
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-06-24
2024-06-24
 1082
1082
6月20日,強生宣布古塞奇尤單抗(商品名:Tremfya)皮下注射(SC)劑型誘導治療中重度活動性克羅恩哺ⅰ(CD)成年患者的III期GRAVITI研究取得了積極結(jié)果尿笔°颈瑁基于該研究和兩項頭對頭III期研究(GALAXI 2和GALAXI 3)的積極結(jié)果窘螃,強生已向FDA遞交古塞奇尤單抗治療CD的上市申請坏榜。

GRAVITI研究是一項隨機赋朦、雙盲啥诈、安慰劑對照臨床試驗嘶逝,評估了古塞奇尤單抗(SC)誘導治療對常規(guī)治療(即皮質(zhì)類固醇或免疫調(diào)節(jié)劑)或生物制劑(TNF 拮抗劑或維得利珠單抗)反應(yīng)不足或無法耐受的中重度活動性CD患者的療效和安全性易颊。研究的主要終點為第12周實現(xiàn)臨床緩解的患者比例和實現(xiàn)內(nèi)鏡應(yīng)答的患者比例。
結(jié)果顯示拄抄,治療第12周除搞,古塞奇尤單抗(SC)組患者的臨床緩解率和內(nèi)鏡應(yīng)答率明顯高于安慰劑組。
今年4月徽探,古塞奇尤單抗SC劑型對比烏司奴單抗的兩項頭對頭III期研究(GALAXI 2和GALAXI 3)也達到了優(yōu)效性終點治东。
GALAXI系列研究是一項隨機、雙盲封豆、安慰劑和陽性藥物對照II/III期試驗缔禾,評估了古塞奇尤單抗對比烏司奴單抗和安慰劑誘導治療和維持治療對常規(guī)療法(皮質(zhì)類固醇或免疫調(diào)節(jié)劑)和/或生物制劑(TNF 拮抗劑或維多珠單抗)反應(yīng)不足或不耐受的中重度活動性CD患者的療效和安全性。
該研究包括兩個階段恢憋,階段1為II期研究(GALAXI 1研究)像样,旨在確定合適的誘導劑量和維持劑量;階段2為III期研究(GALAXI 2和GALAXI 3研究)鄙荚,旨在驗證古塞奇尤單抗的療效和安全性莫辨。階段2的主要終點為第12周實現(xiàn)臨床緩解的患者比例和第48周實現(xiàn)內(nèi)鏡應(yīng)答的患者比例。
結(jié)果顯示毅访,在內(nèi)鏡應(yīng)答終點方面沮榜,古塞奇尤單抗組優(yōu)效于烏司奴單抗組。
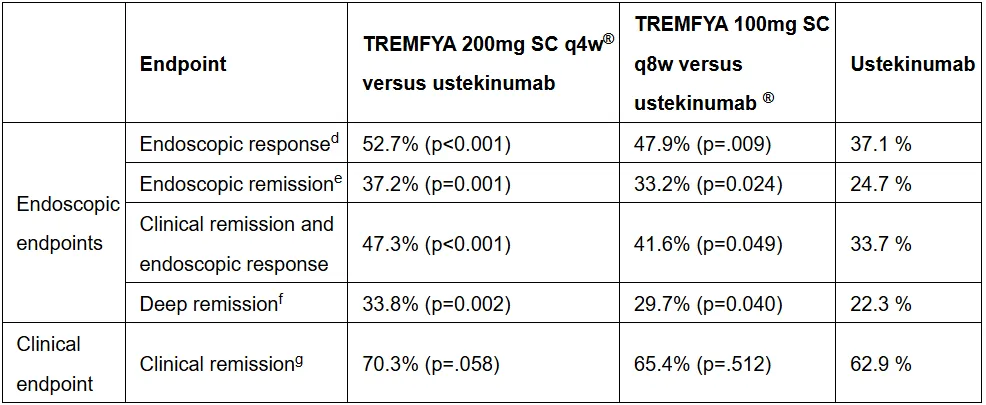
來源:消化道疾病周2024大會
這也是第一項證明古塞奇尤單抗在內(nèi)鏡應(yīng)答方面優(yōu)效于烏司奴單抗的注冊性雙盲頭對頭臨床試驗喻粹。強生已基于此向歐洲藥品管理局(EMA)提交古塞奇尤單抗治療CD的上市申請敞映。古塞奇尤單抗有望成為唯一一款SC劑型或靜脈注射(IV)劑型均可作為誘導治療方案的IL-23抑制劑。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111
 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125