
 研發(fā)追蹤
研發(fā)追蹤
 RNA前沿
RNA前沿  2024-07-01
2024-07-01
 925
925
2024年6月24日寇钉,Alnylam Pharmaceuticals宣布了其HELIOS-B 3期臨床研究的積極頂線結(jié)果钟助,該研究針對的是vutrisiran俭令,這是一種用于治療伴有心肌病的ATTR淀粉樣變性 (ATTR-CM) 的在研RNAi治療藥物翩赐。
該研究達(dá)到了主要終點冯遂,表明在雙盲期間巩樟,總體人群 (HR 0.718斑永,p值 0.0118性谬;n=654) 和單藥治療人群 (基線時未接受他法米迪治療的患者灌次;HR 0.672,p 值 0.0162连嘹;n=395) 的全因死亡率和復(fù)發(fā)性心血管 (CV) 事件的綜合發(fā)生率均顯著降低颈有。
研究還顯示,總體和單藥治療人群的所有次要終點均有顯著改善。這包括疾病進(jìn)展的關(guān)鍵指標(biāo):6 分鐘步行測試 (6-MWT)吁沉、堪薩斯城心肌病問卷 (KCCQ) 和第 30 個月的紐約心臟協(xié)會 (NYHA) 分級 (所有 p<0.025)衣式。重要的是,使用 vutrisiran 治療還降低了總體人群 (HR 0.645檐什,p<0.025) 和單藥治療人群 (HR 0.655碴卧,p<0.05) 的全因死亡率,直至第 42 個月乃正。這是一項預(yù)先指定的意向治療分析住册,包括開放標(biāo)簽擴(kuò)展中長達(dá)六個月的數(shù)據(jù)。
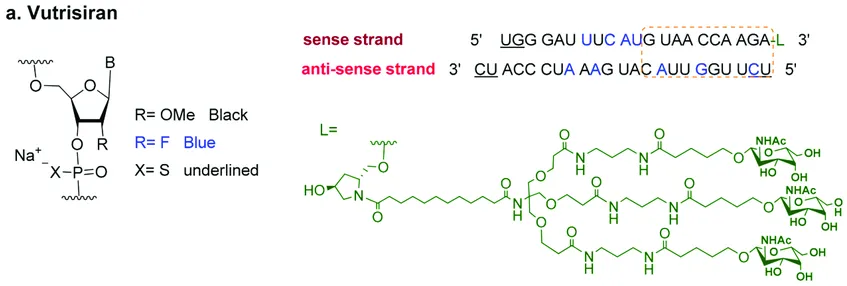
Vutrisiran的化學(xué)結(jié)構(gòu)此外烫葬,vutrisiran 對所有關(guān)鍵亞組的主要綜合終點和所有次要終點均表現(xiàn)出一致的效果界弧,包括基線 tafamidis 使用情況、ATTR 疾病類型和疾病嚴(yán)重程度測量搭综。
在 HELIOS-B 研究中垢箕,vutrisiran表現(xiàn)出令人鼓舞的安全性和耐受性,與其既定特性一致兑巾。vutrisiran組和安慰劑組的不良事件 (AE)条获、嚴(yán)重AE和導(dǎo)致研究藥物停藥的AE發(fā)生率相似。與安慰劑組相比蒋歌,vutrisiran組的AE發(fā)生率未見≥3%罪焰。
HELIOS-B (NCT: NCT04153149) 是一項3期、隨機(jī)风承、雙盲暴喂、安慰劑對照的多中心全球研究,旨在評估vutrisiran在總體和單一治療人群中降低全因死亡率和復(fù)發(fā)性心血管事件(作為主要綜合終點)對ATTR淀粉樣變性心肌病患者的療效和安全性家漂。該研究隨機(jī)選擇了655名患有ATTR淀粉樣變性(遺傳性或野生型)心肌病的成年患者霜售。患者按1:1的比例隨機(jī)分配接受vutrisiran 25mg或安慰劑皮下注射斯癞,每三個月一次矿退,雙盲治療期長達(dá)36個月。雙盲期結(jié)束后板薛,所有符合條件的剩余研究患者均可在開放標(biāo)簽延長期內(nèi)接受vutrisiran治療跪篷。
Alnylam計劃2024年底開始進(jìn)行全球監(jiān)管提交,包括使用優(yōu)先審查憑證向美國食品藥品管理局提交補(bǔ)充新藥申請石葫。
英文鏈接:https://investors.alnylam.com/press-release?id=28231

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊