
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識(shí)林
識(shí)林  2024-07-01
2024-07-01
 354
354
在6月25日這一天CDE同時(shí)發(fā)布了兩份臨床藥理學(xué)方面的文件矫限,即《肽類(lèi)藥物臨床藥理學(xué)研究技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》和《細(xì)胞治療產(chǎn)品臨床藥理學(xué)研究技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》鸵安。無(wú)獨(dú)有偶,F(xiàn)DA也剛在6月15日定稿Clinical Pharmacology Considerations for the Development of Oligonucleotide Therapeutics(《開(kāi)發(fā)寡核苷酸療法的臨床藥理學(xué)考慮因素》)避归。
臨床藥理學(xué)研究
臨床藥理學(xué)研究是創(chuàng)新藥上市前臨床研究不可缺失的研究?jī)?nèi)容,其結(jié)果是支持探索性和確證性臨床研究設(shè)計(jì)和上市申請(qǐng)的重要科學(xué)依據(jù)。過(guò)去的臨床藥理學(xué)研究多局限于臨床藥代動(dòng)力學(xué)研究梳毙,但近些年已開(kāi)始轉(zhuǎn)向?yàn)閷?chuàng)新藥的劑量哺窄、暴露量、生物標(biāo)志物账锹、臨床終點(diǎn)(包括有效性和安全性終點(diǎn))等多維度因素進(jìn)行量化分析萌业。
在監(jiān)管方發(fā)布的指導(dǎo)原則上,也呈現(xiàn)出對(duì)臨床藥理學(xué)研究的關(guān)注度的變化趨勢(shì)奸柬。以CDE為例生年,過(guò)往發(fā)布的臨床研究的指導(dǎo)原則多數(shù)都是以臨床試驗(yàn)技術(shù)為主題,大部分關(guān)注在試驗(yàn)的分組設(shè)計(jì)鸟缕、安全性/有效性評(píng)估等方面晶框。雖然也會(huì)涉及到劑量等因素,但這些指導(dǎo)原則并未全面系統(tǒng)地對(duì)臨床藥理學(xué)研究的各方面給出指導(dǎo)意見(jiàn)懂从。而首次完全以“臨床藥理學(xué)研究”為主題的指導(dǎo)原則是2020年才出現(xiàn)授段,之后大約以一年一份的速度出現(xiàn)臨床藥理學(xué)研究的指導(dǎo)原則。目前已公布的指導(dǎo)原則如下
2020-12-31 兒科用藥臨床藥理學(xué)研究技術(shù)指導(dǎo)原則
2021-12-20 創(chuàng)新藥臨床藥理學(xué)研究技術(shù)指導(dǎo)原則
2022-02-11 生物類(lèi)似藥臨床藥理學(xué)研究技術(shù)指導(dǎo)原則
2024-02-04 化學(xué)藥改良型新藥臨床藥理學(xué)研究技術(shù)指導(dǎo)原則(試行)
但可以看到番甩,已有的四份臨床藥理學(xué)研究指導(dǎo)原則都還是適用于對(duì)大類(lèi)別產(chǎn)品的指南悄函,側(cè)重于通用性。雖然也可以對(duì)從事CGT磅芬、單抗山顶、核酸藥物等新型技術(shù)產(chǎn)品的企業(yè)提供一些幫助,但由于各產(chǎn)品的特殊性着癞,企業(yè)還是會(huì)感到有諸多困惑好员,繼而希望有產(chǎn)品特異性的臨床藥理學(xué)研究指導(dǎo)原則出現(xiàn)。
如今發(fā)布的細(xì)胞治療產(chǎn)品和肽類(lèi)藥物的臨床藥理學(xué)研究指導(dǎo)原則的征求意見(jiàn)稿便充分滿(mǎn)足了這兩類(lèi)產(chǎn)品的企業(yè)當(dāng)前的需求役霍。從內(nèi)容看略尘,這兩份指導(dǎo)原則也的確考慮到了產(chǎn)品的特殊性。雖然都是臨床藥理學(xué)研究的指南磷尊,但是在關(guān)注內(nèi)容上也存在差異怯漾。

細(xì)胞產(chǎn)品的特異性要求
細(xì)胞治療產(chǎn)品的指導(dǎo)原則的一大特色是考慮到免疫細(xì)胞產(chǎn)品和干細(xì)胞產(chǎn)品的性質(zhì)差異,在各研究項(xiàng)目下都體現(xiàn)特異性豹女,做到了對(duì)細(xì)分類(lèi)型產(chǎn)品的具體要求摹削。其中的一些描述已觸及到細(xì)胞治療產(chǎn)品企業(yè)當(dāng)前較為疑惑的問(wèn)題,摘錄如下:
1. 首次用于人體的細(xì)胞治療產(chǎn)品通常采用單次給藥拷肌,僅當(dāng)有足夠的證據(jù)提示安全性風(fēng)險(xiǎn)較低且多次給藥可能增加獲益時(shí)到旦,在早期試驗(yàn)中可考慮采用多次給藥的方式。
2. 鑒于已有研究表明巨缘,CAR-T 產(chǎn)品的劑量與暴露量之間的相關(guān)性較弱添忘,因此可能不適合像傳統(tǒng)治療藥物那樣進(jìn)行劑量?jī)?yōu)化契沫。
3. 根據(jù)細(xì)胞動(dòng)力學(xué)特征分段描述的經(jīng)驗(yàn)性非線(xiàn)性混合效應(yīng)(NLME)模型可用于表征細(xì)胞動(dòng)力學(xué)特征并篩選影響暴露的關(guān)鍵協(xié)變量。
4. 適宜的細(xì)胞動(dòng)力學(xué)參數(shù)可表征細(xì)胞在體內(nèi)各階段的特征昔汉,可以通過(guò)非房室分析(NCA)或群體藥代動(dòng)力學(xué)(PopPK)等方法來(lái)計(jì)算細(xì)胞動(dòng)力學(xué)參數(shù)。
5. 通常情況下拴清,細(xì)胞治療產(chǎn)品不需要開(kāi)展物質(zhì)平衡研究靶病。
6. 改良毒性概率區(qū)間(mTPI)和貝葉斯最優(yōu)區(qū)間(BOIN)等方法可能比傳統(tǒng)“3+3” 設(shè)計(jì)具有更高的研究效率,同時(shí)盡可能降低安全性風(fēng)險(xiǎn)口予。
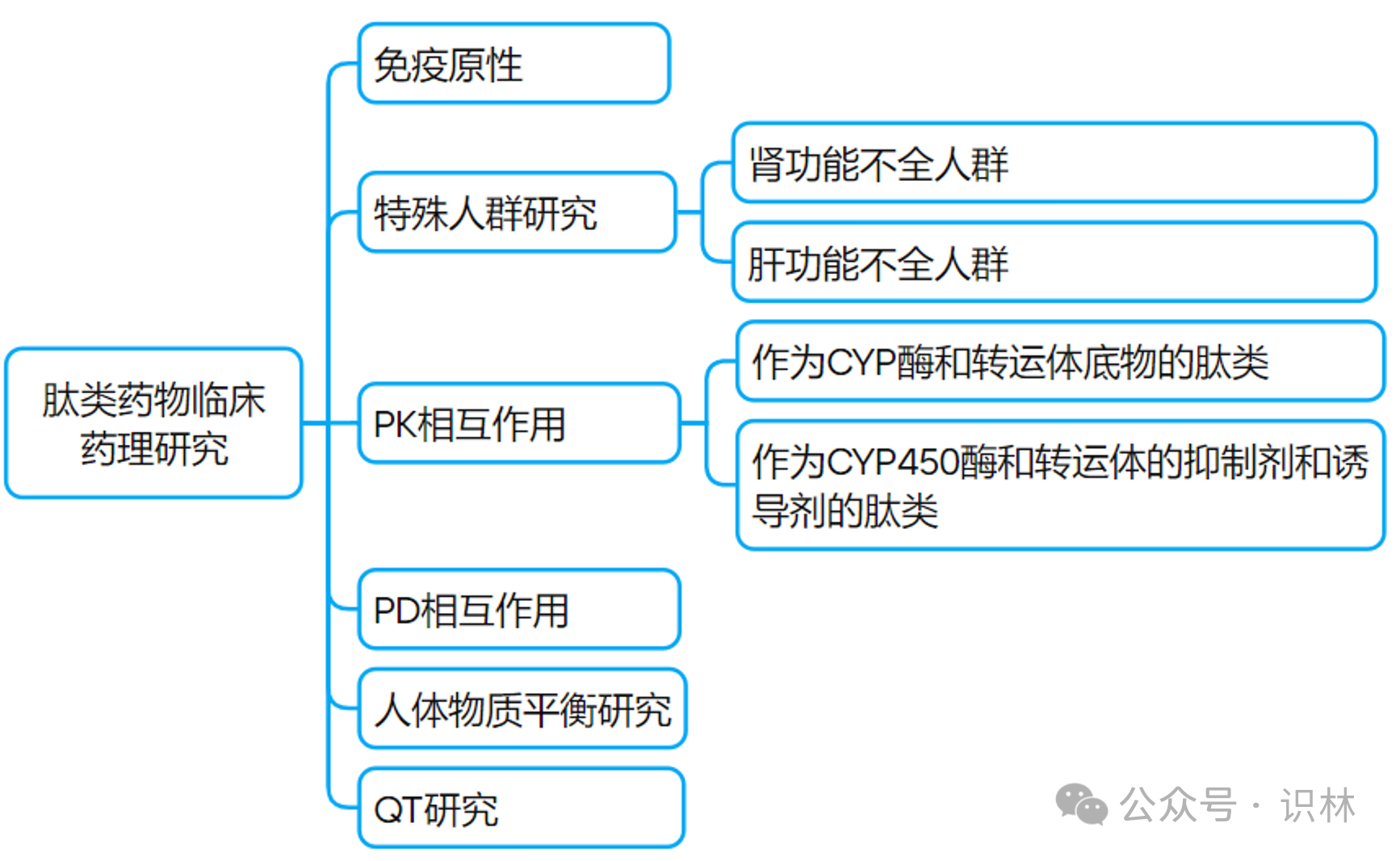
肽類(lèi)藥物的特異性要求
該文件適用的肽類(lèi)藥物主要包括純天然氨基酸的肽以及常規(guī)修飾氨基酸的肽娄周、聚乙二醇修飾肽、脂肪鏈修飾肽等沪停,但不包括放射性核素偶聯(lián)藥物等偶聯(lián)其他基因的肽類(lèi)煤辨。
相較于細(xì)胞治療產(chǎn)品,肽類(lèi)藥物的臨床藥理研究相對(duì)簡(jiǎn)化盒止,對(duì)藥理學(xué)研究的各研究因素的要求和建議大都是概述性?xún)?nèi)容侥锨。值得關(guān)注的內(nèi)容摘錄如下:
1. 一般來(lái)說(shuō),少于8 個(gè)氨基酸的肽類(lèi)藥物預(yù)期不具免疫原性扑跌,除非存在產(chǎn)品雜質(zhì)或聚合物導(dǎo)致的免疫原性風(fēng)險(xiǎn)扇殃。
2. 當(dāng)肝臟代謝和/或膽汁消除的藥物清除率≥ 總清除率的 25%,和/或藥物的靶器官是肝臟時(shí)创皿,建議提供與 CYP450 和轉(zhuǎn)運(yùn)體相關(guān)的體外研究結(jié)果投戴。
3. 由天然氨基酸組成的肽類(lèi)直接與離子通道產(chǎn)生相互作用的可能性較低,通常不需要開(kāi)展全面 QT 和/或 C-QTc 研究爸蝠。
下一份臨床藥理指南會(huì)是什么品種梢跳?
這兩份指導(dǎo)原則現(xiàn)在還是在征求意見(jiàn)稿,但無(wú)疑對(duì)于從事相應(yīng)類(lèi)別產(chǎn)品的臨床研究人員已經(jīng)有著參考價(jià)值十旗。由于藥物的臨床藥理學(xué)特性是由其藥學(xué)特性決定的仲峡,因此研發(fā)人員在知曉監(jiān)管方對(duì)臨床藥理學(xué)的關(guān)注點(diǎn)后也可以反向調(diào)整在藥學(xué)研究中的一些動(dòng)作。例如調(diào)整對(duì)細(xì)胞分群的檢測(cè)要求笑驶。因此可以預(yù)見(jiàn)的是這兩份指導(dǎo)原則在定稿后职颜,對(duì)進(jìn)行早期開(kāi)發(fā)的研發(fā)人員也會(huì)有著指導(dǎo)作用,
而對(duì)其他產(chǎn)品類(lèi)別的從業(yè)人員嫌变,如基因治療產(chǎn)品吨艇、小核酸藥物(已有FDA定稿指南可供參考)等的研發(fā)和臨床研究人員,更值得期待的是或許會(huì)有相應(yīng)類(lèi)別產(chǎn)品的臨床藥理學(xué)研究的指導(dǎo)原則逐漸出現(xiàn)腾啥。這些原則也將為產(chǎn)品的研發(fā)和臨床試驗(yàn)提供更多的建議和要求东涡,助力產(chǎn)品的更快推進(jìn)。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 20
20

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 24
24

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 23
23
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽