
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Insight數(shù)據(jù)庫(kù)
Insight數(shù)據(jù)庫(kù)  2024-07-04
2024-07-04
 381
381
7 月 2 日泽艘,禮來宣布,其在研新一代抗 Aβ 單抗 Donanemab 獲 FDA 批準(zhǔn)上市晚沙,用于治療早期癥狀性阿爾茨海默猜浴(AD)怒随,包括 AD 所致的輕度認(rèn)知障礙以及輕度 AD颠焦。

來自:禮來官網(wǎng)
這個(gè)好消息也在意料之中嚎姨。6 月 10 日更掺,F(xiàn)DA 外周和中樞神經(jīng)系統(tǒng)藥物咨詢委員會(huì)(PCNS)就禮來 Donanemab 用于治療早期癥狀性阿爾茨海默残印(AD)患者「是否有效」以及「獲益是否大于風(fēng)險(xiǎn)」鸣丝,進(jìn)行了投票,均以 11 贊成融沟、0 反對(duì)的結(jié)果全票通過瘪巡。
Donanemab 是一種靶向 N3pG (修飾化 β 淀粉樣蛋白斑塊)的在研抗體藥物,這是淀粉樣蛋白的一個(gè)亞型。通過與其結(jié)合佳珊,Donanemab 可促進(jìn)淀粉樣斑塊的清除揉民。
Donanemab 最初在 2021 年 10 月向 FDA 遞交上市申請(qǐng),基于 II 期臨床試驗(yàn) TRAILBLAZER-ALZ听公。這項(xiàng)注冊(cè)臨床數(shù)據(jù)在 2021 年 5 月發(fā)布在 NEJM鼎嫉,主要終點(diǎn)為患者從基線到 76 周時(shí)的 iDARs 評(píng)分變化。
當(dāng)時(shí)周伦,首款 Aβ 單抗 Aducanumab 剛剛在年中獲批夕春,引起行業(yè)轟動(dòng),禮來與衛(wèi)材专挪、羅氏一同及志,正是這一賽道中最受看好的選手之一。
2021 年下半年寨腔,禮來動(dòng)作迅速速侈,先是啟動(dòng)頭對(duì)頭研究正面對(duì)決 Aducanumab,再是緊隨衛(wèi)材遞交加速批準(zhǔn) BLA迫卢,新建神經(jīng)科學(xué)部門倚搬、任命前腫瘤學(xué)總裁 Anne White 擔(dān)任負(fù)責(zé)人……不過 Aducanumab 的商業(yè)化「死亡」,特別是 CMS 拒付乾蛤,給幾家領(lǐng)頭企業(yè)澆了一盆冷水潭枣。23 年 1 月,F(xiàn)DA 又以患者數(shù)量不足的原因幻捏,發(fā)出了 CRL。
不過帅唬,III 期臨床 TRAILBLAZER-ALZ 2 研究成功給禮來一針強(qiáng)心劑故弟。基于此噪怜,23 年 Q2 禮來再次向 FDA 提交了 Donanemab 的新藥上市申請(qǐng)(BLA)又蝌,近日終于取得最終勝利。
TRAILBLAZER-ALZ 2 研究(登記號(hào):NCT04437511)是一項(xiàng)隨機(jī)予售、雙盲场致、安慰劑對(duì)照 III 期臨床研究,旨在評(píng)估 Donanemab 在早期癥狀性阿爾茨海默病患者中的有效性和安全性湿斩。參與者根據(jù)受試者的 tau 蛋白水平進(jìn)行分層籍投,tau 蛋白是阿爾茨海默病進(jìn)展的預(yù)測(cè)生物標(biāo)志物。
結(jié)果顯示忧埠,在中低 tau 水平的受試者中(n=1182)圣烤,主要終點(diǎn)指標(biāo) iADRS 顯示 Donanemab 延緩了認(rèn)知功能下降達(dá) 35%(p<0.0001),以及另一重要的關(guān)鍵指標(biāo) CDR-SB 評(píng)分顯示 Donanemab 延緩了患者認(rèn)知功能下降 36%(p <0.0001);在所有受試者(n=1736)中喘建,分別下降 22% 和 29%显驼。且無論疾病基線和病理階段如何,與安慰劑相比坯临,Donanemab 都能帶來認(rèn)知和功能益處焊唬。
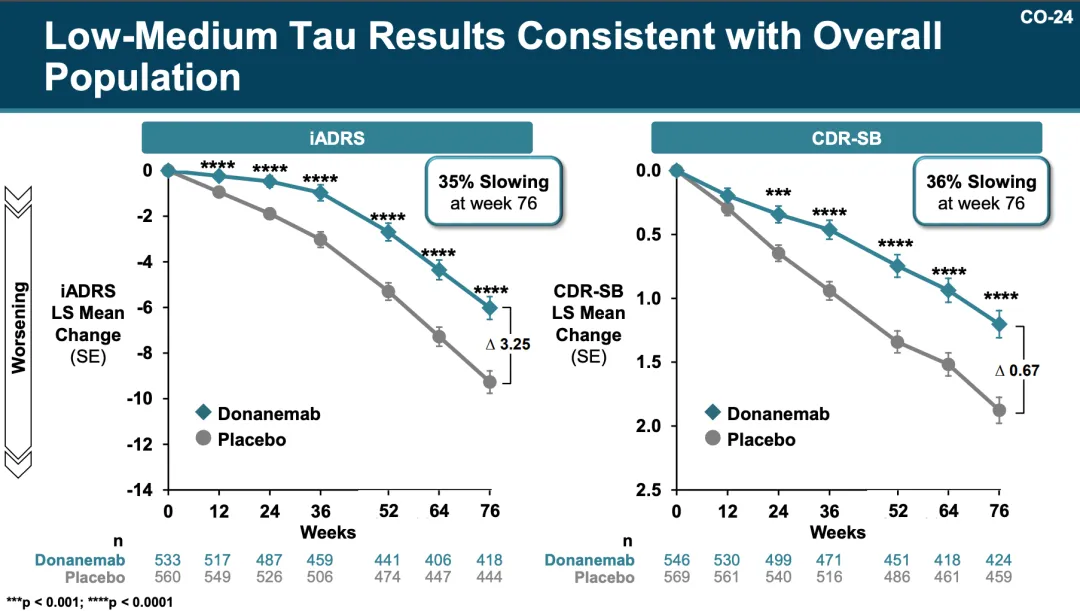

來自:FDA 官網(wǎng)資料(下文如無特殊標(biāo)注,為同一來源)
Donanemab 也將患者疾病進(jìn)展至下一階段的風(fēng)險(xiǎn)降低了 37% (HR=0.626; p<0.0001)看靠。

在 CDR-SB 方面赶促,不同亞組中,同樣可觀察到一致的獲益趨勢(shì)衷笋。

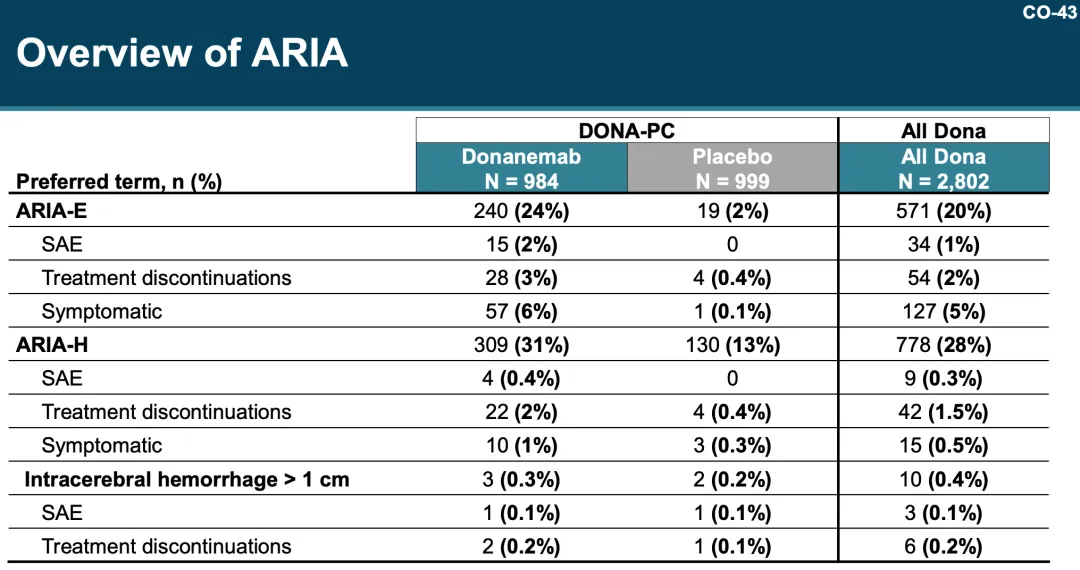
安全性方面芳杏,Donanemab 組 89% 患者出現(xiàn)不良事件(AE)(vs 安慰劑組 83%),常見 AE 包括淀粉樣蛋白相關(guān)成像異常-水腫/積液(ARIA-E)(24%)辟宗、淀粉樣蛋白相關(guān)成像異常-微出血以及和含鐵血黃素沉積(ARIA-H)(18%)爵赵、COVID-19(14%)等。

接受 Donanemab 治療的患者中泊脐,24% 出現(xiàn) ARIA-E空幻,31% 出現(xiàn) ARIA-H,其中大多數(shù)屬于輕度至中度容客。此外秕铛,有觀察到嚴(yán)重 ARIA,包括出現(xiàn)患者死亡蛙途;1.5% 患者出現(xiàn)嚴(yán)重 ARIA-E讯完,0.4% 嚴(yán)重 ARIA-H。

據(jù) Insight 數(shù)據(jù)庫(kù)顯示汤袭,當(dāng)前阿爾茨海默病治療藥物的研發(fā)于扳,仍在高峰期。不過目前主要參與者仍是海外藥企席栅。
從國(guó)內(nèi)維度來看炸穿,衛(wèi)材/渤健的 Lecanemab 剛于今年 1 月在國(guó)內(nèi)獲批上市;禮來的 Donanemab 也在去年 10 月申報(bào)上市署霸。國(guó)產(chǎn)企業(yè)中暖鬓,當(dāng)前恒瑞以及康諾亞布局的 Aβ 單抗進(jìn)入臨床階段,恒瑞 SHR-1707 正在開展 II 期臨床赠魂,預(yù)計(jì)明年 4 月完成主要指標(biāo)(登記號(hào):NCT06199037)麸档;而康諾亞 CM-383 則剛于 6 月初完成 I 期臨床的首例受試者入組工作(登記號(hào):CTR20241658)。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 16
16

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 20
20

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 18
18
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽