
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-07-04
2024-07-04
 1700
1700
2024年3月慷啊,美國FDA接受了在研療法revumenib的新藥上市申請(qǐng)愕炸,并授予其優(yōu)先審評(píng)資格纸级,用于治療攜帶KMT2A重排的復(fù)發(fā)/難治性急性白血病患者脐炼。公開資料顯示吏颖,revumenib是全球首款申報(bào)上市的Menin抑制劑歼冰,代表著白血病藥物研發(fā)領(lǐng)域的一項(xiàng)重大進(jìn)展。該進(jìn)展也引發(fā)了業(yè)界對(duì)于Menin這一靶點(diǎn)在白血病治療領(lǐng)域潛力和前景的關(guān)注和討論剧腻。
白血病是一種惡性血液病工划,是威脅人類生命的常見癌癥之一滑信。根據(jù)病情惡化的速度,白血病可分為“急性白血病”和“慢性白血病”兩大類恒左。而根據(jù)出現(xiàn)病變的血細(xì)胞來源煞恭,白血病又被分為“髓系白血病”、“淋巴細(xì)胞白血病”等等匠似。過去幾十年中臊吓,盡管白血病的治療取得了巨大進(jìn)展,但由于白血病種類較多暗沉,即便是同一種白血病,也有很多不同的亞型讹玉,因此白血病患者仍存在巨大的未滿足治療需求里淡。
當(dāng)前,科學(xué)家們也在探索開發(fā)治療白血病的新療法挡辩,Menin就是備受關(guān)注的新靶點(diǎn)之一谎跨。盡管目前全球尚無Menin抑制劑獲批上市,但已有多款Menin抑制劑在研產(chǎn)品進(jìn)入臨床開發(fā)垃杖。那么男杈,Menin蛋白與白血病之間到底有何聯(lián)系?全球范圍內(nèi)Menin抑制劑的開發(fā)現(xiàn)狀是怎樣的调俘?它們又有望惠及哪些白血病患者伶棒?本文中就讓我們一起來了解下。
——?Menin蛋白:白血病治療領(lǐng)域的新靶點(diǎn)?——
談起Menin蛋白與白血病的關(guān)系彩库,與兩個(gè)基因的變異密不可分肤无。
其一是KMT2A基因(以前稱為混合譜系白血病 [MLL])重排。根據(jù)文獻(xiàn)報(bào)道骇钦,約80%的嬰兒急性淋巴細(xì)胞白血餐鸾ァ(ALL)和5%~15%的兒童和成人急性白血病患者會(huì)發(fā)生賴氨酸甲基轉(zhuǎn)移酶2A (KMT2A)重排[2]。KMT2A基因重排白血病的特征是HOX基因及其輔因子MEIS1的異常過表達(dá)眯搭。攜帶KMT2A基因重排的急性白血病患者通常預(yù)后較差窥翩,5年總生存率不到25%。
其二則是NPM1突變鳞仙。核磷蛋白1基因(NPM1)突變發(fā)生在高達(dá)約30%的急性白血病中寇蚊,是急性髓系白血病(AML)患者中最常見的基因變異堆嘿。NPM1基因突變型AML亞群患者的基因表達(dá)譜與KMT2A基因重排的白血病相似羞条,都有HOX基因(特別是HOXA和MEIS1)上調(diào)的現(xiàn)象。
研究表明氏走,KMT2A基因重排和NPM1基因突變會(huì)導(dǎo)致血細(xì)胞退化或去分化资妇,并表現(xiàn)得像它們起源于的干細(xì)胞一樣,這會(huì)導(dǎo)致造血分化阻滯和白血病轉(zhuǎn)化,而這一過程則依賴于由MEN1基因編碼的Menin蛋白水矢。Menin蛋白會(huì)與KMT2A產(chǎn)生的蛋白質(zhì)相結(jié)合烂秘,這些蛋白質(zhì)形成的復(fù)合物反過來與染色質(zhì)結(jié)合,并開啟由突變的KMT2A或NPM1基因觸發(fā)的異常信號(hào)通路巩顶。
研究顯示裳雕,AML對(duì)Menin蛋白的依賴與HOXA和/或HOXB基因及其輔因子MEIS1的過度表達(dá)有關(guān)。除了NPM1突變和KMT2A基因重排白血病外日病,其他白血病基因型或復(fù)發(fā)性細(xì)胞遺傳學(xué)異常也具有這種表達(dá)特征帜浇。因此,基于Menin-KMT2A相互作用開發(fā)的Menin抑制劑被認(rèn)為是一種治療白血病的有前景的新療法秦辆,尤其是對(duì)那些攜帶KMT2A基因重排或NPM1基因突變的AML患者项茸。
——?Menin抑制劑的開發(fā)?——
根據(jù)文獻(xiàn)報(bào)道,第一種小分子Menin抑制劑于2012年被開發(fā)出來梦重,并在KMT2A基因重排白血病和NPM1突變AML模型中顯示了臨床前活性兑燥。羥甲基和氨甲基哌啶化合物代表了第一代Menin-KMT2A相互作用的小分子抑制劑,一系列羥甲基和氨甲基哌啶化合物被測試用于治療各種惡性腫瘤琴拧。雖然這些化合物表現(xiàn)出了很強(qiáng)的抑制活性降瞳,但它們較差的代謝穩(wěn)定性限制了體內(nèi)藥效學(xué)研究的進(jìn)一步開展。
隨著研究的進(jìn)行蚓胸,研究人員又鑒定出了一類新型小分子抑制劑(噻吩并嘧啶類抑制劑)挣饥,它們具有良好的口服生物利用度和較強(qiáng)的靶標(biāo)結(jié)合活性,被稱為第二代Menin抑制劑赢织。研究表明亮靴,這些Menin抑制劑表現(xiàn)出了良好的生物活性,沒有造血功能損害于置,在小鼠中沒有明顯的組織和器官毒性茧吊。
大環(huán)肽樣類抑制劑是研究人員基于Menin-KMT2A的相互作用開發(fā)而來,這類抑制劑通常擁有較低的分子量八毯。在此基礎(chǔ)上搓侄,研究人員又通過優(yōu)化開發(fā)了Menin-KMT2A抑制劑,并于2020年首次在急性白血病中開展了臨床試驗(yàn)[1]予乏。
公開資料顯示偿寥,目前全球范圍內(nèi)尚未有Menin抑制劑獲批上市,但已有不少M(fèi)enin抑制劑管線正在開發(fā)中蟹游,其中有些已進(jìn)入到臨床階段填级,進(jìn)展最快的已經(jīng)向FDA申請(qǐng)上市。
臨床研究階段的Menin抑制劑管線
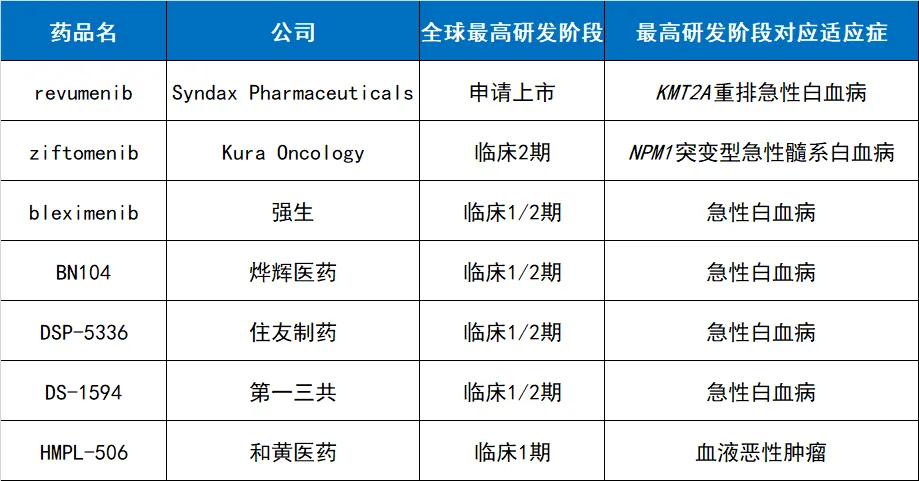
注:本表由《醫(yī)藥觀瀾》根據(jù)公開資料梳理蔓捡,為不完全統(tǒng)計(jì)怜人,如有遺漏愚缔,歡迎補(bǔ)充
Syndax公司:revumenib
Revumenib是Syndax公司正在研發(fā)的一種針對(duì)Menin-KMT2A相互作用的強(qiáng)效、選擇性小分子抑制劑癌羞。Nature雜志曾于2023年3月在線發(fā)表兩篇文章介紹該產(chǎn)品及其首次人體研究數(shù)據(jù)垛淮,并表示這些數(shù)據(jù)確立了Menin抑制劑作為易感急性白血病亞型的治療策略。2024年3月豌富,Syndax公司宣布該產(chǎn)品的新藥申請(qǐng)(NDA)獲FDA授予優(yōu)先審評(píng)資格根适,用于治療攜帶KMT2A重排的復(fù)發(fā)/難治性急性白血病患者。該申請(qǐng)的PDUFA日期為2024年9月26日铅乡。
在治療攜帶KMT2A重排的急性白血病人群的關(guān)鍵臨床試驗(yàn)(AUGMENT-101)中继谚,57名可評(píng)估患者中有23%達(dá)到完全緩解(CR)或帶部分血液學(xué)恢復(fù)的完全緩解(CRh)。在達(dá)到CR/CRh且進(jìn)行了最小殘留猜∨小(MRD)評(píng)估的患者中犬庇,70%的患者M(jìn)RD為陰性。患者中的總緩解率(ORR)達(dá)到63%侨嘀。82%的納入安全性分析的受試者報(bào)告了治療相關(guān)不良事件(TRAEs)。51名患者(54%)觀察到≥3級(jí)TRAE捂襟,最常見的是分化綜合征(DS)咬腕、發(fā)熱性中性粒細(xì)胞減少癥和QTc(按心率校正的QT間期)延長≡岷桑總體而言涨共,6%的患者因TRAE而停止治療,沒有由于DS或QTc延長引起的治療中斷宠漩。
此外举反,revumenib治療NPM1突變AML患者的關(guān)鍵試驗(yàn)隊(duì)列已完成入組,Syndax公司預(yù)計(jì)在2024年第四季度公布該研究的頂線數(shù)據(jù)扒吁,于2025年上半年提交新適應(yīng)癥上市申請(qǐng)火鼻。該產(chǎn)品此前已被FDA和歐洲委員會(huì)授予孤兒藥資格,用于治療AML患者邀耽;并被FDA授予快速通道資格穗蚌,用于治療攜帶KMT2A重排或NPM1突變的成人和兒科復(fù)發(fā)/難治性急性白血病患者。
Kura Oncology:ziftomenib
Ziftomenib為Kura Oncology公司在研療法平葡,為一種針對(duì)Menin-KMT2A蛋白復(fù)合體之間相互作用的候選藥物崭守。該在研新藥曾被獵藥人網(wǎng)站列為2022年度10大“明星”小分子之一。目前宗而,該產(chǎn)品單藥治療NPM1突變型AML患者正處于2期注冊(cè)性臨床研究階段浙辫。2024年4月,Kura公司宣布ziftomenib已經(jīng)獲得FDA授予的突破性療法認(rèn)定攻躏,用于治療攜帶NPM1基因突變的復(fù)發(fā)/難治性AML患者郊檐。
根據(jù)2022年ASH大會(huì)公布的1期研究數(shù)據(jù)玩捉,ziftomenib表現(xiàn)出令人鼓舞的安全性和耐受性,作為單藥治療在每日600mg劑量下活性最佳俯坐,在20例NPM1突變型復(fù)發(fā)/難治AML患者中觀察到30%的完全緩解率噩拼。然而,雖然在KMT2A重排患者也中觀察到有意義的臨床獲益寺晌,但分化綜合征的副作用使大多數(shù)患者無法接受足夠的治療來達(dá)到CR/CRh的緩解標(biāo)準(zhǔn)世吨。對(duì)于KMT2A重排AML患者,Kura公司表示將進(jìn)一步開發(fā)ziftomenib與化療的聯(lián)合療法呻征。
今年1月公布的聯(lián)合療法數(shù)據(jù)顯示耘婚,ziftomenib與標(biāo)準(zhǔn)治療方法,包括阿糖胞苷/柔紅霉素(7+3)和venetoclax/阿扎胞苷(ven/aza)聯(lián)合使用表現(xiàn)出令人鼓舞的安全性和耐受性陆赋,可以在降低分化綜合征風(fēng)險(xiǎn)的同時(shí)持續(xù)給藥沐祷。其中,所有新診斷的AML患者接受ziftomenib和7+3治療均達(dá)到完全緩解(CR)攒岛,計(jì)數(shù)完全恢復(fù)赖临,CR率為100%(5/5),其中包括4例NPM1突變AML患者和1例KMT2A重排AML患者灾锯。
強(qiáng)生(Johnson & Johnson):JNJ-75276617
Bleximenib(JNJ-75276617)是Menin-KMT2A相互作用抑制劑兢榨。在2023年11月,強(qiáng)生曾在國際期刊Blood上公布了JNJ-75276617單藥治療KMT2A或NPM1變異的復(fù)發(fā)/難治性急性白血病成人患者的首次人體1期研究結(jié)果顺饮。

安全性數(shù)據(jù)顯示吵聪,30 例患者出現(xiàn)≥1次治療相關(guān)不良反應(yīng)(TRAE),最常見的是分化綜合征 (DS)沿阁。5例患者出現(xiàn)劑量限制性毒性 (DLT)嫌盲。有效性數(shù)據(jù)顯示,在41例有疾病評(píng)估數(shù)據(jù)的患者中铆贞,26例患者的骨髓疾病負(fù)擔(dān)減輕赐赁。其中,16例患者的骨髓原始細(xì)胞減少≥50%桶邑。在最高劑量水平下画眯,≥3名患者(90 mg BID;n=8)的ORR為50%务囤。在對(duì)≥3例患者(≥45 mg BID灌当;n=20)的更高劑量水平的評(píng)估中,ORR為40%幅挂,7名應(yīng)答者在治療中京球。該研究認(rèn)為:JNJ-75276617單藥療法具有可接受的安全性、令人鼓舞的抗白血病活性腺帽。
在2024年6月舉行的EHA年會(huì)上怎晰,研究人員還報(bào)告了JNJ-75276617聯(lián)合venetoclax和阿扎胞苷治療伴有KMT2A重排或NPM1突變的復(fù)發(fā)/難治性急性髓系白血病的1b期研究結(jié)果髓绽。安全性數(shù)據(jù)顯示,87%(39/45)的患者至少經(jīng)歷一次TRAE妆绞,以惡心顺呕、嘔吐和血小板減少最為常見。60%的患者觀察到≥3級(jí)TRAE括饶,22%的患者觀察到單獨(dú)歸因于JNJ-75276617的TRAEs株茶。迄今為止,尚未報(bào)道分化綜合征(DS)图焰、QTcF延長启盛、腫瘤溶解綜合征(TLS)以及限制性毒性(DLT)。
在JNJ-75276617 BID劑量水平為50mg的療效數(shù)據(jù)集中技羔,ORR(≥PR)為86% (18/21)僵闯,CR/CRh/CRi(即cCR)率為48%,CR/CRh率為24%藤滥。對(duì)于先前有VEN暴露的患者鳖粟,ORR為82%,cCR為36%拙绊,CR/CRh為18%牺弹。療效數(shù)據(jù)集中至首次反應(yīng)的中位時(shí)間為23天,至cCR的中位時(shí)間為52天战架。在所有劑量遞增隊(duì)列中(n=45),9名應(yīng)答者停止治療并繼續(xù)進(jìn)行同種異體移植侦萍,另外11名患者仍在積極治療咸壮,其中1名患者接受研究治療超過12個(gè)月。
燁輝醫(yī)藥:BN104
BN104是燁輝醫(yī)藥首個(gè)自主研發(fā)項(xiàng)目均壳,為一款新型漆究、高選擇性的口服Menin抑制劑。該產(chǎn)品曾獲FDA授予孤兒藥資格和快速通道資格拔翠,分別用于治療AML和復(fù)發(fā)/難治急性白血病钉榔。2023年,該產(chǎn)品相繼在中國和美國獲批IND翅窥,并于2023年10月在中國完成首例患者給藥圣钝。目前,BN104正在1/2期臨床中評(píng)估治療復(fù)發(fā)/難治急性白血病的療效和安全性没惶。目前該藥的1期臨床研究劑量遞增階段已經(jīng)順利結(jié)束肖喂,正在進(jìn)行劑量優(yōu)化來選擇2期推薦劑量。
據(jù)燁輝醫(yī)藥公開資料介紹庆杜,在臨床前研究中射众,BN104展現(xiàn)出了優(yōu)異的療效和明顯更大的安全窗口碟摆。在急性髓系白血病移植瘤的臨床前動(dòng)物模型中,BN104表現(xiàn)出高效的抗癌活性叨橱。在保持治療有效性的同時(shí)對(duì)hERG(一種離子通道)幾乎不存在抑制作用典蜕,且其設(shè)計(jì)旨在避免QTc延長風(fēng)險(xiǎn),具有潛在更好的安全性罗洗。
住友制藥(Sumitomo Pharma):DSP-5336
DSP-5336是住友制藥在研的一款Menin-KMT2A相互作用抑制劑愉舔,目前正在開展針對(duì)復(fù)發(fā)或難治性急性白血病患者的1/2期臨床研究,該產(chǎn)品還曾獲FDA授予用于急性髓性白血病的孤兒藥資格栖博。
今年6月屑宠,住友制藥在歐洲血液學(xué)協(xié)會(huì)(EHA)年會(huì)上口頭報(bào)告了DSP-5336的最新臨床數(shù)據(jù)。在KMT2A重排和NPM1突變的患者中仇让,在劑量為140mg每日兩次或更高時(shí)典奉,兩組中觀察到一致的緩解情況,在共21例研究中心檢測到伴有KMT2A重排或NPM1突變的患者中丧叽,12例(57%)患者獲得客觀緩解卫玖,5例(24%)患者獲得CR/CRh。迄今為止宴忱,DSP-5336仍然具有良好的耐受性辐胆,沒有觀察到劑量限制性毒性。
第一三共(Daiichi Sankyo):DS-1594
DS-1594是第一三共在研的一種有效的選擇性小分子Menin抑制劑巾妇。該產(chǎn)品旨在靶向并破壞Menin和MLL的蛋白-蛋白相互作用卸研,抑制白血病細(xì)胞的生長和增殖。在臨床前研究中哥甲,DS-1594顯示出對(duì)AML和ALL細(xì)胞的選擇性生長抑制多盅,并在AML模型中顯示出穩(wěn)健和持久的抗腫瘤活性,具有可接受的安全性裹耗。目前勤右,研究人員正在開展該產(chǎn)品治療復(fù)發(fā)/難治急性白血病的1/2期臨床研究。
和黃醫(yī)藥:HMPL-506
HMPL-506是一種研究性的新型痘宋、高選擇性靶向Menin蛋白的口服小分子抑制劑虫甲。在今年美國癌癥研究協(xié)會(huì) (AACR)年會(huì)上,和黃醫(yī)藥公布了HMPL-506的初步臨床前數(shù)據(jù)塌瑞。該產(chǎn)品在KMT2A重排和NPM1突變的白血病細(xì)胞系模型中展示出較強(qiáng)的抑制活性辩块,在體外和體內(nèi)試驗(yàn)中與阿扎胞苷、維奈克拉或吉瑞替尼聯(lián)用在KMT2A重排的白血病中均起到協(xié)同抗腫瘤作用神汹。該候選藥物還表現(xiàn)出良好的藥代動(dòng)力學(xué)特征庆捺、高選擇性和低心臟毒性風(fēng)險(xiǎn)。今年6月屁魏,和黃醫(yī)藥宣布啟動(dòng)HMPL-506用于治療血液惡性腫瘤的1期臨床試驗(yàn)滔以。
除了上述產(chǎn)品捉腥,還有一些其它的Menin抑制劑正在開發(fā)中,限于篇幅你画,不再一一介紹抵碟。希望隨著研究的進(jìn)展,Menin抑制劑研究領(lǐng)域能夠取得更多進(jìn)展和突破坏匪,早日為白血病患者帶來更多新的治療選擇拟逮。
參考資料:
[1]Thomas X. (2024)Small Molecule Menin Inhibitors: Novel Therapeutic Agents Targeting Acute Myeloid Leukemia with KMT2A Rearrangement or NPM1 Mutation. Oncol Ther. doi: 10.1007/s40487-024-00262-x.
[2] Issa, G.C., Aldoss, I., DiPersio, J. et al. (2023) The menin inhibitor revumenib in KMT2A-rearranged or NPM1-mutant leukaemia. Nature. https://doi.org/10.1038/s41586-023-05812-3
[3] Di Fazio, P. (2023)Targeting menin: a promising therapeutic strategy for susceptible acute leukemia subtypes. Sig Transduct Target Ther . https://doi.org/10.1038/s41392-023-01627-w
[4]Perner, F., Stein, E.M., Wenge, D.V. et al. (2023) MEN1 mutations mediate clinical resistance to menin inhibition. Nature.https://doi.org/10.1038/s41586-023-05755-9
[5] Syndax Announces FDA Priority Review of NDA for Revumenib for the Treatment of Relapsed/Refractory KMT2Ar Acute Leukemia. Retrieved March 27, 2024, from https://www.prnewswire.com/news-releases/syndax-announces-fda-priority-review-of-nda-for-revumenib-for-the-treatment-of-relapsedrefractory-kmt2ar-acute-leukemia-302100145.html
[6]REVUMENIB MONOTHERAPY IN PATIENTS WITH RELAPSED/REFRACTORY KMT2AR ACUTE LEUKEMIA: TOPLINE EFFICACY AND SAFETY RESULTS FROM THE PIVOTAL AUGMENT-101 PHASE 2 STUDY. Retrieved June 13 , 2024. From ?https://library.ehaweb.org/eha/2024/eha2024-congress/420615/ibrahim.aldoss.revumenib.monotherapy.in.patients.with.relapsed.html?f=listing%3D1%2Abrowseby%3D8%2Asortby%3D2%2Ace_id%3D2552%2Aot_id%3D29192%2Amarker%3D5101
[7]A PHASE 1B STUDY OF THE MENIN-KMT2A INHIBITOR JNJ-75276617 INCOMBINATION WITH VENETOCLAX AND AZACITIDINE INRELAPSED/REFRACTORY ACUTE MYELOID LEUKEMIA WITH ALTERATIONS INKMT2A OR NPM1. Retrieved June 13 , 2024. From https://library.ehaweb.org/eha/2024/eha2024-congress/422237/andrew.h.wei.a.phase.1b.study.of.the.menin-kmt2a.inhibitor.jnj-75276617.in.html?f=listing%3D1%2Abrowseby%3D8%2Asortby%3D2%2Ace_id%3D2552%2Aot_id%3D29192%2Amarker%3D5099
[8]KURA ONCOLOGY REPORTS POSITIVE PRELIMINARY ZIFTOMENIB COMBINATION DATA IN ACUTE MYELOID LEUKEMIA. Retrieved January 31, 2024, from https://ir.kuraoncology.com/news-releases/news-release-details/kura-oncology-reports-positive-preliminary-ziftomenib
[9]A First-in-Human Phase 1 Study of the Menin-KMT2A (MLL1) Inhibitor JNJ-75276617 in Adult Patients with Relapsed/Refractory Acute Leukemia Harboring KMT2A or NPM1 Alterations. Retrieved Nov 2, 2023, from https://ashpublications.org/blood/article/142/Supplement%201/57/499087/A-First-in-Human-Phase-1-Study-of-the-Menin-KMT2A
[10]KURA ONCOLOGY PRESENTS UPDATED CLINICAL DATA FROM KOMET-001 TRIAL OF MENIN INHIBITOR ZIFTOMENIB AT AMERICAN SOCIETY OF HEMATOLOGY ANNUAL MEETING. Retrieved Dec 10, 2022, from https://ir.kuraoncology.com/news-releases/news-release-details/kura-oncology-presents-updated-clinical-data-komet-001-trial
[11]各公司官網(wǎng)及公開資料

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 12
12

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 16
16

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 14
14
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽