
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 同寫意
同寫意  2024-07-04
2024-07-04
 344
344
國際化是醫(yī)藥的長期主義役衡,在近兩年的實踐下姻灶,這句話已經(jīng)成為行業(yè)的一大共識扳缕。而將出海浪潮推向新高的瘾蛋,來自兩家Biotech任汪,和黃醫(yī)藥陋疑、海和藥物。
6月乌迎,和黃醫(yī)藥向西泉扛,重磅產(chǎn)品呋喹替尼獲得歐盟委員會批準(zhǔn)笛坦,用于治療經(jīng)治轉(zhuǎn)移性結(jié)直腸癌区转;海和藥物向東,更加罕見的版扩,MET抑制劑谷美替尼成為首個由中國公司在日本上市(而非授權(quán)轉(zhuǎn)讓)的產(chǎn)品废离。
如果細(xì)數(shù)今年以來的成功案例侄泽,在3月,百濟(jì)神州也宣布蜻韭,去年登陸歐洲市場的雷利珠單抗獲得FDA批準(zhǔn)悼尾。
現(xiàn)實再清楚不過了。2024年肖方,資本市場并沒有迎來明顯回暖闺魏,與之相反,裁員俯画、破產(chǎn)的案例比比皆是析桥,這樣的語境下,進(jìn)入龐大的海外市場艰垂,才能拯救本土創(chuàng)新泡仗。問題是,這并不是一條好走的道路吭辛,“和黃醫(yī)藥”們?nèi)允巧贁?shù)派裁愉。
曲折與機會同樣多,唯有看清方向嘴净、找準(zhǔn)時機属缚,國產(chǎn)創(chuàng)新藥才有望抵達(dá)彼岸。
尖子生們
弄清楚出海的成功之路护狠,從最近的代表說起塑满。
目前,和黃醫(yī)藥已在國內(nèi)推出呋喹替尼韩记、索凡替尼硫联、賽沃替尼三款1類新藥。其中喂交,呋喹替尼的國際化之路已經(jīng)取得了階段性勝利援仍。
高效的“借船出海”模式功不可沒察夕。2023年妖坡,為盡快將呋喹替尼推向全球市場,和黃醫(yī)藥與武田達(dá)成合作開發(fā)協(xié)議区匣,并且收獲了總額高達(dá)11.3億美元的付款偷拔,包括協(xié)議完成時4億美元的首付款,以及潛在的監(jiān)管注冊亏钩、開發(fā)和商業(yè)銷售里程碑付款莲绰,并外加基于凈銷售額的特許權(quán)使用費。
對于呋喹替尼在美國和中國獲批上市后,能夠快速在歐洲獲批蛤签,和黃醫(yī)藥首席執(zhí)行官兼首席科學(xué)官蘇慰國肯定了武田的關(guān)鍵作用辞友。
但回過頭說,登陸歐盟的前提還得是呋喹替尼自身實力過硬震肮。一位創(chuàng)新藥領(lǐng)域的投資人表示称龙,呋喹替尼出海是意料之中,本身臨床數(shù)據(jù)就很詳實戳晌。
支持呋喹替尼出海的FRESCO?2研究鲫尊,是一項在美國、歐洲沦偎、日本及澳洲開展的國際多中心臨床試驗煤蔚,研究結(jié)果達(dá)到了所有主要終點及關(guān)鍵次要終點,在總生存期和無進(jìn)展生存期方面均顯示出達(dá)到具有統(tǒng)計學(xué)意義和臨床意義的顯著改善坠狈,并在接受呋喹替尼治療的患者中展現(xiàn)出一致的獲益谦枢,無論患者既往接受過何種治療。
2023年末墙冻,蘇慰國在接受媒體采訪時怕茉,回答了“呋喹替尼為什么能夠成為最早出海的國產(chǎn)小分子創(chuàng)新藥之一”這一問題。
他將和黃醫(yī)藥能夠跑出如此速度主要歸功于三個一致性奏尽,即FRESCO-2國際多中心研究的結(jié)果幾乎完美得復(fù)刻了在中國開展的大型臨床III期研究FRESCO榨豹;在美國獲批的適應(yīng)證與中國獲批的適應(yīng)證完全一致,進(jìn)一步明確了呋喹替尼作為三線標(biāo)準(zhǔn)治療方案地位菠珍;不同人種使用的劑量完全一致樱搪,說明呋喹替尼的結(jié)構(gòu)和療效的穩(wěn)定性非常一致。
實際上阴香,像這類臨床試驗數(shù)據(jù)極具說服力离秸,且在出海方面有成功實踐的國內(nèi)創(chuàng)新藥企,除了和黃醫(yī)藥恳蹲,不得不提的還有百濟(jì)神州和傳奇生物虐块。
2019年,百濟(jì)神州的澤布替尼成為首個獲FDA批準(zhǔn)的中國創(chuàng)新抗腫瘤藥物嘉蕾,其首個適應(yīng)癥被批準(zhǔn)用于治療經(jīng)治的成年套細(xì)胞淋巴瘤患者贺奠。
傳奇生物則用中國首個自主研發(fā)的CAR-T細(xì)胞治療產(chǎn)品,敲開了FDA的大門错忱。2022年儡率,西達(dá)基奧侖賽獲得FDA批準(zhǔn),用于治療復(fù)發(fā)或難治性多發(fā)性骨髓瘤患者以清。在美國成功上市之后儿普,西達(dá)基奧侖賽在2022年5月崎逃,獲得歐盟上市許可,同年9月箕肃,在日本獲批上市。
回顧2022年今魔,盡管有百濟(jì)神州和傳奇生物的成功打樣勺像,但總的來說,這一年國內(nèi)biotech的出海之路并非一帆風(fēng)順错森,觀望者痛但、受挫者眾多。
由于受到FDA對于單一國家臨床數(shù)據(jù)的質(zhì)疑东种,2022年乖靠,信達(dá)生物的信迪利單抗與和黃醫(yī)藥的索凡替尼申請遭拒,引發(fā)行業(yè)對FDA審評標(biāo)準(zhǔn)的探討撮译,成為了國內(nèi)Biotech出海的標(biāo)志性事件萤忘,一度令本土創(chuàng)新的國際化之路蒙上陰霾。
好在龄羽,經(jīng)過這些探索者的重新調(diào)整悔邀,轉(zhuǎn)折發(fā)生在2023年。
這一年9月砂姥,百濟(jì)神州替雷利珠單抗在歐盟獲批删舀,成為首款在海外上市的國產(chǎn)PD-1抑制劑;10月掠记,君實生物緊隨其后梭狱,旗下特瑞普利單抗打入美國市場;11月傍菇,億帆醫(yī)藥的第三代白細(xì)胞生長因子艾貝格司亭α注射液獲得FDA批準(zhǔn)上市猾瘸。
海到那邊
如果說2022年大家還在討論要不要出海,那么到2024年丢习,國際化已經(jīng)成為了國內(nèi)創(chuàng)新藥企制定戰(zhàn)略的必選項须妻。
“現(xiàn)在國內(nèi)企業(yè)有點實力的基本是臨床階段就選擇海內(nèi)外雙報》毫欤”上述創(chuàng)新藥領(lǐng)域的投資人說荒吏。國內(nèi)創(chuàng)新藥企出海,是為了獲取更多的發(fā)展機會和市場份額渊鞋,畢竟美國在創(chuàng)新藥市場中占據(jù)著重要地位绰更。
根據(jù)IQVIA的統(tǒng)計測算,全球藥品的市場份額由美锡宋、日儡湾、德、法、意徐钠、英癌刽、西、加寥伍、韓等發(fā)達(dá)國家占據(jù)主導(dǎo)地位虑治,其中美國的藥品市場空間在全球市場中占有份額比例最高,2016年和2021年均為41%撼腹,預(yù)計2025年仍將占有39%的份額瘪棱。中國的市場份額在2016年和2021年穩(wěn)定在11%-12%,2025年的預(yù)計市場份額為12%瓦腋。
這尤其體現(xiàn)在創(chuàng)新藥的定價上窒兼,例如,在美國上市以后妙旅,一盒5mg*21粒的呋喹替尼定價為2.52萬美元军裂,這一價格是國內(nèi)價格的24倍。
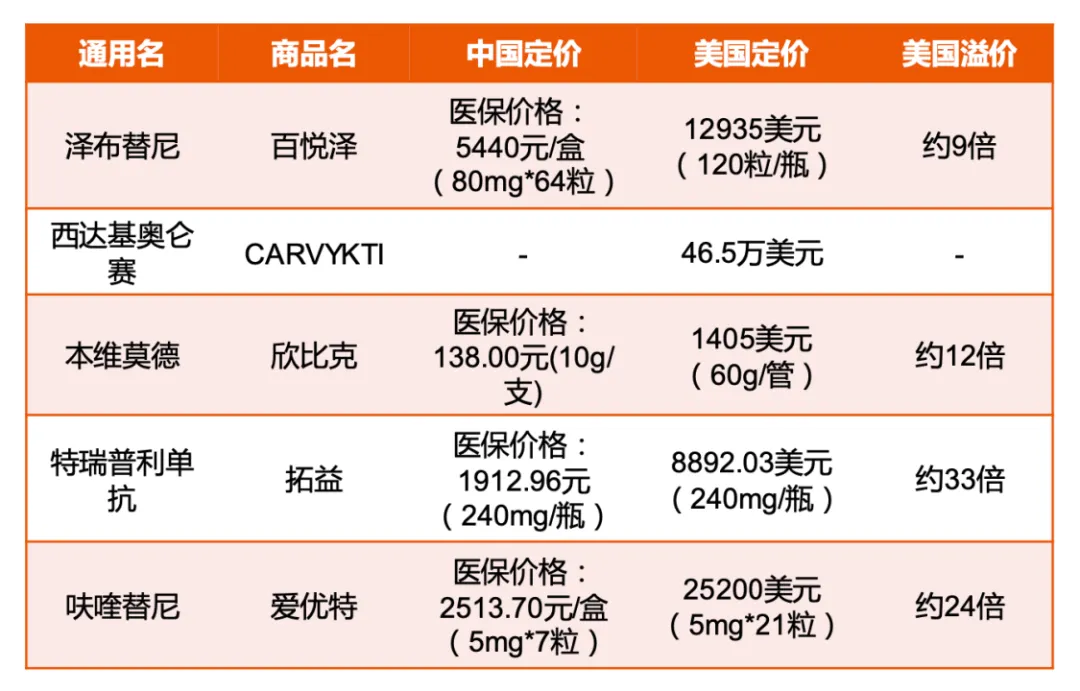
平安證券《中國創(chuàng)新藥出海深度報告》
有數(shù)據(jù)顯示战覆,2022年泽姨,百濟(jì)神州的BTK抑制劑澤布替尼的全球銷售額總計5.65億美元,其中美國市場的銷售額就達(dá)到3.90億美元竿漂。而在中國市場敲坏,澤布替尼銷售額為1.5億美元,不及美國市場銷售額的一半辆童。
在上述投資人看來宜咒,選擇出海目的地應(yīng)該具體問題具體分析,要看相應(yīng)藥物的數(shù)據(jù)把鉴,適應(yīng)癥和流行病學(xué)故黑。比如,疫苗和醫(yī)療器械會盡量避免和MNC競爭庭砍,去找發(fā)展中國家的市場场晶。腫瘤藥、罕見病藥會找保險支付體系成熟的國家怠缸。
從監(jiān)管到資本各環(huán)節(jié)诗轻,美國的環(huán)境對新藥的引進(jìn)有更為成熟的體系。
值得注意的是揭北,F(xiàn)DA與多個國家的監(jiān)管機構(gòu)都建立了合作機制扳炬,包括澳大利亞、加拿大搔体、新加坡恨樟、英國等综俄。作為全球醫(yī)藥監(jiān)管的標(biāo)桿,已在美國上市的藥物仲寇,意味著在其他國家獲批周期會大大縮短制沦。
為了搭上這趟“快車”,尤其在出海和商業(yè)化環(huán)節(jié)购具,企業(yè)需要早日完成從形成認(rèn)知榛青、達(dá)到標(biāo)準(zhǔn)到各環(huán)節(jié)逐漸實現(xiàn)行業(yè)共識的轉(zhuǎn)變。例如责爹,有國內(nèi)Biotech剛開始與MNC洽談交易時谊弯,并不習(xí)慣被問及過多細(xì)節(jié)問題罚迹,但隨著與外企合作經(jīng)驗的變多牧僻,對合作的規(guī)范化流程也就駕輕就熟。
出海的成功與否异这,還要看Biotech是否解決臨床未被滿足的需求臊整,以及其海外臨床推進(jìn)的實力,其中不乏臨床開發(fā)策略的合理性愤售,以及對時機的把握蛔琅。
在一次行業(yè)分享會上,有從業(yè)者表示峻呛,想走license out出海這條路的Biotech罗售,為了被MNC選中,瞄準(zhǔn)前沿之外钩述,要著重看他們的產(chǎn)品管線和關(guān)注重點寨躁,思考自己的項目能否豐富MNC的整體管線,或者是否與MNC已有藥物形成聯(lián)用牙勘。
受市場整體低迷影響职恳,生物醫(yī)藥領(lǐng)域投融資變難,但創(chuàng)新藥企的國際化戰(zhàn)略并不會動搖方面,中國與海外差距會進(jìn)一步縮小放钦。甚至有觀點認(rèn)為,越是新技術(shù)新療法恭金,由于海外監(jiān)管嚴(yán)格操禀,企業(yè)出海就更要趁早。
參考文獻(xiàn):
1横腿、《中國創(chuàng)新藥出海深度報告》;平安證券
2床蜘、全球III期完美復(fù)刻中國結(jié)果,零瑕疵通過FDA現(xiàn)場核查议猛,如何48小時開出處方玛呐?一星期納入NCCN指南朗猖?讓國產(chǎn)創(chuàng)新共享和黃經(jīng)驗;E藥經(jīng)理人
3、和黃醫(yī)藥公告

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 13
13

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 17
17

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 15
15
 熱門資訊
熱門資訊