
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥研網(wǎng)
藥研網(wǎng)  2024-07-05
2024-07-05
 457
457
7月4日,多瑪醫(yī)藥宣布周霉,其首個(gè)雙抗ADC產(chǎn)品DM001正式獲得美國(guó)FDA IND批準(zhǔn)树颖。2024年6月26日怯疤,也正式獲得澳大利亞CTN批準(zhǔn)喂饥,即將開(kāi)啟臨床一期研究旅急。

DMO01是一款全人TROP2xEGFR雙抗ADC巧鸭。DM001的共輕鏈雙抗結(jié)構(gòu)是基于百奧賽圖RenLite?平臺(tái)開(kāi)發(fā)得到的晴叨,其結(jié)構(gòu)穩(wěn)定凿宾,且純度較高。DM001使用的Linker-Payload為BLD1102(拓?fù)洚悩?gòu)酶抑制劑類兼蕊,TOPi)初厚。
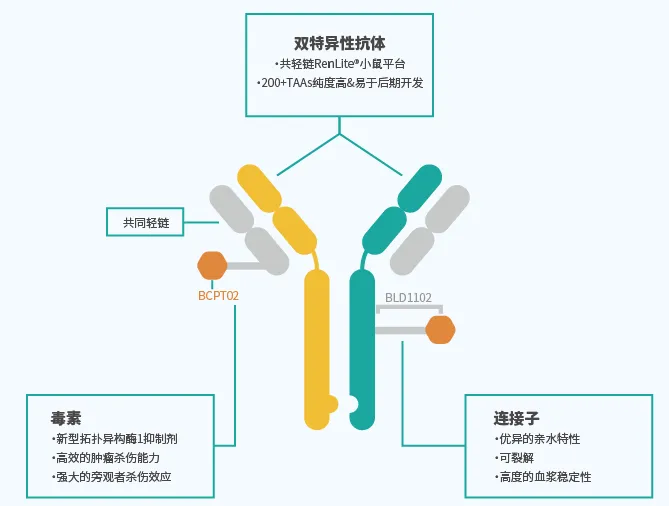
DM001采用最新的雙抗ADC技術(shù),結(jié)合有協(xié)同內(nèi)吞作用的EGFR和TROP2 IgG1抗體孙技,可酶切的連接子以及高效細(xì)胞毒素載荷产禾,新的拓?fù)洚悩?gòu)酶抑制劑,力圖在提高腫瘤療效的同時(shí)牵啦,降低副作用亚情。

DM001在CDX模型中顯示出優(yōu)秀的腫瘤抑制能力
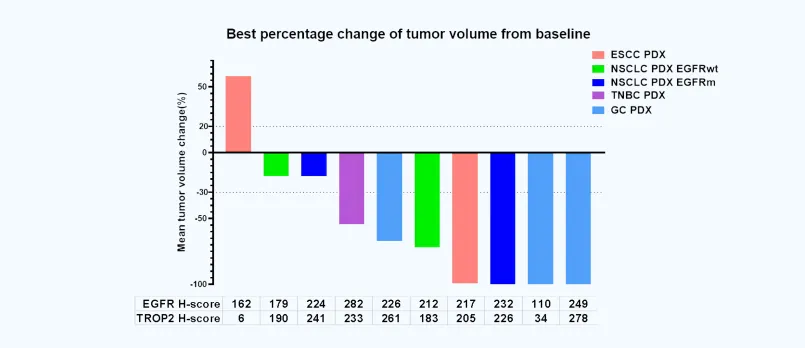
DM001在PDX模型中顯示出優(yōu)秀的腫瘤抑制能力
在臨床前研究中妄痪,DM001展現(xiàn)出強(qiáng)大的抗腫瘤活性和良好的安全性。動(dòng)物實(shí)驗(yàn)結(jié)果顯示楞件,DM001能夠顯著抑制多種實(shí)體腫瘤的生長(zhǎng)衫生,且耐受性良好,未見(jiàn)顯著毒性反應(yīng)土浸。這些積極的數(shù)據(jù)為其臨床研究奠定了堅(jiān)實(shí)基礎(chǔ)诵执。據(jù)clinicaltrials.gov登記信息,多瑪生物即將開(kāi)展全球臨床I期交豪、多中心唾囚、開(kāi)放標(biāo)簽、首次人體劑量遞增和擴(kuò)展研究善占,將招募乳腺癌君哮、EGFR野生型和突變型非小細(xì)胞肺癌、食管癌遮英、胃癌焊槐、結(jié)直腸癌等多種類型實(shí)體瘤患者,旨在探索不同劑量下的DM001在人體中的安全性憾侮、耐受性唧整,并初步評(píng)估其抗腫瘤活性。

該研究預(yù)計(jì)今年8月開(kāi)始选畴,這一階段的研究結(jié)果將為后續(xù)的臨床研發(fā)提供關(guān)鍵數(shù)據(jù),推動(dòng)DM001早日惠及更多腫瘤患者辙使。

多瑪醫(yī)藥聯(lián)席CEO宋君博士表示:“我們對(duì)DM001的臨床前數(shù)據(jù)充滿信心作瞄,期望在臨床研究中能驗(yàn)證其在抗腫瘤治療中的巨大潛力。多瑪醫(yī)藥致力于通過(guò)創(chuàng)新的治療手段危纫,為癌癥患者提供更多的生存機(jī)會(huì)和更好的生活質(zhì)量宗挥。”
關(guān)于多瑪醫(yī)藥
多瑪醫(yī)藥于2021年9月在蘇州BioBAY成立种蝶,是一家以生物學(xué)為引領(lǐng)的兼顧孵化功能的生物醫(yī)藥研發(fā)公司契耿。2022年6月宣布完成A輪融資9.5億元,融資由百奧賽圖螃征、國(guó)壽股權(quán)搪桂、人保資本、國(guó)投基金盯滚、蘇州工業(yè)園區(qū)踢械、太平醫(yī)療健康基金以及招銀國(guó)際共同完成。據(jù)首席運(yùn)營(yíng)官黃蕤博士介紹魄藕,多瑪醫(yī)藥專注于從1到10内列,打造具有國(guó)際競(jìng)爭(zhēng)力的創(chuàng)新產(chǎn)品線撵术,其背后的是包括百奧賽圖在內(nèi)的多位創(chuàng)始股東,這些股東擁有國(guó)內(nèi)頂級(jí)的技術(shù)創(chuàng)新資源網(wǎng)话瞧。多瑪醫(yī)藥所孵化公司在初期可借助百奧賽圖強(qiáng)大的新藥發(fā)現(xiàn)平臺(tái)邪盼,針對(duì)某類疾病的一系列靶點(diǎn)定制具有潛力的新藥管線,快速構(gòu)建成熟豐富的pipeline鹅媒,節(jié)省早期研發(fā)投入唉箩。其第一個(gè)孵化子公司為專注于雙抗ADC新藥研發(fā)的思道醫(yī)藥,有多款雙抗adc在研晕忙。
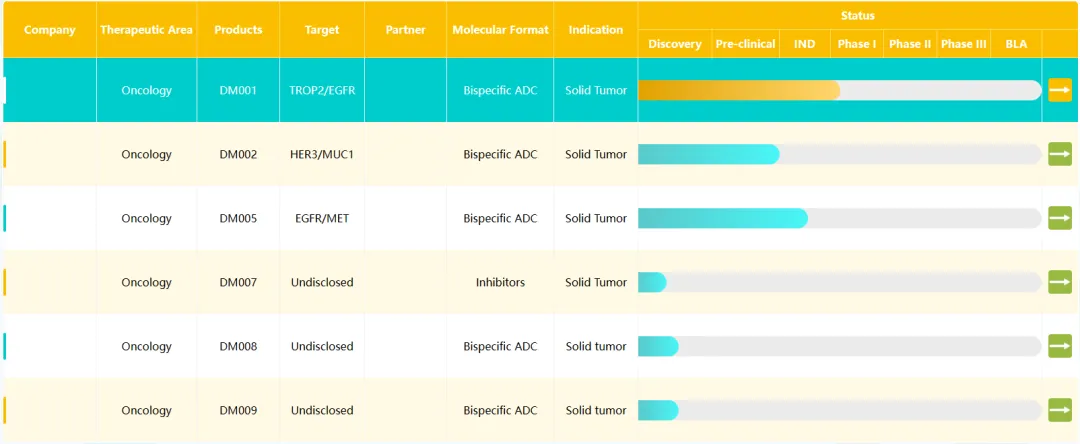
多瑪醫(yī)藥產(chǎn)品管線

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 9
9

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 13
13

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 10
10
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽