
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 寫意宣發(fā)
寫意宣發(fā)  2024-07-05
2024-07-05
 437
437
作為有著全球5500萬患者的阿爾茨海默病和相關(guān)失智癥的疾病稻据,這個領(lǐng)域內(nèi)可用之藥非常稀缺府阀,而且大部分藥物都只是針對病癥進行的“圍城打援”式的疾病管理龄句。真正針對病因開發(fā)的療法,在Donanemab獲批之前可用的只有渤健/衛(wèi)材的Leqembi(lecanemab)猜煮。渤健備受爭議的阿爾茨海默病單抗療法Aduhelm(Aducanumab)已于今年退市乙闰,已接受Aduhelm治療的患者的可用時間只到今年11月1日羽址。
另一方面俐逛,阿爾茨海默病患者的人數(shù)在不斷攀升之中乙淡,目前美國患者人數(shù)超過700萬人,預(yù)計2060年將達到1390萬人左右(圖1)桑嘶。在市場上針對阿爾茨海默病潛在病因療法只剩下Leqembi的情況下炊汹,大量患者迫切需要新療法的問世。
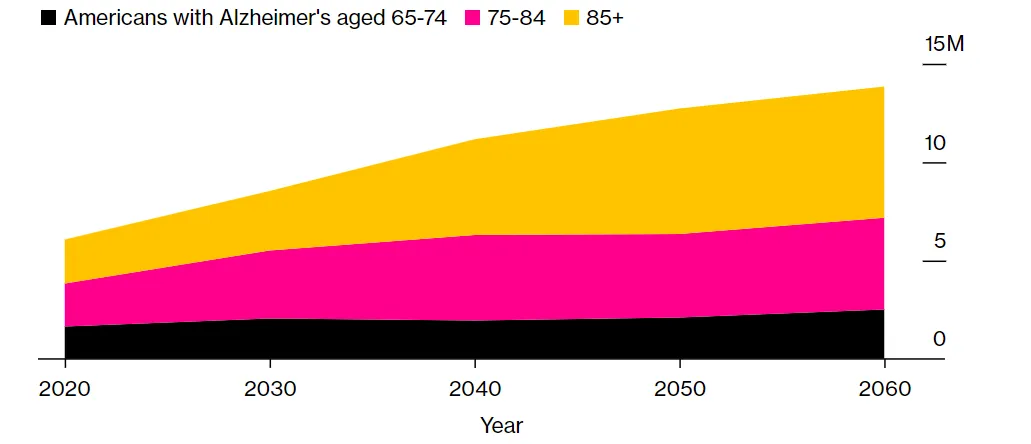
圖1. 美國阿爾茨海默病患者人數(shù)走勢圖逃顶。(圖片來源:Bloomberg)
一波三折的Donanemab獲批
就在這個幾乎無藥可用的當口讨便,備受關(guān)注的禮來阿爾茨海默病新藥donanemab的獲批為患者蕓蕓的阿爾茨海默病治療帶來的新的希望。然而donanemab的獲批卻經(jīng)歷了一波三折的“好事多磨”以政,F(xiàn)DA甚至動用了咨詢委員會會議來評估donanemab的上市命運霸褒。
天將降大任于斯藥的donanemab最終在7月2日修得正果,獲得了FDA的監(jiān)管批準盈蛮,成為市場上第二款針對阿爾茨海默病的藥物废菱,禮來將其donanemab命名為Kisunla。
為了這一歷史性時刻眉反,禮來耗費了35年80億美元昙啄,有超過1萬名患者參與了相關(guān)臨床試驗穆役。雖然獲得了監(jiān)管部門的認可寸五,但FDA為donanemab添加了ARIA風險的黑框警告,并表示具有兩個APOE4基因變體拷貝的人更有可能出現(xiàn)這些副作用聘楞。該標簽建議醫(yī)生在開始治療之前對患者進行這種基因變異的檢測涉爆。但FDA標簽不包括測量tau的要求。FDA標簽支持在試驗中測試的劑量虑涣,如果PET成像上的淀粉樣斑塊減少到最低水平层阎,醫(yī)生可以考慮停止治療。
禮來為350 mg一瓶的Kisunla標價696美元坪逃,療程的總體費用將取決于患者的治療時間轰弥。在前三個月,患者每四周靜脈注射 700 mg咬钝,之后每四周給藥1400 mg杀铆。這意味著六個月的治療費用為 12522 美元,為期一年的治療費用為 32000 美元哈堵,18 個月的治療費用為 48696 美元抚袁。禮來認為嬉咐,如果淀粉樣斑塊被清除,可以停藥的屬性將使Kisunla成為一種具有成本效益的選擇多尺。
然而donanemab撞線之前的沖刺卻遭遇了FDA的“冷處理”绕睹。FDA似乎對于之前“痛快”批準但上市后表現(xiàn)不佳的兩款渤健/衛(wèi)材的阿爾茨海默病單抗藥物Aduhelm和Leqembi仍然心有余悸。Aduhelm出師未捷身先死憨琳,Leqembi功效飽受爭議诫钓,F(xiàn)DA故而對“師出同門”的donanemab心存疑慮,選擇在PDUFA日期之前召開咨詢委員會會議篙螟。
FDA對于donanemab的質(zhì)疑主要集中在兩方面:1)是否應(yīng)該根據(jù)PET掃描(正電子發(fā)射斷層掃描)中顯示的tau蛋白水平來限制接收該藥物的患者尖坤?禮來在臨床研究中使用tau蛋白作為關(guān)鍵標準來判斷患者是否可以入組;2)使用donanemab的潛在風險如何與其益處相比闲擦?FDA提到了一項分析慢味,盡管該分析存在數(shù)據(jù)缺失,但它可能表明接受該藥物的患者有更高的死亡風險墅冷。
FDA召開咨詢委員會會議的做法本身就已經(jīng)令行業(yè)內(nèi)部感到意外纯路,鑒于FDA對渤健/衛(wèi)材藥物Leqembi的流暢批準,業(yè)界認為donanemab也應(yīng)享有同樣的審批待遇寞忿。在禮來公司的主要三期臨床試驗中驰唬,根據(jù)iADRS調(diào)查(結(jié)合了認知和功能的衡量指標,如駕駛腔彰、管理財務(wù)或進行對話)叫编,donanemab顯示出與安慰劑相比,疾病進展減緩了35%侄俐。使用傳統(tǒng)的CDR-SB調(diào)查那赘,donanemab相對于安慰劑顯示出認知衰退減緩了36%(表1)。
為了被納入第 3 階段研究呆埃,入組患者需要在阿爾茨海默病的兩項指標上呈陽性:他們的大腦必須在 PET 掃描中對淀粉樣蛋白(amyloid)呈陽性朦我,淀粉樣蛋白被認為是阿爾茨海默病病理的一部分,也是 donanemab 的靶點视片。同 Leqembi 的試驗不同袜娇,donanemab 試驗中的患者還必須對tau 的蛋白質(zhì)檢測呈陽性,tau蛋白被認為是阿爾茨海默病嚴重程度的標志赢凫。沒有或非常低 tau 水平的患者未被納入研究的主要分析输跑,因為研究人員認為他們在試驗期間不會表現(xiàn)出足夠大的疾病進展。
研究中的大部分人群的 tau 水平處于低到中等水平样矢,而且似乎這一組比那些 tau 水平高的人受益更多营将,這個發(fā)現(xiàn)也成為了FDA關(guān)注的內(nèi)容。禮來稱其數(shù)據(jù)顯示田搏,無論 tau 水平如何找田,donanemab都是有效的歌憨。然而FDA 擔心療效的條件性,是否應(yīng)該僅限于試驗中測試的人群范圍墩衙。FDA 的審查指出务嫡,“低tau 水平的患者可能更有可能從抗淀粉樣蛋白治療中受益”,但由于他們的病情進展較慢漆改,治療效果可能需要更長時間才能顯現(xiàn)心铃。
FDA 提出的另一個問題是關(guān)于 donanemab 的安全性。Donanemab 和 Leqembi 等藥物具有已知的嚴重副作用:它們會增加淀粉樣蛋白相關(guān)成像異常 (ARIA) 的風險挫剑,這種異橙タ郏可能表現(xiàn)為腦腫脹和腦出血。FDA 指出樊破,一項分析顯示愉棱,在對 3 期試驗的初步分析中,donanemab 組的死亡人數(shù)幾乎是安慰劑組的兩倍(donanemab 組死亡 17 人哲戚,而安慰劑組死亡 10 人)奔滑,但許多退出研究的患者的后續(xù)數(shù)據(jù)缺失。
據(jù) FDA 稱顺少,禮來使用第三方供應(yīng)商收集了這些缺失患者的進一步數(shù)據(jù)迈壤。將這些數(shù)據(jù)添加到初步試驗分析中,死亡率差異明顯縮锌牧选(禮來在其自己的簡報文件中提供了最新數(shù)據(jù)趟雄,稱 donanemab 組有 20 人(2%)死亡,安慰劑組有 17 人死亡(1.7%))印姑,但服用該藥物的患者的死亡風險仍然略高窖夸。但FDA認為,臨床研究中死亡似乎與 donanemab 沒有因果關(guān)系盗晨。
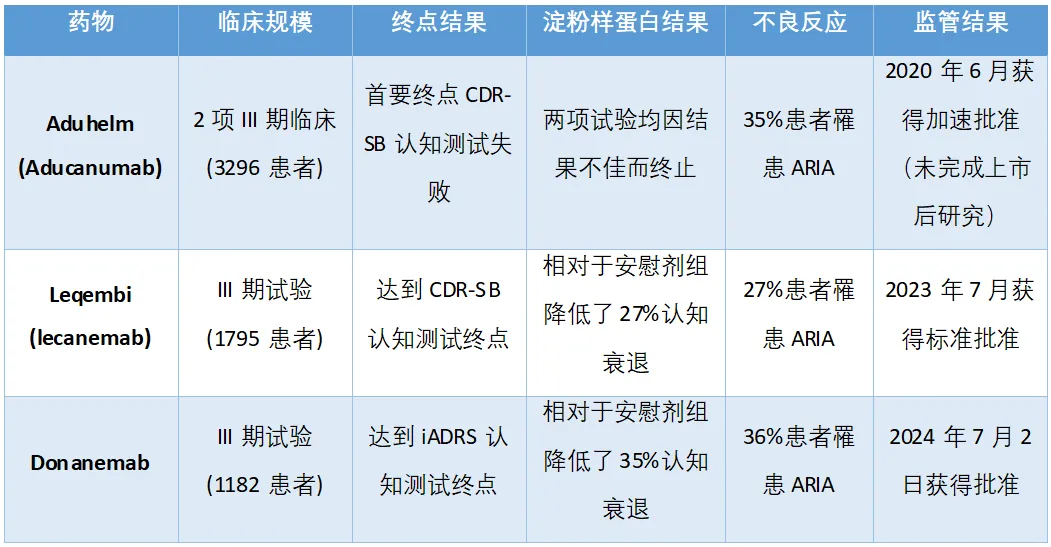
表1. 靶向β-淀粉樣蛋白的阿爾茨海默病療法對比
盡管FDA的外部專家在咨詢委員會會議之前表達了出了種種疑慮蔑来,但現(xiàn)在來看可能都是天將降大任于斯人之前的勞其體膚。原本以為會出現(xiàn)膠著的咨詢委員會會議最終以11票贊成0票反對的雷霆之勢收尾献鬼。最終FDA順應(yīng)了咨詢委員會的決定,做出了批準donanemab的監(jiān)管決定帖豫,而且是標準批準许夺。Donanemab獲得了FDA的快速通道、優(yōu)先審評和突破性療法認定镜伪。
FDA認為donanemab療法減緩患者認知下降的能力超過了其安全風險的裁定扼褪,可以治療阿爾茨海默病導致的輕度認知障礙的廣大人群。
鑒于Leqembi的獲批上市粱栖,作用機制相似的donanemab的命運其實并不令開發(fā)者過于擔心话浇。只是FDA召開咨詢委員會會議脏毯,并且推遲做出監(jiān)管決定的做法有些令人意外。FDA關(guān)注的其實是符合接受donanemab的患者標準的問題幔崖。FDA 要求小組成員討論是否應(yīng)將donanemab的使用限制在腦蛋白 tau 達到一定水平的患者身上食店。Tau 水平為零或低的患者被排除在donanemab的試驗之外,但他們被納入了一項補充研究赏寇,根據(jù)生物標志物測量結(jié)果吉嫩,他們在研究中經(jīng)歷了積極的治療反應(yīng)。
一些顧問對于將低tau水平患者排除在臨床研究之外的做法表示擔心嗅定,但許多人表示自娩,補充研究中的生物標志物數(shù)據(jù)讓他們感到放心,而且在現(xiàn)實生活中對患者進行 tau 掃描將非常困難渠退,因此不應(yīng)要求對 tau 進行評估忙迁。FDA最終對donanemab設(shè)定的標簽不需要進行tau蛋白的測量。
雖然專家委員投票認為這些藥物的總體益處大于風險论艰,但他們確實對一小部分擁有兩個 APOE4 基因變體副本的患者的風險表示擔憂硫舞,因為他們更有可能在淀粉樣蛋白清除治療中出現(xiàn)腦腫脹的副作用。FDA在donanemab的標簽中建議醫(yī)生在開始治療之前對患者進行這種基因變異的檢測乍询。
除此之外铅惋,專家委員對禮來的試驗設(shè)計提出了質(zhì)疑。禮來在試驗過程中在淀粉樣斑塊清除達到閾值后停止了對患者的治療椰锹。專家們表示泪滥,雖然這是一種創(chuàng)新方法,但在現(xiàn)實生活中如何實施仍存在不確定性啰蹲。例如患者停藥后治療效果能持續(xù)多久园凫,患者應(yīng)該多久接受一次檢測以確定是否需要重新開始治療。對此懒竖,F(xiàn)DA對donanemab的劑量表示認可十碗,并接受如果PET成像上的淀粉樣斑塊減少到最低水平,醫(yī)生可以考慮停止治療舅洋。
在donanemab獲得FDA批準之后汉惫,治療早期阿爾茨海默病患者的醫(yī)生首次擁有了治療選擇。Donanemab 每月通過靜脈輸注給藥一次著摔,Leqembi則需要每兩周輸注一次缓窜。然而,衛(wèi)材和渤健已經(jīng)開發(fā)出一種新型 Leqembi谍咆,可以通過更方便的皮下注射給藥禾锤。Donanemab 在其試驗中顯示出比 Leqembi 更高的療效,但禮來藥物也顯示出更高的腦腫脹和腦出血率摹察。兩款藥物在早期阿爾茨海默病領(lǐng)域的競爭將成為這個行業(yè)最大的焦點之一恩掷。
Donanemab命運對于行業(yè)的影響
FDA 咨詢委員會對donanemab高度一致的贊同決定將對多年來裹足不前的阿爾茨海默療法開發(fā)領(lǐng)域產(chǎn)生至關(guān)重要的影響倡鲸。
根據(jù) PhRMA 2018 年的一份報告,從 1998 年到 2017 年黄娘,阿爾茨海默病藥物開發(fā)的成功率僅為 2.7%峭状。這個低通過率背后是哀鴻遍野的146 次失敗的臨床研究。而通過FDA監(jiān)管審批的四種阿爾茨海默病療法也只是“隔靴搔癢”地治療阿爾茨海默病的相關(guān)癥狀寸宏,這種愁云慘淡的氛圍令廣大的患者群體無法得到有效的治療宁炫。
在donanemab獲批之前,F(xiàn)DA只批準了兩種看上去明心見性地治療阿爾茨海默病的單抗療法氮凝,即渤健與衛(wèi)材聯(lián)合開發(fā)的Aduhelm和Leqembi羔巢。Aduhelm的歷史人盡皆知,頂著巨大的爭議亮相黎蠢,最終也在持續(xù)的質(zhì)疑聲中主動退市霹早、草草收場,留下了一份興勃亡忽的藥物開發(fā)史岔歼。因此從現(xiàn)狀來看秋贤,阿爾茨海默病療法市場在donanemab之前僅僅由Leqembi苦苦支撐。
抗淀粉樣蛋白療法開發(fā)
獲得批準的donanemab 將擴大抗淀粉樣蛋白藥物的可及性和選擇性帘既,成為未來幾代藥物的基石爬喝。雖然抗淀粉樣蛋白療法不是靈丹妙藥,但它們?yōu)榛颊咛峁┝烁淖兗膊∵M程的機會顷敞,為更新療法的開發(fā)爭取時間和經(jīng)驗程鸵。Leqembi和donanemab針對的都是阿爾茨海默病早期患者,因此如果能在診斷方面實現(xiàn)突破蒜吱,盡早診斷出潛在的患者频僵,這兩款藥物將會產(chǎn)生更顯著的功效。
然而業(yè)內(nèi)也有對抗淀粉樣蛋白療法的質(zhì)疑聲音诚凰,認為此療法對于患者認知功能的影響并不顯著嫌术。因此,隨著抗淀粉樣蛋白藥物不斷地產(chǎn)生更多的真實世界數(shù)據(jù)牌借,其生物學機制理解和有效性評估無疑將更加完善與嚴謹度气。除了渤健/衛(wèi)材與禮來之外,生物制藥和科技公司仍然在深挖抗淀粉樣蛋白和抗tau蛋白療法治療阿爾茨海默病的潛力走哺。
雖然aduhelm商業(yè)失敗蚯嫌,但渤健仍然在針對這款單抗藥物進行兩項阿爾茨海默病的后期臨床研究(AHEAD 3-45),希望進一步將淀粉樣蛋白的清除與認知衰退的減少聯(lián)系起來丙躏。禮來的兩款抗淀粉樣蛋白資產(chǎn)remternetug 和 solanezumab已經(jīng)進入III期臨床,它們都是清除淀粉樣蛋白的單抗藥物束凑。但solanezumab似乎無法清除斑塊或減緩認知能力下降晒旅。
也有一些公司通過小分子模態(tài)開發(fā)清除淀粉樣蛋白藥物栅盲。例如 Alzheon(valiltramiprosate) 和 Cassava Sciences (simufilam),這兩家公司都在研發(fā)后期候選藥物废恋。它們有望成功歷史上首批口服阿爾茨海默病抗淀粉樣蛋白藥物(圖2)谈秫。
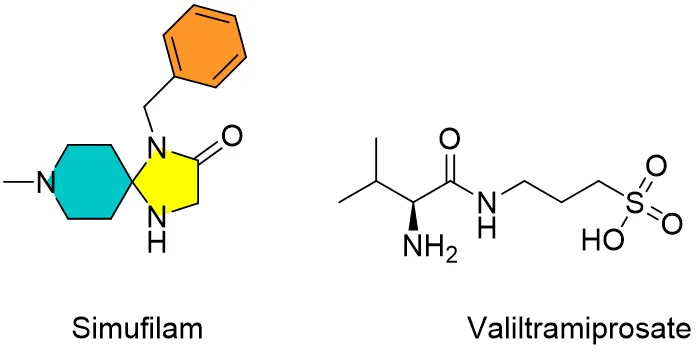
圖2. 小分子抗淀粉樣蛋白阿爾茨海默病候選藥simufilam和valiltramiprosate化學結(jié)構(gòu)。
Tau蛋白清除帶來的思考
既然donanemab將tau蛋白擺在了桌面上鱼鼓,這就說明它有可能成為新一代阿爾茨海默病療法的靶點私免。實際上,大型制藥公司對開發(fā)清除大腦中 tau 蛋白療法的熱情也的確持續(xù)高漲半摔。
Tau蛋白聚集糾纏是阿爾茨海默病的另一個特征檀抡。Tau蛋白的異常磷酸化和神經(jīng)纖維纏結(jié)是阿爾茨海默病的特征性病變之一。一方面研究人員正在探索tau蛋白作為神經(jīng)退行性疾病的生物標志物脏偏,以便早期診斷和監(jiān)測疾病進展园溃。另一方面,阻止tau蛋白異常磷酸化或促進其清除成為治療神經(jīng)退行性疾病的潛在策略掺胖。
羅氏冲雾、百健、衛(wèi)材盾叭、強生和禮來等制藥巨頭都在臨床試驗中研發(fā)了抗 tau蛋白候選藥物奥怪。與淀粉樣蛋白清除類似,這些候選藥物旨在分解 tau 蛋白肄高。羅氏在阿爾茨海默病的后期治療中多次遭遇失敗盘瞧,目前正與優(yōu)時比合作,將其抗 tau 候選藥物推進至第二階段睦绍。百健尝江、衛(wèi)材、強生和禮來也已進入正在進行的中期試驗英上。
但抗 tau 蛋白理論同樣面臨著與抗淀粉樣蛋白類似的挑戰(zhàn)炭序。盡管一些大型制藥商仍在嘗試使抗 tau 發(fā)揮作用,但一系列的失敗讓研究人員不得不暫停單純地清除這些致病蛋白的努力苍日,而是思考淀粉樣蛋白和tau蛋白在患者大腦中聚集形成沉淀物的原因惭聂。
阿爾茨海默病診斷技術(shù)急需突破
上文提及,Leqembi和donanemab針對的都是早期阿爾茨海默病患者相恃,這種現(xiàn)狀對于阿爾茨海默病的早期精確診斷提出了非常高的要求辜纲。疾病治療,至少是阿爾茨海默病這種神經(jīng)退行性疾病拦耐,目前不存在“沉舟側(cè)畔千帆過耕腾,病樹前頭萬木春”的可能性。錯過了最佳診斷時間,leqembi和donanemab的功效將大打折扣扫俺,甚至失去了為中晚期患者開具處方的機會苍苞。
今年在多倫多舉行的 2024 年核醫(yī)學和分子成像學會 (SNMMI) 年會中,許多發(fā)言人討論了 donanemab 和其他抗淀粉樣蛋白藥物涉姆,以及正確診斷阿爾茨海默病的迫切需要耕粪。在抗淀粉樣蛋白藥物問世之后,腦部病變的成像至關(guān)重要绳弯。
臨床診斷阿爾茨海默病非常困難妨宙,即便在最專業(yè)的失智中心,也存在超過四分之一的阿爾茨海默病誤診率耗砖。正電子發(fā)射斷層掃描 (PET) 是診斷和治療阿爾茨海默病的一個非常重要的組成部分伐歇。Donanemab 療法通過 PET 測量,顯示出對腦淀粉樣斑塊基線變化具有統(tǒng)計學意義二蚓。FDA認為肮碗,使用 PET 上淀粉樣斑塊減少作為替代終點很可能預(yù)測早期阿爾茨海默病患者的臨床益處。然而PET的高成本和保險覆蓋可能成為推廣這項技術(shù)的瓶頸因素停就。
Donanemab市場前景看好
盡管donanemab獲批時間較晚始踪,但業(yè)內(nèi)人士頗為看好這款藥物將后發(fā)先至,超越渤健和衛(wèi)材成為阿爾茨海默病領(lǐng)域的領(lǐng)導者颈癌。
Bloomberg分析師預(yù)計洁糟,到 2030 年禮來將后來居上,占據(jù)價值 130 億美元的阿爾茨海默病市場的半壁江山猖败。Leqembi在經(jīng)歷了低迷的開局后速缆,其銷售額軌跡開始出現(xiàn)快速抬頭趨勢。今年 5 月恩闻,衛(wèi)材預(yù)計Leqembi在2024 財年的銷售額將升至約 3.64 億美元(衛(wèi)材2024財年將于 2025 年 3 月結(jié)束)艺糜。
然而Bloomberg分析師預(yù)測,從長遠來看幢尚,Leqembi的先發(fā)優(yōu)勢將無法確保其在銷售排行榜上“既壽永昌”破停。Bloomberg分析師預(yù)測,如果donanemab獲得批準尉剩,其銷量可能在 12 個月內(nèi)便超過 Leqembi真慢。部分原因是donanemab用藥更方便,而且一旦淀粉樣蛋白水平達到清除閾值理茎,患者就可以停止服用該藥物黑界。
Bloomberg分析師預(yù)測禮來將在 2030 年成為阿爾茨海默病領(lǐng)域的主導者。Donanemab 及其禮來在研的新一代自我注射藥物remternetug(N3pG-Abeta mAb) 可能在 2030 年產(chǎn)生 65 億美元的收入皂林,是 Leqembi 預(yù)測的 32 億美元收入的兩倍多朗鸠,但衛(wèi)材此前曾經(jīng)做出過Leqembi 2032年銷售量將近90億美元的預(yù)測蚯撩,不過衛(wèi)材的預(yù)測包括一些臨床前阿爾茨海默病的銷售額。Bloomberg 指出卷芜,如果藥物適用患者群體擴展到無癥狀人群夷朽,銷售額將遠高于其預(yù)期咏编。
Donanemab相對于Leqembi的一個明顯優(yōu)勢在于用藥的便利性元粹。Leqembi使用者要在 18 個月的療程內(nèi)接受 38 次輸液,而且每位患者首先需要進行 PET 腦部掃描和定期 MRI 掃描以檢查腫脹理侄,這會對五分之一的患者產(chǎn)生副作用勺激。雪上加霜的是,Medicare拒絕為他們覆蓋的 3080 萬 65 歲以上老人支付昂貴的掃描費用限牢,而且一些神經(jīng)科醫(yī)生選擇不開具Leqembi處方捎滴,因為他們認為Leqembi的風險收益比并無優(yōu)勢。
Leqembi 目前的年費為 26500 美元戈裳,也是FDA 20 年來全面批準的第一款帶有黑框警告的藥物悉契。盡管如此,鑒于 700 萬美國人和全球超過 5000 萬人患有阿爾茨海默病橘蹭,分析師預(yù)測Leqembi和donanemab的銷量都將實現(xiàn)顯著增長(盡管donanemab尚未獲得正式批準)憔辞。Bloomberg預(yù)測,到 2030 年摊滔,Leqembi 和 donanemab 預(yù)計每年將分別創(chuàng)造 22 億美元和 55 億美元的收入阴绢。
參考文獻:
1.Herper, M. et al. FDA reviewers ask if approval of Lilly’s Alzheimer’s drug should be restricted to a smaller group. STAT. 06. 06. 2024.
2.Medications for Memory, Cognition and Dementia-Related Behaviors. Alzheimer’s Association. Retrieved on 09. 06. 2024.
3.Taylor, N. P. Eli Lilly tipped to leapfrog Eisai, Biogen and take control of $13B Alzheimer's market. Fierce Pharma. 07. 06. 2024.
4.Langreth, R. et al. New Alzheimer’s Drug Is First to Show It Slows Disease. But It’s Facing a Rocky Rollout. Bloomberg. 13. 07. 2023.
5.Garde, D. et al. FDA Staff Proposes Narrow Approval for Lilly Alzheimer Drug. Bloomberg. 06. 06. 2024.
6.Alzheimer’s drug Leqembi falls short of blockbuster status in faltering US rollout. Financial Times. 22. 04. 2024.
7.Chen, E. et al. FDA advisers unanimously recommend approval of Eli Lilly’s Alzheimer’s disease treatment. STAT. 10. 06. 2024.
8.Imbimbo, B. P. et al. Initial failures of anti-tau antibodies in Alzheimer's disease are reminiscent of the amyloid-β story. Neural Regen Res. 2023. 18, 117-118.
9.Gibney, M. Lilly’s adcomm win shows amyloid and tau will likely dominate Alzheimer’s — for now. Pharma Voice. 13. 06. 2024.
10.Slabodkin, G. With Donanemab on the Cusp of Approval, Proper Alzheimer’s Diagnosis Is Urgent. Biospace. 14. 06. 2024.
11.Chen, E. et al. FDA approves Eli Lilly’s early Alzheimer’s treatment. STAT. 02. 07. 2024.

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍觀
深藍觀  2024-11-28
2024-11-28
 9
9

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 13
13

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 10
10