
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-07-08
2024-07-08
 817
817
在美國(guó)FDA藥物評(píng)價(jià)和研究中心(CDER)過去5年批準(zhǔn)的新藥中,以核酸和多肽類藥物為代表的新分子療法是重要來(lái)源疙汁,占比穩(wěn)定在12%左右堕圾。隨著技術(shù)的進(jìn)步,這兩類療法不但具有突破既往被認(rèn)為“難以成藥”靶點(diǎn)的潛力恒猴,也在減重降糖荡拌、血脂代謝、脂肪肝诉母、癌癥等重大疾病領(lǐng)域具有廣闊應(yīng)用前景窿猿。2024上半年獲批的核酸和多肽療法均反映出產(chǎn)業(yè)的重要突破,下半年還有6款此類創(chuàng)新療法有望獲批常侣。
3款新藥閃耀全球
2024上半年蜡饵,兩款核酸療法首次獲批上市,蘊(yùn)含重要技術(shù)創(chuàng)新胳施。Rytelo獲得美國(guó)FDA批準(zhǔn)治療骨髓增生異常綜合征溯祸,這是全球首款端粒酶靶向療法。異常骨髓細(xì)胞常表達(dá)端粒酶舞肆,重建端粒焦辅,導(dǎo)致不受控制的細(xì)胞分裂。Rytelo通過抑制端粒酶活性椿胯,抑制癌變干細(xì)胞和祖細(xì)胞的增殖氨鹏,誘導(dǎo)癌細(xì)胞凋亡,改變疾病進(jìn)程压状。mRESVIA獲得美國(guó)FDA批準(zhǔn)用于預(yù)防呼吸道合胞病毒(RSV)感染引起的下呼吸道疾病仆抵,這是在COVID-19疫苗之外首個(gè)基于mRNA技術(shù)的獲批產(chǎn)品,標(biāo)志著mRNA療法的開發(fā)和應(yīng)用擴(kuò)展至更廣泛疾病領(lǐng)域种冬。
在多肽領(lǐng)域镣丑,2024年上半年不可不提的一款重磅療法是諾和諾德開發(fā)的超長(zhǎng)效基礎(chǔ)胰島素類似物諾和期(Awiqli,insulin icodec)兢努,自2024年3月起先后獲得瑞士漂岔、加拿大、歐盟贞卜、中國(guó)監(jiān)管機(jī)構(gòu)批準(zhǔn)上市辰想。這款胰島素每周一次皮下注射即可滿足一整周的基礎(chǔ)胰島素需求。
展望2024下半年爹嘁,全球范圍內(nèi)兩款治療核酸類療法有望首次獲批远驹,分別為治療血友病的小干擾RNA(siRNA)療法fitusiran梧部,和用于降脂的反義寡核苷酸(ASO)療法olezarsen;4款多肽類療法有望迎來(lái)獲批安坏,作用機(jī)制主要集中在GLP-1相關(guān)通路泊嗤。
全球大型藥企管線布局:重大疾病領(lǐng)域多點(diǎn)開花
從全球20家大型藥企管線布局來(lái)看,40款核酸類療法處于臨床研發(fā)階段颈冶。RNAi療法最為常見垮袭,且大多治療心血管疾病、脂肪肝等常見代謝類疾病摆抑。其次為RNA疫苗转砖,值得關(guān)注的是,在傳染性疾病以外鲸伴,有兩款個(gè)體化新抗原mRNA疫苗用于癌癥治療:默沙東和Moderna聯(lián)合開發(fā)的疫苗V940(mRNA-4157)正在針對(duì)黑色素瘤府蔗、非小細(xì)胞肺癌(NSCLC)開展3期臨床研究、針對(duì)皮膚鱗狀細(xì)胞癌開展2/3期研究挑围;羅氏和BioNTech聯(lián)合開發(fā)的autogene cevumeran(RG6180)正在實(shí)體瘤患者中開展2期臨床研究礁竞。
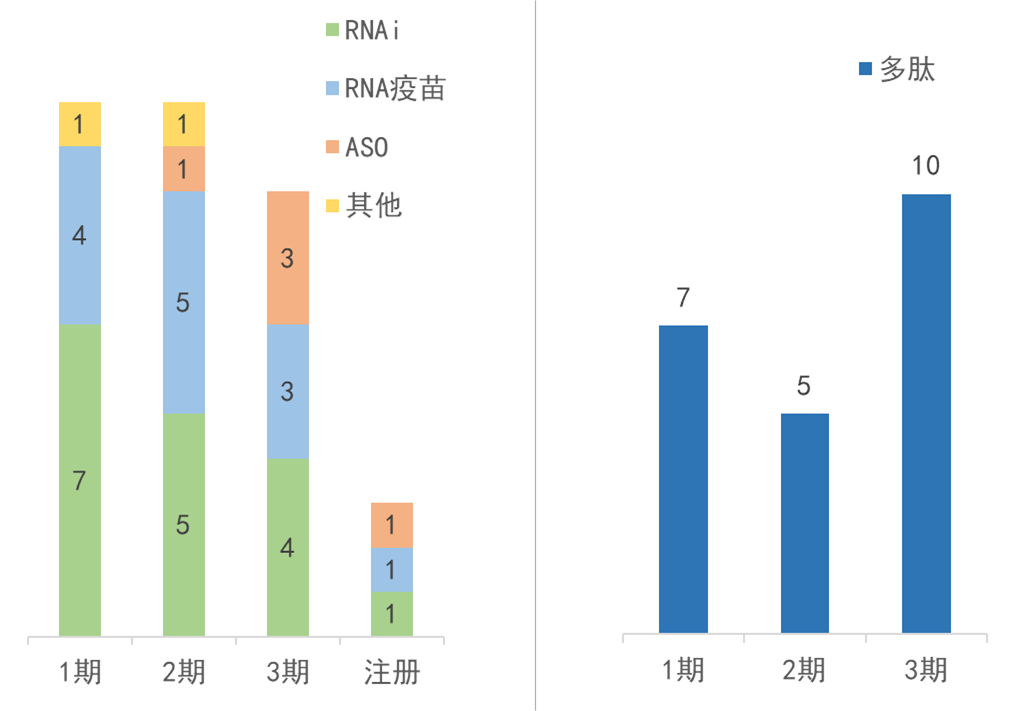
▲全球20家大型藥企的核酸類(左)和多肽類(右)療法管線分布;掃描文中二維碼可申請(qǐng)獲取完整管線列表
注:數(shù)據(jù)來(lái)源為各藥企公開信息杉辙,截至2024年6月模捂。20家大型藥企參考行業(yè)媒體Fierce Pharma 2024年4月榜單。部分療法已有適應(yīng)癥獲批蜘矢,但仍在推進(jìn)更多適應(yīng)癥/地區(qū)的研究與監(jiān)管申請(qǐng):包括2款新適應(yīng)癥注冊(cè)階段的核酸類療法狂男、1款新適應(yīng)癥3期在研核酸類療法;4款新適應(yīng)癥3期在研多肽類療法品腹。
全球20家大型藥企的臨床在研管線涵蓋超20款多肽類療法岖食。其中近一半聚焦于肥胖、糖尿病等代謝內(nèi)分泌疾病舞吭,其中9款靶向GLP-1等腸促胰島素信號(hào)通路泡垃,4款靶向胰淀素,這些療法大多已處于2/3期骚钮。
在研肽類其他治療方向還包括癌癥秘鳞、心血管疾病、自身免疫性疾病等设鼎。其中多款已處于臨床3期研發(fā)階段叔人,例如:武田的天然激素鐵調(diào)素的肽模擬物rusfertide(TAK-121),治療罕見癌癥真性紅細(xì)胞增多癥阿席;默沙東的PCSK9抑制劑MK-0616伍奏,治療高膽固醇血癥;強(qiáng)生靶向IL-23的JNJ-2113菠吟,擬治療銀屑病肿蚂。
同時(shí)啊衣,我們也能看到新型肽類分子的涌現(xiàn),羅氏開發(fā)的LUNA18為口服環(huán)肽相品、輝瑞開發(fā)的PF-08046045和安進(jìn)正在開發(fā)的MariTide均為抗體-多肽偶聯(lián)藥物卧他,反映了肽類設(shè)計(jì)技術(shù)的進(jìn)步示婉。
18家新銳完成新一輪融資
2024年分別有11家核酸類療法新銳和7家多肽類療法新銳完成早期融資品山,融資總額逾7億美元。
多肽新銳的技術(shù)聚焦于兩大方向烤低。一些新銳開發(fā)包括大環(huán)肽在內(nèi)的大環(huán)分子肘交,解決難以成藥靶點(diǎn),其中包括由蛋白設(shè)計(jì)先驅(qū)David Baker教授聯(lián)合創(chuàng)立的Vilya公司扑馁;另一些新銳致力于開發(fā)結(jié)合其他分子類型的復(fù)雜多肽涯呻,包括以多肽為配體的核藥、多肽偶聯(lián)藥物腻要、多肽融合蛋白复罐。
核酸領(lǐng)域中,siRNA療法新銳Alys Pharmaceuticals完成高達(dá)1億美元的種子輪融資雄家。Alys公司致力于重新定義皮膚病治療效诅,具有多種平臺(tái)技術(shù)與10多條研發(fā)管線,在研療法有多款為寡核苷酸偶聯(lián)藥物趟济。其他融資較高的核酸新銳同樣擁有獨(dú)特的技術(shù)乱投,比如Exsilio Therapeutics基于自然界中可編程遺傳元件,通過mRNA編碼安全插入全新基因顷编;Vico Therapeutics開發(fā)有潛力治療9種疾病的ASO療法卤檐。
2024下半年有望獲批的6款核酸和多肽類療法
Fitusiran:治療血友病A與血友病B
Fitusiran是一款小干擾RNA(siRNA)療法,旨在作為體內(nèi)產(chǎn)生/未產(chǎn)生凝血因子抑制物的血友病A或血友病B患者的預(yù)防性治療七迂。Fitusiran可降低抗凝血酶水平呀埠,從而促進(jìn)凝血酶生成黄骇,重新平衡止血功能并預(yù)防出血。在兩項(xiàng)3期臨床研究中,與對(duì)照組相比桶求,每月一次皮下注射fitusiran預(yù)防治療組患者的年化出血率降低了90%。Fitusiran注射液的上市申請(qǐng)已于2024年5月獲得中國(guó)國(guó)家藥監(jiān)局(NMPA)受理掖阶,并于6月獲得美國(guó)FDA受理舌肝。
Olezarsen:治療家族性乳糜微粒血癥綜合征(FCS)
Olezarsen是一種ASO療法,能夠抑制機(jī)體產(chǎn)生apoC3桃逆。ApoC3是一種在肝臟中產(chǎn)生察颅、調(diào)節(jié)血液中甘油三酯(TG)代謝的蛋白。Balance臨床3期試驗(yàn)結(jié)果顯示贫莹,F(xiàn)CS患者每四周接受一次80 mg olezarsen皮下注射治療叫质,患者的TG水平持續(xù)顯著降低(經(jīng)安慰劑調(diào)整)京挖,治療6個(gè)月降幅為44%;治療第6個(gè)月到第12個(gè)月期間降低59%物喷;經(jīng)安慰劑調(diào)整后的apoC3降幅在接受治療6個(gè)月時(shí)為74%卤材,在12個(gè)月時(shí)為81%。美國(guó)FDA已接受olezarsen用于治療FCS成人患者的新藥申請(qǐng)(NDA)并授予優(yōu)先審評(píng)資格峦失,預(yù)計(jì)在2024年12月19日前完成審評(píng)扇丛。Ionis還計(jì)劃在今年在歐盟和加拿大遞交監(jiān)管申請(qǐng)。
Glepaglutide:治療短腸綜合征(SBS)
Glepaglutide是一種長(zhǎng)效GLP-2類似物尉辑,設(shè)計(jì)用于每周兩次的皮下給藥帆精,旨在減少或消除SBS患者對(duì)腸外支持的需求。隨機(jī)雙盲關(guān)鍵3期試驗(yàn)EASE-1的結(jié)果顯示隧魄,與安慰劑相比卓练,每周兩次glepaglutide給藥在第24周顯著降低患者每周腸外支持所需總液體體積,14%的患者實(shí)現(xiàn)不再需要腸外支持輔助治療购啄,而安慰劑治療患者均不能停用腸外支持襟企。Zealand Pharma已于2023年末向美國(guó)FDA遞交glepaglutide的NDA,PDUFA日期為2024年12月22日狮含。
維派那肽:治療2型糖尿病
維派那肽注射液是一款長(zhǎng)效GLP-1受體激動(dòng)劑顽悼,具備無(wú)需滴定、每周一次啥诈、一次性預(yù)填充自動(dòng)注射筆皮下給藥等優(yōu)勢(shì)绎揭,顯著改善患者用藥依從性與生活質(zhì)量。在一項(xiàng)共納入273名初治中國(guó)2型糖尿病患者的3期試驗(yàn)中专稼,維派那肽注射液150 μg每周一次皮下注射治療24周數(shù)據(jù)顯著優(yōu)于安慰劑組叉室;4周治療即顯著降低空腹和餐后血糖,至第52周無(wú)反彈且降糖效果較24周更優(yōu)缰嘴。維派那肽的NDA已于2023年9月獲NMPA受理布撑。
瑪仕度肽(IBI-362):用于成人肥胖或超重患者的長(zhǎng)期體重控制
瑪仕度肽是一款長(zhǎng)效GLP-1/GCG受體雙重激動(dòng)劑,它利用脂肪跣屑妫基側(cè)鏈延長(zhǎng)作用時(shí)間辩洪,從而允許每周給藥一次。瑪仕度肽已在多項(xiàng)臨床研究中展現(xiàn)出優(yōu)秀的減重和降糖療效楣善,以及多重代謝獲益『宪瘢瑪仕度肽在中國(guó)超重或肥胖成人受試者中的3期臨床研究GLORY-1達(dá)成兩個(gè)主要終點(diǎn):4 mg和6 mg瑪仕度肽組受試者治療32周后體重相對(duì)基線的降幅,以及體重相對(duì)基線下降≥5%的受試者比例均顯著優(yōu)于安慰劑組陡花;第48周時(shí)減重療效進(jìn)一步提升僻邀;該研究所有關(guān)鍵次要終點(diǎn)也都達(dá)成。瑪仕度肽的NDA已于2024年2月獲NMPA受理。
艾本那肽:治療2型糖尿病
艾本那肽是一款長(zhǎng)效GLP-1受體激動(dòng)劑掠剑,采用獨(dú)特的藥物親和力偶合(DAC)技術(shù)屈芜,對(duì)GLP-1受體激動(dòng)劑類藥物exendin-4進(jìn)行化學(xué)修飾,從而形成穩(wěn)定的exendin-4白蛋白偶合物朴译,通過抵抗快速降解和快速腎清除克服了天然exendin-4較短血漿半衰期的缺點(diǎn)井佑,達(dá)到一周給藥一次的效果。臨床研究顯示眠寿,在2型糖尿病受試者中連續(xù)給藥24周躬翁,艾本那肽注射液可顯著降低受試者血糖水平,且第5周即可觀察到顯著的有效性澜公,治療后第5-17周血糖持續(xù)降低姆另,并在第17周趨于穩(wěn)定喇肋,療效可維持至52周坟乾。艾本那肽的NDA已于2024年4月獲NMPA受理。

 研發(fā)追蹤
研發(fā)追蹤
 藥時(shí)代
藥時(shí)代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽