
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥智網(wǎng)
藥智網(wǎng)  2024-07-10
2024-07-10
 683
683
2020年我國發(fā)布的《藥品注冊管理辦法》芬赢,首次提出了突破性治療藥物付找、附條件批準(zhǔn)甜湾、優(yōu)先審評審批和特別審批等四種藥品加快上市程序泌弧,為臨床急需藥品從研發(fā)到上市鋪筑了快速審批的“高速公路”理盆。
其中喊儡,附條件批準(zhǔn)程序不同于其它三種服務(wù)于研發(fā)注冊的程序垢啼,直接在臨床時間上開啟“綠燈”窜锯,縮短了臨床試驗到上市的時間。
但附條件批準(zhǔn)上市芭析,并不意味著獲批適應(yīng)癥研發(fā)階段的結(jié)束悄贴,最終的命運依然存有變數(shù)悟唆。
過河不拆橋,新冠產(chǎn)品命運的延續(xù)
據(jù)不完全統(tǒng)計诈绷,自2020年《藥品注冊管理辦法》實施以來拗辜,已有97款藥品附條件批準(zhǔn)上市,其中怒央,涉及新冠的產(chǎn)品有10款烤眉,包含5款新冠疫苗(其他新冠疫苗通過納入緊急使用上市)和5款新冠治療藥物。
新冠疫苗完成使命项请,技術(shù)沉淀不能丟烦盛。之前,在新冠疫情的陰影下肚轴,通過附條件批準(zhǔn)上市的新冠產(chǎn)品已完成了歷史使命紧邑,特別是新冠疫苗,從目前的新冠應(yīng)對措施來看稠还,暫時不再有市場需求伞缺,一眾疫苗藥企的業(yè)績在經(jīng)過因新冠疫苗導(dǎo)致業(yè)績大幅下滑的修復(fù)后,早已回歸常規(guī)疫苗的市場角逐中叁丧。
值得一提的是啤誊,雖然新冠疫苗已成為過去時,但沉淀的技術(shù)卻還在延續(xù)拥娄,如石藥集團(tuán)的新冠mRNA疫苗(SYS6006)蚊锹,是我國首款上市的mRNA疫苗。新冠疫情的出現(xiàn)稚瘾,讓mRNA技術(shù)路線被推上研發(fā)熱潮枫耳,缺席mRNA就意味著趕不上下一個藥物研發(fā)黃金地,2024年6月25日孟抗,石藥集團(tuán)的SYS6020獲國家藥監(jiān)局批準(zhǔn)開展臨床試驗迁杨,該產(chǎn)品是全球首款獲批臨床試驗的基于mRNA-LNP的細(xì)胞治療產(chǎn)品,標(biāo)志著我國的mRNA技術(shù)路線又踏上了新的征程凄硼。
因治新冠聞名铅协,奔著“他鄉(xiāng)”而去。在新冠疫情期間摊沉,通過附條件批準(zhǔn)上市的5款新冠治療藥物分別為阿茲夫定片狐史、阿泰特韋片/利托那韋片、來瑞特韋片用六、氫溴酸氘瑞米德韋片和先諾特韋片/利托那韋片近振,在后疫情時代,雖然5款藥物名聲響,但在新冠適應(yīng)癥市場上的表現(xiàn)不及常規(guī)感冒藥暴遂,但并不完全意味著其命運的終結(jié)暂呈。
阿茲夫定片在附條件批準(zhǔn)用于治療新冠之前,就已附條件批準(zhǔn)用于與核苷逆轉(zhuǎn)錄酶抑制劑及非核苷逆轉(zhuǎn)錄酶抑制劑聯(lián)用粘伊,治療高病毒載量(HIV-1 RNA≥100000 copies/ml)的成年HIV-1感染患者辜辰,“雙重身份”的阿茲夫定片,因新冠名聲大噪惠翼,不僅在2023年被納入醫(yī)保目錄束敦,且商業(yè)化進(jìn)程快速推進(jìn)。藥智數(shù)據(jù)顯示支摹,阿茲夫定片2023年國內(nèi)公立醫(yī)療機(jī)構(gòu)銷售額為10.96億元匾瓣,同比增長261.53%,在回歸HIV領(lǐng)域后代郊,也算得上是一位驍勇之將缕陕。
氫溴酸氘瑞米德韋片作為以新冠適應(yīng)癥注冊申報獲批的1類創(chuàng)新藥,在2023年1月附條件批準(zhǔn)后疙挺,就向另一熱門適應(yīng)癥進(jìn)發(fā),藥智數(shù)據(jù)顯示怜浅,2023年2月铐然,旺山旺水生物/中科院上海藥物研究所/中科院武漢病毒研究所就以干混懸劑的劑型,提交了用于治療呼吸道合胞病毒(RSV)感染的臨床申請恶座,且在2023年5月獲批臨床搀暑,目前已推進(jìn)至2期臨床試驗階段。
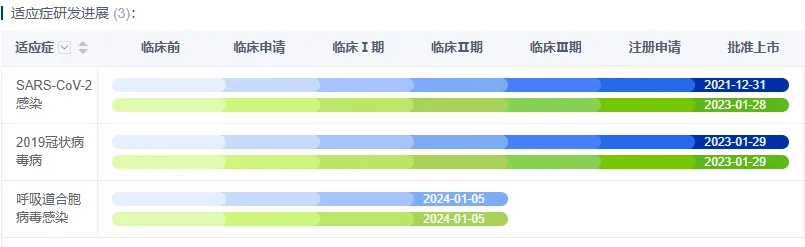
圖1 氫溴酸氘瑞米德韋臨床適應(yīng)癥研發(fā)情況 圖片來源:藥智數(shù)據(jù)
附條件批準(zhǔn)跨琳,并非“護(hù)身符”
除了新冠產(chǎn)品外自点,其他附條件批準(zhǔn)的藥品命運如何?筆者根據(jù)CDE官網(wǎng)公示的附條件批準(zhǔn)品種的具體情況整理了77款產(chǎn)品(詳見文末脉让,數(shù)據(jù)截至7月7日)桂敛,其中,15款藥品附條件批準(zhǔn)狀態(tài)發(fā)生變動溅潜。
表1 15款附條件批準(zhǔn)狀態(tài)變動藥品情況
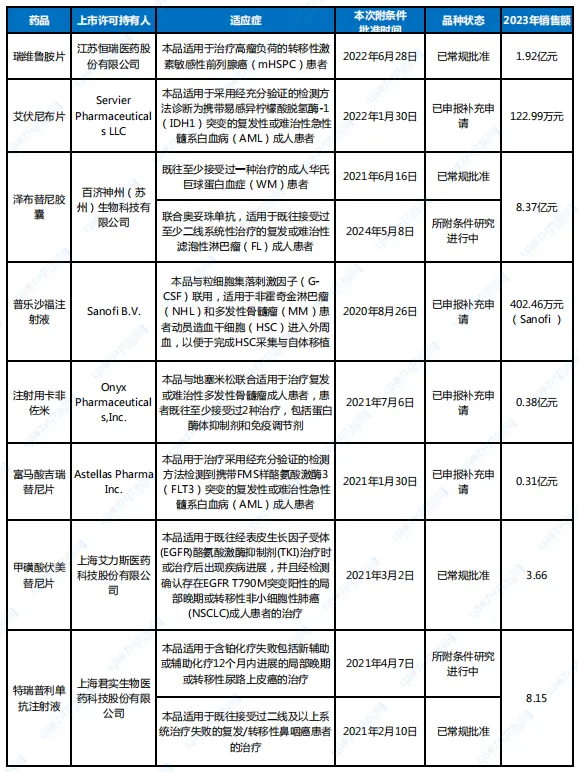
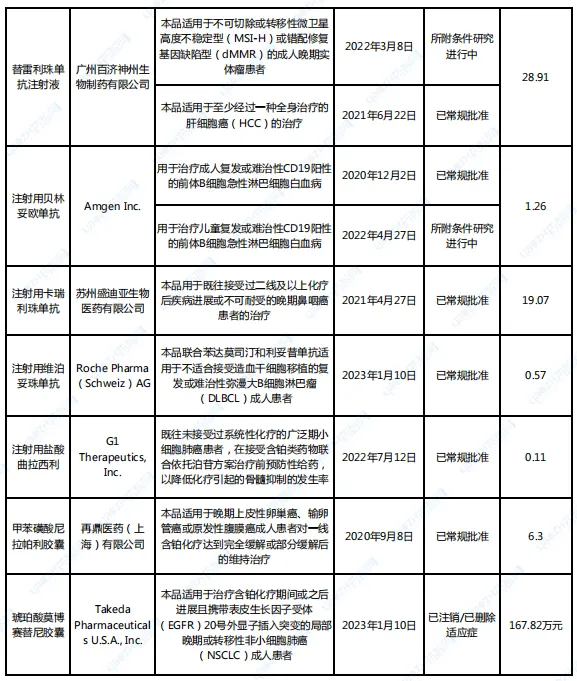
數(shù)據(jù)來源:根據(jù)CDE官網(wǎng)公示整理
10個產(chǎn)品“修成正果”术唬。能夠通過附條件批準(zhǔn)的藥品,都是在臨床上取得突破性治療數(shù)據(jù)的佼佼者墅瑟,不僅達(dá)到現(xiàn)有治療藥物和手段無法企及的高度避扎,而且也是市場所急迫的,一旦順利完成常規(guī)批準(zhǔn)身份的轉(zhuǎn)換枪素,市場表現(xiàn)必將一飛沖天咬跷。
77款藥品中,已有10款轉(zhuǎn)為常規(guī)批準(zhǔn),絕大部分藥品2023年國內(nèi)公立醫(yī)療機(jī)構(gòu)銷售額已破億演避,其中氨鹤,替雷利珠單抗注射液達(dá)28.91億元,值得一提的是旭绝,該藥品的另一項用于不可切除或轉(zhuǎn)移性微衛(wèi)星高度不穩(wěn)定型(MSI-H)或錯配修復(fù)基因缺陷型(dMMR)的成人晚期實體瘤患者適應(yīng)癥也獲附條件批準(zhǔn)绷荔,一旦轉(zhuǎn)為常規(guī)批準(zhǔn),市場前景不可限量桨皂。
注射用維泊妥珠單抗和注射用鹽酸曲拉西利是唯二的兩款銷售額暫未破億的產(chǎn)品茄码,2023年國內(nèi)公立醫(yī)療機(jī)構(gòu)銷售額分別為0.57億元和0.11億元,但注射用維泊妥珠單抗是在2023年1月才獲附條件批準(zhǔn)衰屡,轉(zhuǎn)為常規(guī)批準(zhǔn)也不過數(shù)月之久构韵,2024年銷售額破億已無懸念。
而注射用鹽酸曲拉西利也是在2023年10月才轉(zhuǎn)為常規(guī)批準(zhǔn)趋艘,2023年12月疲恢,國家藥監(jiān)局同意G1 Therapeutics將該藥生產(chǎn)技術(shù)轉(zhuǎn)讓至先聲藥業(yè),首批地產(chǎn)化產(chǎn)品在4月下線瓷胧,提升了患者可及性显拳。同月,中國臨床腫瘤學(xué)會(CSCO)發(fā)布的《CSCO小細(xì)胞肺癌診療指南(2024版)》搓萧,更新了廣泛期小細(xì)胞肺癌(ES-SCLC)的一線治療推薦杂数,由Ⅱ級推薦、2A類證據(jù)修改為Ⅰ級推薦瘸洛、1A類證據(jù)揍移;復(fù)發(fā)小細(xì)胞肺癌二線治療推薦,由2A類證據(jù)修改為1A類證據(jù)反肋,種種跡象表明那伐,注射用鹽酸曲拉西利將在2024年發(fā)起市場滲透“總攻”。
轉(zhuǎn)為常規(guī)批準(zhǔn)才能打破臨床用藥的觀望狀態(tài)石蔗,這在即將“修成正果”的藥品市場表現(xiàn)上也得以印證披滑,艾伏尼布片、普樂沙福注射液轮拼、注射用卡非佐米和富馬酸吉瑞替尼片等4款附條件批準(zhǔn)的藥品適應(yīng)癥窗项,目前正處于補充申請階段,在“轉(zhuǎn)正”之前的市場表現(xiàn)一般衷求,其中帮声,注射用卡非佐米和富馬酸吉瑞替尼片2023年銷售額最高,雖然均在2021年就已獲批搞督,但直到2023年专散,離破億還有較遠(yuǎn)差距。
附條件批準(zhǔn)并非“護(hù)身符”。琥珀酸莫博賽替尼膠囊在2023年1月獲國家藥監(jiān)局附條件批準(zhǔn)喉隙,但在2024年4月注銷了批準(zhǔn)的適應(yīng)癥叶皿,武田制藥(中國)的公告顯示,是由于3期EXCLAIM-2臨床試驗結(jié)果未達(dá)到主要研究終點畏帖,不符合之前國家藥監(jiān)局授予的附條件批準(zhǔn)確證性研究數(shù)據(jù)要求拢掷。
值得注意的是,琥珀酸莫博賽替尼膠囊當(dāng)初所附條件的研究時限定為4年曹动,決定命運的時刻尚遠(yuǎn)斋日,但卻如此早的選擇放棄,究其原因墓陈,與武田制藥的開發(fā)策略有極大的關(guān)系恶守。
琥珀酸莫博賽替尼膠囊早在2021年9月就基于Exkivity 1/2期二線單臂試驗,獲美國FDA加速批準(zhǔn)上市贡必,成為全球首款且唯一獲批的治療EGFR 20號外顯子插入突變晚期非小細(xì)胞肺癌口服靶向藥兔港,之后獲國家藥監(jiān)局附條件批準(zhǔn)同樣基于Exkivity 1/2期試驗。
在接下來的臨床試驗中仔拟,武田制藥并沒有延續(xù)二線應(yīng)用衫樊,轉(zhuǎn)而將研究瞄準(zhǔn)一線治療,但在2023年7月利花,武田制藥披露了琥珀酸莫博賽替尼膠囊對比含鉑化療科侈,用于一線治療的EXCLAIM-2試驗因無效而終止,這時再調(diào)頭繼續(xù)二線治療的臨床研究已為時過晚晋被。彼時,強生的埃萬妥單抗聯(lián)合化療在新診斷EGFR外顯子20插入突變的晚期或轉(zhuǎn)移性非小細(xì)胞肺癌患者中開展的3期PAPILLON研究取得積極結(jié)果刚盈,此外彪趣,迪哲醫(yī)藥的舒沃替尼片即將在國內(nèi)附條件批準(zhǔn),3款針對EGFR exon20ins的藥物均獲批在二線蓄梯。
因何推新規(guī)拌微,為何又放緩腳步
目前,我國的藥品附條件批準(zhǔn)程序框架是在2020年建立起來的游推,在《藥品注冊管理辦法》發(fā)布之后殊储,又出臺了《藥品附條件批準(zhǔn)上市申請審評審批工作程序》和《藥品附條件批準(zhǔn)上市技術(shù)指導(dǎo)原則》,為進(jìn)一步完善該程序胳雁,2023年8月瘤慕,藥監(jiān)局發(fā)布了新的《工作程序》修訂稿征求意見稿。
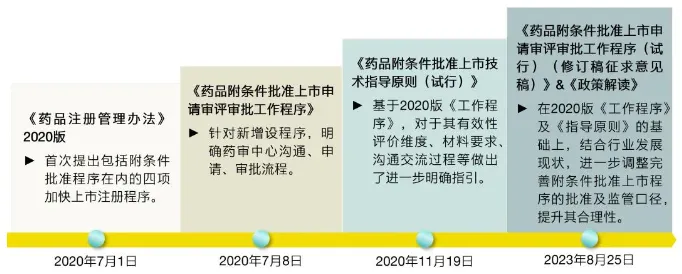
圖2 中國附條件批準(zhǔn)相關(guān)政策發(fā)展路徑 圖片來源:安永EY公眾號
治療領(lǐng)域扎堆康逝,后續(xù)臨床動力不足鹰柄。CDE《2023年度藥品評審報告》顯示,2020年至2023年,共有107個適應(yīng)癥獲附條件批準(zhǔn)擎融,其中衣右,腫瘤、新冠彬祖、血液疾病茁瘦、內(nèi)分泌疾病、抗感染储笑、風(fēng)濕性及免疫疾病和外科領(lǐng)域的適應(yīng)癥分別為84個甜熔、13個、5個南蓬、2個纺非、1個、1個和1個赘方,其中烧颖,腫瘤領(lǐng)域最多,占79%窄陡,若剔除新冠疫情的特殊影響炕淮,腫瘤領(lǐng)域?qū)⒄嫉浇?0%。
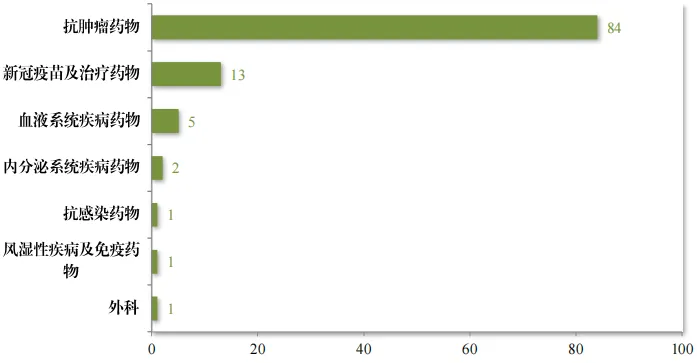
圖3 2020年至2023年附條件批準(zhǔn)藥品適應(yīng)癥分布情況(按適應(yīng)癥計)圖片來源:CDE《2023年度藥品評審報告》
作為同樣廣受臨床關(guān)注的兒童群體跳夭,特別是罕見病群體涂圆,獲批的藥品鳳毛麟角,2020年以來湃儒,兒童用藥方面还纤,僅在2022年有6個適應(yīng)癥附條件批準(zhǔn),其他年度均無進(jìn)展氯摆,至于罕見病方面埠邻,在2020年附條件審批程序制度建立當(dāng)年曇花一現(xiàn),有3個適應(yīng)癥獲批峡冻,之后就偃旗息鼓苞惰,筆者認(rèn)為,若不是近年來國家醫(yī)保等政策大力向罕見病藥物傾斜最奸,怕是2023年也將為零咕诊。
表2 2020年至2023年附條件批準(zhǔn)藥品患者領(lǐng)域分布(按適應(yīng)癥統(tǒng)計)
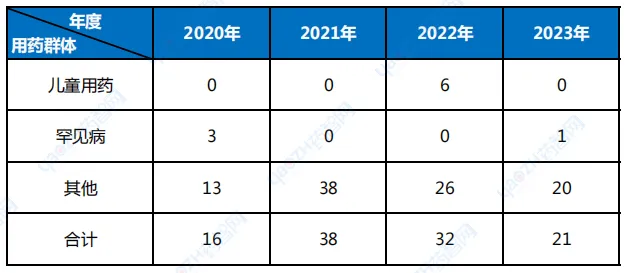
數(shù)據(jù)來源:安永EY公眾號
大量研發(fā)資源的集中,也導(dǎo)致非腫瘤領(lǐng)域研發(fā)動能的欠缺拜殊,比如賽諾菲的普樂沙福注射液在2020年8月獲國家藥監(jiān)局附條件批準(zhǔn)上市焚卖,目前還未轉(zhuǎn)為常規(guī)批準(zhǔn),但這期間匿党,已有3家藥企的國產(chǎn)藥物獲批翠霍,這不僅影響藥企創(chuàng)新研發(fā)的積極性锭吨,且浪費了大量的臨床研發(fā)資源。
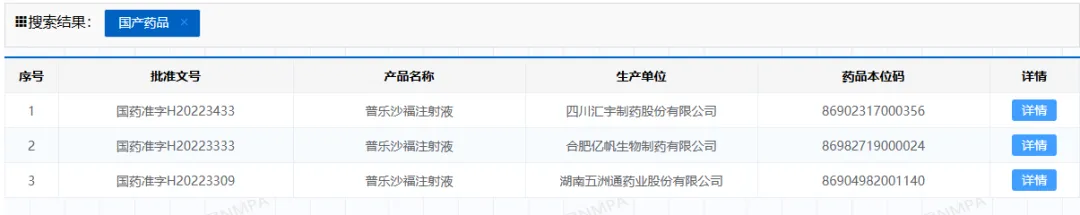
圖4 國產(chǎn)普樂沙福注射液獲批情況 圖片來源:國家藥監(jiān)局官網(wǎng)
2023版的征求意見稿中寒匙,明確提出藥品獲附條件批準(zhǔn)上市后零如,原則不再同意其他同機(jī)制、同靶點锄弱、同適應(yīng)癥的同類藥品開展相似的以附條件上市為目標(biāo)的臨床試驗申請考蕾,此外,在轉(zhuǎn)為常規(guī)批準(zhǔn)之前会宪,不受理仿制藥注冊申請肖卧,也不批準(zhǔn)生物類似藥上市注冊申請,因此掸鹅,要想通過附條件批準(zhǔn)的“綠燈”塞帐,除了藥企間的競速外,更重要的是選準(zhǔn)目標(biāo)巍沙,倒逼藥企研發(fā)資源在疾病領(lǐng)域的分散葵姥。
此外,我國常規(guī)批準(zhǔn)轉(zhuǎn)化率較低句携,CDE報告顯示献舍,2020年《藥品注冊管理辦法》實施以來,到2023年底宴亦,有95個藥品附條件批準(zhǔn)上市苟及,其中,19個藥品完成上市后研究轉(zhuǎn)為常規(guī)批準(zhǔn)啥闪,轉(zhuǎn)化率僅為20%夷钥,而美國和歐盟的轉(zhuǎn)化率約為50%和39%,一方面是因為我國附條件批準(zhǔn)實施較晚曙悠,另一方面是給予的“寬限期”較長婿残,附條件批準(zhǔn)的91個適應(yīng)癥中,有38個適應(yīng)癥研究時限為5年影其。
2023版的征求意見稿中脖煮,明確提出藥品附條件上市申請遞交前贬奢,就應(yīng)已啟動確證性研究乍厉,且要以首例受試者入組為判斷是否啟動的標(biāo)準(zhǔn),此外悦追,完成時限原則上不超4年凹蜈。
值得注意的是,征求意見稿的征求期限早在2023年9月25日就結(jié)束忍啸,至今已過去9個多月仰坦,并未見正式文件發(fā)布履植,筆者分析,該政策的變化悄晃,對國內(nèi)藥企研發(fā)格局有著巨大的影響玫霎,比如迪哲醫(yī)藥的舒沃替尼片,若是按征求意見稿的規(guī)定妈橄,恐怕就無出頭之日了庶近,管理層也在衡量利弊,對政策的變化慎之又慎眷蚓。
在新規(guī)發(fā)布之前鼻种,已放緩獲批腳步,國家藥監(jiān)局查詢顯示沙热,截至目前叉钥,僅有6個藥品的各1項適應(yīng)癥獲附條件批準(zhǔn),其中篙贸,首次批準(zhǔn)上市的藥品有4個码累,分別為瑞普替尼膠囊、戈利昔替尼绳练、妥拉美替尼膠囊和澤沃基奧侖賽注射液锦镶,而2023年,剔除新冠附條件批準(zhǔn)的藥品有17個(適應(yīng)癥同為17)枫昏,其中首次批準(zhǔn)的藥品為12個偶屯,2024年半年過去,通過數(shù)量僅為上一年的三成旋蝎。
結(jié)語
附條件批準(zhǔn)程序的意義冶习,在于為早期臨床試驗數(shù)據(jù)支持能夠治療嚴(yán)重危及生命且尚無有效治療手段的疾病以及臨床急需的藥品開“綠燈”,并不是讓藥企憑借早期優(yōu)異的臨床數(shù)據(jù)孕序,以附條件批準(zhǔn)名義爭取早獲批琐幔,如何避免藥企臨床資源扎堆,又不影響研發(fā)激情递市,還要保障臨床用藥的持續(xù)更新为稽,才是未來新規(guī)要解決的問題。
參考來源:
1.石藥集團(tuán)公告
2.武田制藥(中國)官網(wǎng)
3.CDE官網(wǎng)及年度藥品審評報告
4.中國經(jīng)營報《沖擊一線未果武田制藥莫博賽替尼在美主動退市》

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 4
4

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 5
5
 熱門資訊
熱門資訊