
 產業(yè)資訊
產業(yè)資訊
 氨基觀察
氨基觀察  2024-07-10
2024-07-10
 362
362
創(chuàng)新藥就像挖礦鸭叙,臨床數(shù)據(jù)是 “挖出來的是真正的礦”的證明质礼,所有藥企都是靠這個證據(jù)去融資、BD缀拭、申請藥物上市乡括。
因此,某種程度上智厌,臨床數(shù)據(jù)是藥企最寶貴的財富。這也是為什么,生物科技行業(yè)極為重視知識產權保護尔兆,比如通過專利予裳、著作權、商業(yè)秘密等方式對這些數(shù)據(jù)本身進行保護蜈坛。
然而芙继,專利能夠保護的僅是很少一部分,大量的具體試驗數(shù)據(jù)雖然不能申請專利啦铣,但對藥品審批來說又至關重要锻碎。最直觀的例子,莫過于仿制藥的注冊審批基于新藥的試驗數(shù)據(jù)圈烘,可以免于重新進行臨床試驗竖拢,從而大大節(jié)省時間和資金成本。
但對于原研藥來說筋氮,經歷“雙十”考驗獲批上市后莫切,若專利保護期已屆滿或即將屆滿,且沒有額外的制度保護心唆,那將意味著贸伐,其很難在有限的時間內收回成本,收益也就無從談起怔揩。這會極大降低藥企的創(chuàng)新捉邢、研發(fā)積極性。
倘若大量藥企的創(chuàng)新回報不及預期商膊,整個行業(yè)的投資生態(tài)也將遭受沖擊伏伐。畢竟,投資最重要的是便是預期翘狱,沒有人愿意投資于自己無法掌控/預期的東西秘案。
從這個角度來說,創(chuàng)新藥關鍵的知識產權不僅是專利潦匈,更包括藥品試驗數(shù)據(jù)保護(RDP)阱高。因為,這可以防止競爭對手在一定時期內茬缩,利用自己的臨床數(shù)據(jù)申報仿制藥上市赤惊。
比如最早實行RDP制度的美國,其規(guī)定自生物創(chuàng)新藥上市日起凰锡,12年內FDA不得批準仿制藥的上市申請未舟。其底層邏輯在于,誰做原始的安全性有效性數(shù)據(jù)忿脉,誰擁有數(shù)據(jù)的所有權少烙,誰就應該得到相應的保護居删。
那么,藥品試驗數(shù)據(jù)保護到底是什么尸褪,為什么它比專利保護還要重要榄兑?
攔截仿制藥的利器
眾所周知,新藥研發(fā)是一個風險高线区、投資大马窘、周期長的過程,藥物有效性與安全性數(shù)據(jù)的獲得需要進行長期推進和不斷拓展的臨床試驗铜殉,并為此持續(xù)投入大量的人力與物力寡专。
因此,如果對原研藥企業(yè)付出巨大代價取得的藥品試驗數(shù)據(jù)不加以保護郊察,這會削弱原研藥企業(yè)的研發(fā)積極性茧伍,同時也會影響原研藥企業(yè)的持續(xù)研發(fā)投入,最終影響藥品的可及性憎茂。
藥品試驗數(shù)據(jù)保護制度起源于美國1984年通過的《藥品價格競爭和專利期補償法案》(《Hatch-Waxman法案》)珍语。
這個法案首次明確提出了藥品“數(shù)據(jù)保護”,確立了針對藥品試驗數(shù)據(jù)的獨占保護制度竖幔。
FDA則在Hatch-Waxman法案之上板乙,依據(jù)藥品注冊路徑的不同給予了新化學實體(NCE)、全新的生物藥實體(NBE)不同時長的保護周期拳氢。其中募逞,NCE最長保護期為7.5年,NBE最長達12年馋评,無論是NCE還是NBE放接,保護方式都為“不受理+不批準”,比如NBE上市4年內不受理仿制藥上市申請留特,4年后可以受理申請纠脾,但8年內不得批準上市。
簡單來說蜕青,所謂數(shù)據(jù)保護苟蹈,就是監(jiān)管機構在一定時間內不可以依賴原研公司提交的數(shù)據(jù)批準潛在的仿制藥品進入市場,直接延遲仿制藥進入市場的時間旋钓。
當然垫暑,在試驗數(shù)據(jù)保護期結束后,F(xiàn)DA只需要審查仿制藥是否與新藥具有生物等效性即可鱼谅。
為了保護本土藥企蔚分,美國極力向其他國家推行該制度。作為國際協(xié)議益若,《與貿易有關的知識產權協(xié)議》(TRIPS協(xié)議)最早引入了藥品試驗數(shù)據(jù)保護制度碟舱,并成為了最早明確規(guī)定藥品實驗數(shù)據(jù)保護內容的國際標準洁操。而后日本、歐盟等國家率先響應并積極實施晨下,至今累冠,全球已有多個國家以法律法規(guī)的形式對藥品試驗數(shù)據(jù)保護加以規(guī)制。
你可能會疑惑拳芹,藥企已經享有專利保護,為什么還要數(shù)據(jù)保護岸腥?
那是因為矢勉,只有專利是不夠的,知識產權保護需要貫穿創(chuàng)新藥的全生命周期茉唉,尤其是對于生物藥來說固蛾。
額外的安全感
專利保護和數(shù)據(jù)保護,可以看做是兩種具有互補作用的知識產權保護方式度陆,都有助于激勵開發(fā)創(chuàng)新藥所需的巨大投資艾凯。后者則為藥企提供了急需的額外安全感。
鑒于原研藥的臨床試驗充滿變數(shù)且耗時長久懂傀,當藥物最終獲批上市時趾诗,其法定專利保護期可能已經或即將結束。
在沒有額外保護機制的情況下蹬蚁,其他企業(yè)可以選擇開發(fā)恃泪、改良含有相同活性成分和相同適應癥的同品種藥品,并申請仿制藥的注冊犀斋。
對于前期投入成本巨大的原研藥企來說贝乎,這種情況將不利于其收回成本并獲得收益,進而可能降低原研藥企的研發(fā)積極性叽粹。
由于各國專利規(guī)則的不同览效,對于某一新分子實體,臨床實驗可以證明其安全性盼饼,但往往一個專利文件會有各種各樣的規(guī)定新砖。特別是生物制劑相較于小分子藥物,更難以通過專利手段抵御生物類似物的挑戰(zhàn)津咒。如果監(jiān)管機構允許利用相同數(shù)據(jù)批準相似藥物另碍,那么專利法所能提供的保護力度將大打折扣。
除了生成相關數(shù)據(jù)的成本高昂哩拔,生物技術發(fā)明專利保護資格的不確定性以及有效執(zhí)行這些權利的能力也進一步凸顯了監(jiān)管數(shù)據(jù)保護的必要性自烛。
而數(shù)據(jù)保護則不同,藥企做出來的全套數(shù)據(jù)都會得到保護影焙,仿制藥方做出來的數(shù)據(jù)也會得到保護戈秕。也就是說即使原研藥享有數(shù)據(jù)保護血肯,也不會妨礙仿制藥獨立進行全部臨床試驗,獨立產生安全性有效性的臨床數(shù)據(jù)嫡贷。這是數(shù)據(jù)保護和專利保護不同的地方途居。
當然,對于藥企來說朴埂,相比專利保護袍镀,數(shù)據(jù)保護最大的不同在于,其是在獲得上市許可之后才開始起算冻晤,期限和效力均十分明確苇羡,能夠有效阻止仿制藥依賴原研藥臨床數(shù)據(jù)獲得上市許可。
因此鼻弧,從這個角度來說设江,RDP制度的重要目的之一,就是賦予原研藥在上市后對其原始數(shù)據(jù)享有一定期限的市場獨占期攘轩,通過不予批準其他企業(yè)利用未披露數(shù)據(jù)進行的仿制藥或新藥申請叉存,為原研藥企提供額外的保護。
穩(wěn)定回報預期
2009年7月度帮,美國國會召開聽證會歼捏,研究美國生物制劑的12年監(jiān)管數(shù)據(jù)保護期的立法提案。第二年够傍,《生物制劑價格競爭和創(chuàng)新法》簽署成為法律甫菠,從美國監(jiān)管機構首次批準之日起,新生物制劑的數(shù)據(jù)排他性為期12年冕屯。
可以說寂诱,除了自由定價,正是對于知識產權的全方位蒿庙、嚴密保護搓陈,造就了美國生物科技行業(yè)的蓬勃與繁榮。
底層邏輯在于砖蕾,這讓大量VC/PE看到了未來回報的預期北捣。
風投資金對于生物技術行業(yè)至關重要,而如果看不到未來的回報“承諾”廷共,投資機構沒有理由投資于這樣一個高成本论辈、高風險的行業(yè)。這種“承諾”诸鲸,一方面取決于藥企的研發(fā)實力伪您,機構的投資能力,另一方面則有賴于制度保護使驰。
知識產權保護订菇,包括專利和數(shù)據(jù)保護消忘,是創(chuàng)新藥企的根基,也是投資的基礎哈误。沒有人愿意投資自己無法掌控/預期的東西哩至。
對于投資者來說,底線很簡單:如果生物技術公司的臨床數(shù)據(jù)在合理的時間內受到保護蜜自,它們更愿意加入這場賭局菩貌。
因為,它們往往根據(jù)隨著時間的推移的回報率來證明其合理性袁辈。而獲得的回報菜谣,則取決于投資的持久性——換句話說,創(chuàng)新藥將產生多長時間的現(xiàn)金流和利潤晚缩。
這種情況下,監(jiān)管數(shù)據(jù)保護至關重要媳危。因為正如前文所說荞彼,專利法在某種程度上為藥企提供了這種保護,但并不完全待笑。
而在一些投資人士看來鸣皂,當前趨勢還在發(fā)生變化,由于一些最高法院的其他裁決暮蹂,專利法今天提供的保護更少维瑰。因此,在他們眼中鼻发,數(shù)據(jù)保護變得更加重要茶窍。
刨除美國訴訟的天文成本,對于初創(chuàng)公司辑奔,監(jiān)管數(shù)據(jù)保護在實踐中非常重要扫帝,因為你不能指望能夠通過漫長的專利訴訟,來維護自己的權利哲琼。
簡單來說融乖,專利和RDP在內的產權保護,不僅讓創(chuàng)新藥企怖冷,也讓行業(yè)的另一重要參與者——投資機構闺焦,對于創(chuàng)新藥這門生意的投資回報,預期變得更加穩(wěn)定俺膊。
是否破壞了藥物的獲燃闷摺?
當然勘伺,市場也擔憂跪腹,RDP通過延長新藥享有的市場排他性期限褂删,會讓藥企變得更加壟斷,進而影響藥物的可及性冲茸,并會將醫(yī)療保健成本推高到不可持續(xù)的水平屯阀。
然而,日內瓦網絡的研究表明轴术,這種擔憂或許是沒有根據(jù)的难衰。比如加拿大和日本子,它們近年來都延長了各自的RDP期限逗栽,但數(shù)據(jù)顯示盖袭,在變化之前和之后的幾年里,國家藥品支出占GDP的百分比仍然幾乎持平彼宠。
另外鳄虱,有機構統(tǒng)計53個國家的市場數(shù)據(jù)后,的除了RDP反而能夠增加創(chuàng)新藥物的可及性凭峡。
2018-2022年拙已,全球推出的所有創(chuàng)新藥物中獲批創(chuàng)新藥物的比例,具有RDP的市場平均在全球至少一個市場擁有31.5%的創(chuàng)新藥物煤丧,而沒有RDP的市場平均有11.1%的創(chuàng)新藥物可用枯誓。
這意味著,RDP市場中的患者可及的創(chuàng)新藥物數(shù)量是沒有RDP市場的患者的3倍左右裕唯。
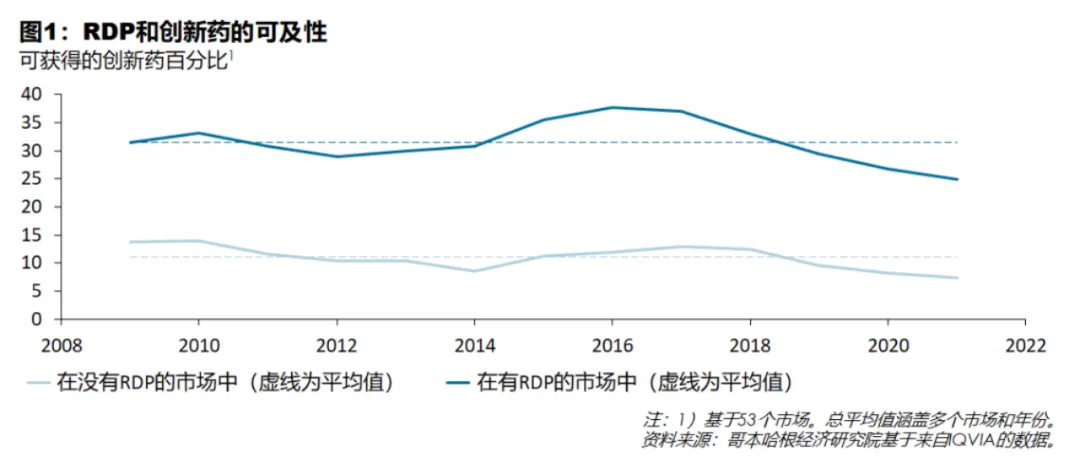
造成這種差異的原因之一是五浊,與其他知識產權保護機制一樣,RDP加強了藥企在一市場推出創(chuàng)新藥物的立項依據(jù)扔摔。因為藥企將有更好的機會享受一段保護期菲缕,在此期間它們可以產生收入,以收回開發(fā)和推出創(chuàng)新藥物的成本四雏。
此外勿见,數(shù)據(jù)顯示,在有RDP的市場上進行了更多的臨床試驗百擒。比較在有和沒有RDP的市場進行的平均臨床試驗數(shù)量资村,發(fā)現(xiàn)有RDP的市場平均每百萬人有21項臨床試驗,而沒有RDP的市場平均有4項仍桌。
這一數(shù)據(jù)也能夠說明为猩,RDP正向激勵了創(chuàng)新藥物臨床研發(fā)。
而在業(yè)內人士看來忱叭,實施RDP也有可能會鼓勵更多的“創(chuàng)新”隔崎。核心在于,數(shù)據(jù)保護提供了另一種形式的知識產權保護,會推遲生物仿制藥公司將產品推向市場爵卒,除非它們自行取得的證明藥品安全性虚缎、有效性的試驗數(shù)據(jù)。
國內何時跟上
如下圖所示钓株,全球擁有高度創(chuàng)新的生物制藥行業(yè)的主要市場实牡,基本擁有強大的知識產權保護和執(zhí)法體系。美國對于創(chuàng)新生物制劑的數(shù)據(jù)保護期為最長達12年轴合,歐盟采取“8+2+1”的保護模式创坞,日本對創(chuàng)新藥的保護期由6年延長至8年,加拿大則采用“6+2”的保護模式受葛。
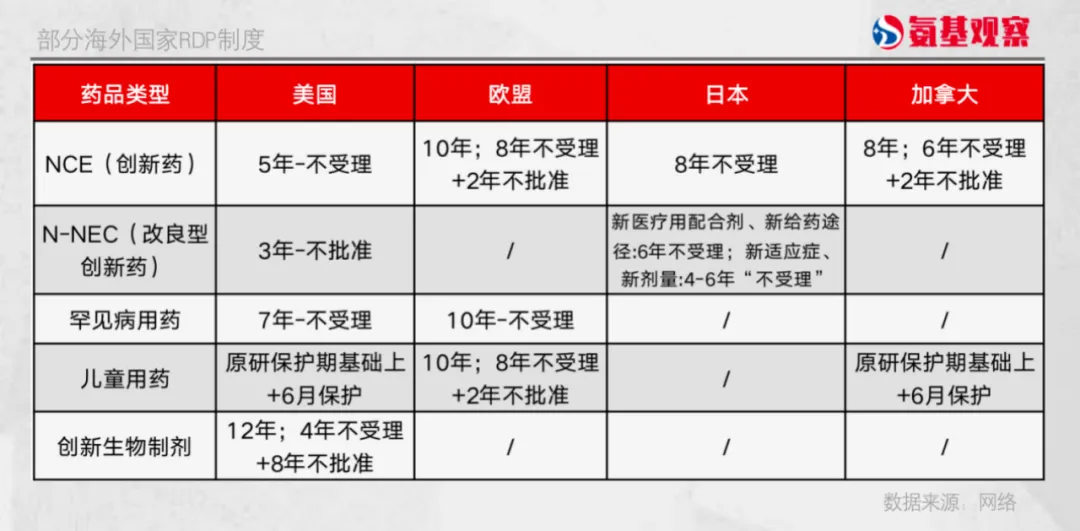
回到國內來說题涨,隨著創(chuàng)新藥領域的大步發(fā)展,監(jiān)管已經在最新的《專利法》修正案中加強了對創(chuàng)新藥的知識產權保護总滩。然而與國際水平相比纲堵,國內醫(yī)藥創(chuàng)新知識產權保護體系仍有待完善,數(shù)據(jù)保護具體條例還有待進一步落地蝌秕。
事實上船庐,早在本世紀初加入WTO后,我們國家便簽署了TRIPs協(xié)議地捂,并2002年實施的《藥品管理法實施條例》中引入了相關數(shù)據(jù)保護內容。但截至目前掸校,仍處于有總體規(guī)定滤重、無實施細則的狀態(tài)。
真正的改革涮巩、完善序幕應當是始于2018年鲫庆,藥監(jiān)局出臺《藥品試驗數(shù)據(jù)保護實施辦法(暫行)(征求意見稿)》,系統(tǒng)性制定藥品試驗數(shù)據(jù)保護制度向社會公開征求意見矩沥;2022年5月掏榜,藥監(jiān)局綜合司發(fā)布“公開征求《中華人民共和國藥品管理法實施條例(修訂草案征求意見稿)》意見”,將數(shù)據(jù)保護期統(tǒng)一設立為藥品注冊上市后6年咪干。
同年7月络兜,藥監(jiān)局在回復人大代表的相關提案中表示,待《藥品管理法實施條例》修訂實施后部翘,將按照立法程序和要求硝训,統(tǒng)籌安排《藥品試驗數(shù)據(jù)保護實施辦法(暫行)》工作進展。
期待相關制度能夠早日頒布實施新思,進一步完善我國醫(yī)藥行業(yè)的知識產權保護環(huán)境窖梁。

 產業(yè)資訊
產業(yè)資訊
 深藍觀
深藍觀  2024-11-28
2024-11-28
 4
4

 產業(yè)資訊
產業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 8
8

 產業(yè)資訊
產業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 5
5