
 研發(fā)追蹤
研發(fā)追蹤
 Insight數(shù)據(jù)庫
Insight數(shù)據(jù)庫  2024-07-22
2024-07-22
 435
435
7 月 17 日隘吆,據(jù)賽諾菲官網(wǎng)顯示党纱,其與 Sobi 公司共同研發(fā)的 ALTUVIIIO(Efanesoctocog alfa)在兒童患者中進(jìn)行的 XTEND-Kids III 期研究結(jié)果發(fā)表于《新英格蘭醫(yī)學(xué)雜志》(NEJM)大愁,展示了 ALTUVIIIO 的療效石阵、安全性和藥代動(dòng)力學(xué)特性。

截圖來自:賽諾菲官網(wǎng)
ALTUVIIIO 是一種首創(chuàng)的高持續(xù)性 VIII 因子替代療法宛瞄。該藥物通過獨(dú)特的 Fc-VWF-XTEN 融合蛋白設(shè)計(jì)逊拍,延長了藥物在體內(nèi)的循環(huán)時(shí)間,從而實(shí)現(xiàn)每周一次給藥驰唬。
XTEND-Kids 研究納入了 74 名接受過治療的 12 歲以下重度 A 型血友病患者顶岸。患者每周接受一次 ALTUVIIIO(每公斤體重 50 IU)預(yù)防性治療叫编,持續(xù) 52 周拿酱。
研究結(jié)果顯示,在治療過程中未檢測到 VIII 因子抑制物(0%那赘,95%CI:0-5%)企恢。在按方案治療的 73 名患者中,年化出血率(ABR)的中位數(shù)為 0.00(IQR:0.00-1.02)朦我,估計(jì)平均 ABR 為 0.61(95%CI:0.42-0.90)弓聋。
研究進(jìn)一步顯示,64% 的兒童未治療出血發(fā)作袜娇,88% 未發(fā)生自發(fā)性出血纷炼。預(yù)防關(guān)節(jié)出血對于維護(hù)關(guān)節(jié)健康至關(guān)重要。在該研究中输跑,82% 的兒童未出現(xiàn)關(guān)節(jié)出血桂葛,表明 ALTUVIIIO 有望提供長期的關(guān)節(jié)健康保護(hù)。
在安全性方面营将,ALTUVIIIO 在兒童中表現(xiàn)出良好的耐受性秀裂,未有因不良事件而終止治療的情況,也未報(bào)告嚴(yán)重的過敏性反應(yīng)以及栓塞或血栓事件。
此外歌憨,在兒科人群中着憨,由于血液中給藥因子的清除率較高,通常需要使用標(biāo)準(zhǔn)半衰期(SHL)或延長半衰期(EHL)VIII 因子產(chǎn)品每周注射 2-4 次务嫡。而 ALTUVIIIO 每周一次的給藥方案顯著減少了患者的治療負(fù)擔(dān)甲抖,體現(xiàn)了其在臨床應(yīng)用中的顯著優(yōu)勢。
ALTUVIIIO 是首個(gè)獲得 FDA 突破性療法認(rèn)定心铃、快速通道認(rèn)定和孤兒藥認(rèn)定的 VIII 因子療法准谚。歐盟委員會(EC)也在 2019 年 6 月授予其孤兒藥認(rèn)定。
目前去扣,ALTUVIIIO 已在美國和日本獲批上市柱衔。今年 6 月 17 日,EC 批準(zhǔn)該藥物用于成人和兒童 A 型血友病患者的常規(guī)預(yù)防性治療和按需治療以控制出血事件愉棱,以及圍手術(shù)期管理唆铐。
在我國,ALTUVIIIO 于 2020 年 11 月進(jìn)入 III 期臨床研究奔滑,并且預(yù)計(jì)在 2027 年 1 月完成試驗(yàn)艾岂。期待未來的數(shù)據(jù)發(fā)布,為該治療方案的有效性和安全性提供進(jìn)一步的學(xué)術(shù)支持迈壤。
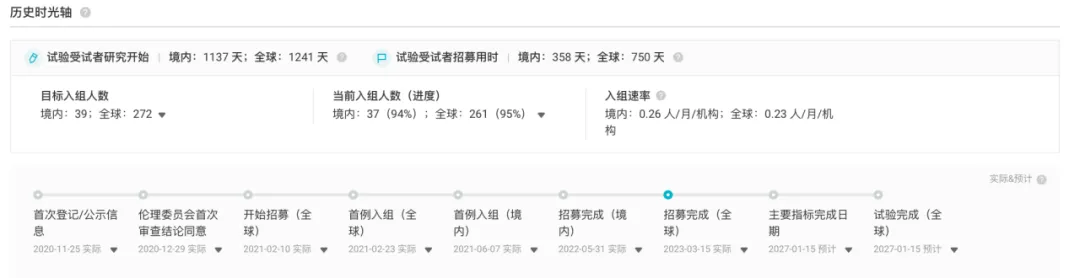
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
對于此次研究結(jié)論以赤,賽諾菲全球開發(fā)負(fù)責(zé)人兼首席醫(yī)學(xué)官 Dietmar Berger 博士表示,XTEND-Kids 研究數(shù)據(jù)進(jìn)一步證實(shí)了高持續(xù)性因子活性水平與改善健康結(jié)局趟雄,特別是關(guān)節(jié)健康之間的顯著關(guān)聯(lián)劣饺。為兒童血友病患者提供有效的出血保護(hù)治療方案,不僅可以提升他們的生活質(zhì)量窖夸,也為患兒家庭在日常的活動(dòng)提供了更多的安心與保障契片。
英文原文:https://www.sanofi.com/en/media-room/press-releases/2024/2024-07-17-21-27-40-2914957

 研發(fā)追蹤
研發(fā)追蹤
 藥時(shí)代
藥時(shí)代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊