
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥時(shí)代
藥時(shí)代  2024-08-09
2024-08-09
 177
177
2024年8月5日田蔑,行業(yè)媒體Fierce Biotech公布了Fierce 15榜單。
該榜單最早發(fā)布于2003年脸学,迄今已經(jīng)公布了三百多家公司,有的公司重復(fù)進(jìn)入名單躬拢,有的年份公布公司的數(shù)量不止15家躲履。
目前,在這三百多家公司里聊闯,有的被并購工猜,有的已經(jīng)上市,還有的已然倒閉菱蔬。
雖然入選的公司命運(yùn)各異域慷,但不可否認(rèn)的是,F(xiàn)ierce 15榜單確實(shí)成功篩選出了Ambrx汗销、AC lmmune犹褒、EQRX等眾多明星Biotech。
對(duì)于許多投資者而言弛针,F(xiàn)ierce 15榜單無疑成為了他們了解最新醫(yī)藥行業(yè)發(fā)展趨勢以及技術(shù)熱點(diǎn)的重點(diǎn)參考方向之一叠骑。
根據(jù)Fierce Biotech披露,該榜單中的每一家入選企業(yè)都是百里挑一削茁,他們不僅需要具備真正的技術(shù)創(chuàng)新宙枷,還要滿足良好的合作伙伴關(guān)系、風(fēng)險(xiǎn)投資方和市場競爭地位等諸多條件茧跋。

所以昏个,對(duì)于初創(chuàng)Biotech而言,入選Fierce 15榜單是一種榮譽(yù)捉肄,更是對(duì)其在技術(shù)創(chuàng)新乃屈、商業(yè)模式以及市場潛力的一種肯定。
這不常苍,今年入選的Biotech們都紛紛在其官網(wǎng)“曬出了”這份榮譽(yù)兼英。
下文,藥時(shí)代將對(duì)今年入選的15家Biotech逐一分析鸵丸,看看他們究竟“猛”在哪里喳牌。
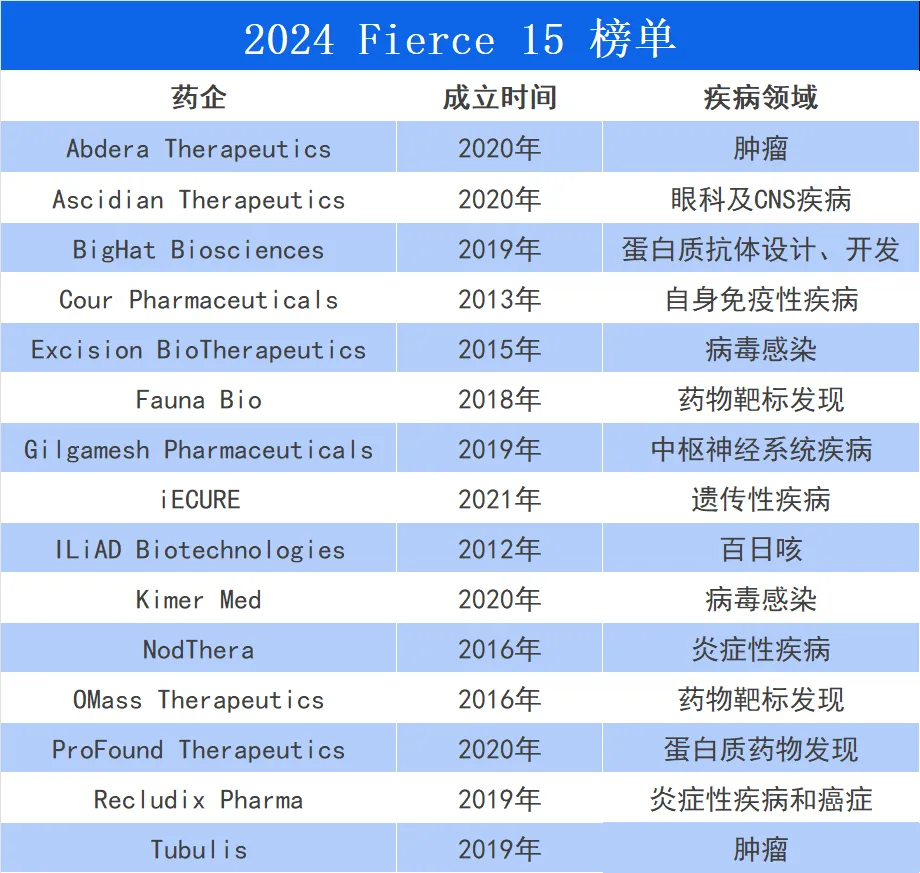
Abdera Therapeutics成立于2020年,公司專注于放射性同位素技術(shù)贪焊,治療領(lǐng)域?yàn)槟[瘤玲院。
Fierce Biotech認(rèn)為,隨著諾華旗下核藥Pluvicto惦肴、Lutathera銷售增長趨勢亮眼淡早,未來核藥賽道潛力巨大,但全球核藥研究靶點(diǎn)相對(duì)集中:SSTR、PSMA巧鸭。
而Abdera的核心技術(shù)平臺(tái)ROVEr?可以篩選出新一代核藥靶點(diǎn)瓶您,而非局限于現(xiàn)有的利用小配體或大蛋白麻捻。
目前纲仍,基于ROVEr?平臺(tái)開發(fā)的ABD-147,是首款靶向DLL3贸毕,放射性同位素為225Ac的新一代核藥郑叠。
今年6月份,F(xiàn)DA批準(zhǔn)了該藥的IND明棍,Abdera計(jì)劃今年下半年啟動(dòng)1期臨床試驗(yàn)乡革。
此外,Abdera擁有不錯(cuò)的帶資入場能力摊腋。2023年沸版,公司在退出隱身模式的同時(shí),宣布已在A輪和B輪融資中籌集了1.42億美元兴蒸。
Ascidian Therapeutics同樣成立于2020年视粮,公司專注于RNA療法,治療領(lǐng)域?yàn)檠劭萍癈NS疾病间歌。
Fierce Biotech認(rèn)為胃磷,該公司的企業(yè)文化不錯(cuò),50人左右的團(tuán)隊(duì)頗具凝聚力鹅址。當(dāng)然裤困,最為核心的還是其開創(chuàng)的RNA外顯子編輯技術(shù)平臺(tái)。
該平臺(tái)結(jié)合了先進(jìn)計(jì)算機(jī)生物學(xué)與高通量分子生物學(xué)篩選妨谦,與現(xiàn)有CRISPR和單堿基編輯技術(shù)相比巡雄,不僅能夠靶向大型基因和高度變異基,還能保持天然的基因表達(dá)模式和水平显而,支持在千堿基規(guī)模上編輯RNA外顯子屠睡。
其意義在于,該基因編輯技術(shù)有望進(jìn)一步降低脫靶風(fēng)險(xiǎn)以及相關(guān)不良反應(yīng)的發(fā)生其摘。
2024年6月受二,該技術(shù)成功吸引到了羅氏,雙方達(dá)成合作均天。Ascidian基于其RNA外顯子編輯平臺(tái)為羅氏篩選CNS領(lǐng)域靶點(diǎn)画鉴。
交易總價(jià)值為18億美元,首付款為4200萬美元恢着。
目前桐愉,該公司進(jìn)展最快的項(xiàng)目是,針對(duì)ABCA4視網(wǎng)膜病變的在研療法ACDN-01,即將進(jìn)入1期臨床試驗(yàn)从诲。
BigHat Biosciences成立于2019年左痢,與前面兩家不同的是,這是家AI公司系洛,即使用人工智能幫助設(shè)計(jì)俊性、開發(fā)蛋白質(zhì)抗體。
自2014年以來描扯,隨著各大藥企爭相進(jìn)入抗PD1/PD-L1抗體免疫治療領(lǐng)域定页,雙抗多抗、ADC等各種新型藥物形式得以涌現(xiàn)绽诚。
眾多疾病治療手段得以實(shí)現(xiàn)實(shí)質(zhì)性飛躍典徊,但對(duì)靶點(diǎn)有效的抗體蛋白質(zhì)結(jié)構(gòu)太過復(fù)雜,設(shè)計(jì)恩够、篩選有效的抗體需要耗費(fèi)大量時(shí)間卒落,最大的難點(diǎn)就是如何確定抗體蛋白質(zhì)序列和結(jié)構(gòu)。
BigHat推出的Milliner?抗體設(shè)計(jì)平臺(tái)檬撒,便是瞄準(zhǔn)了這一痛點(diǎn)顺丸。該平臺(tái)不單集成了人工智能算法,還直接與操作實(shí)驗(yàn)室聯(lián)通南谈,可以在幾天內(nèi)完成過去幾周才能完成的項(xiàng)目骂蒙。
基于此,BigHat相繼與安進(jìn)国谬、默沙東殷缝、艾伯維等多家MNC達(dá)成合作,共同開發(fā)新一代抗體和蛋白療法程堤。
融資方面蝇盖,2021至2022兩年中,BigHat獲AB輪融資共計(jì)9400萬美元谍线,其中投資者包括安進(jìn)與BMS虎资。
Cour Pharmaceuticals成立于2013年,公司專注于其反向疫苗技術(shù)工斤,治療領(lǐng)域?yàn)樽陨砻庖咝约膊 ?/p>
在傳統(tǒng)意義上卷雕,疫苗是通過引入病原體的一部分/弱化/滅活的病原體來刺激免疫系統(tǒng)產(chǎn)生記憶,使得在遇到真正的病原體時(shí)能迅速作出反應(yīng)票从。而“反向疫苗”則是在嘗試移除或減弱免疫系統(tǒng)對(duì)某些抗原的記憶反應(yīng)漫雕。
Cour就是利用納米顆粒,特異性結(jié)合導(dǎo)致免疫系統(tǒng)攻擊自身組織的抗原峰鄙,簡單理解就是:“蒙蔽”免疫系統(tǒng)對(duì)特定抗原的記憶浸间。
目前太雨,該公司擁有7款在研管線,其中進(jìn)度較快的是與武田合作的CNP-101(TAK-101)魁蒜,目前處于乳糜瀉臨床二期試驗(yàn)囊扳。
另一款是與Ironwood Pharmaceuticals合作的藥物CNP-104,目前正在進(jìn)行原發(fā)性膽汁性膽管炎臨床二期試驗(yàn)兜看。
此外锥咸,其治療重癥肌無力的在研療法CNP-106已經(jīng)獲得臨床概念驗(yàn)證,它的2a期臨床試驗(yàn)正在招募患者铣减。
今年年初她君,該公司完成1.05億美元的A輪融資脚作,投資者包括羅氏葫哗、輝瑞、百時(shí)美施貴寶等MNC卓瞻。
Excision BioTherapeutics成立于2015年笤吵,2019年重組,公司致力于CRISPR技術(shù)更扰,治療領(lǐng)域?yàn)椴《靖腥尽?/p>
Excision的亮點(diǎn)之一是具有諾獎(jiǎng)背景叹倒,技術(shù)平臺(tái)來自諾獎(jiǎng)實(shí)驗(yàn)室由加州大學(xué)伯克利分校 Jennifer Doudna實(shí)驗(yàn)室和天普大學(xué)Khalili實(shí)驗(yàn)室授權(quán)。
2019 年装呢,Excision團(tuán)隊(duì)完成了一項(xiàng)重大科學(xué)里程碑甩芦,其技術(shù)將HIV DNA從活體小鼠基因組中去除。
Excision的核心管線EBT-101乌烫,便是基于該科研成功開發(fā)练歇,用于治療HIV。因此忍症,EBT-101也是全球首款基于 CRISPR 的體內(nèi)基因編輯技術(shù)治療 HIV 感染的療法蔑枣。
可惜的是,今年5月稽及,Excision宣布EBT-101在早期研究中失敗仿吞。
在對(duì)五名患者進(jìn)行的第一階段試驗(yàn)結(jié)果表明,EBT-101并不能有效抑制 HIV 病毒捡偏。據(jù)報(bào)道唤冈,有3名患者在停用抗逆轉(zhuǎn)錄病毒療法后很快出現(xiàn)病毒反彈,需要恢復(fù)常規(guī)治療银伟。
不過你虹,除了治療艾滋病毒感染的先導(dǎo)管線 EBT-101,該公司還有EBT-103枣申、EBT-104售葡、EBT-107 三條管線看杭,分別用于治療人類多瘤病毒、單純皰疹病毒挟伙、乙型肝炎病毒感染楼雹。
2021年,Excision通過A輪融資籌集了6000萬美元尖阔。在面對(duì)Fierce Biotech采訪時(shí)贮缅,該公司的CEO表示,將盡快籌集B輪融資疫题。
Fauna Bio成立于2018年焕鲸,雖然與BigHat Biosciences同為AI公司,但研發(fā)思路卻大相徑庭韧似。
Fauna的思路十分清奇落寡。該公司的Convergence? AI平臺(tái)分析從冬眠生物學(xué)的保護(hù)性適應(yīng)(和其他極端適應(yīng))收集的數(shù)據(jù),以確定人類的藥物靶標(biāo)浊笤。
簡單而言痒仆,就是從大自然中找靈感。
先是研究冬眠動(dòng)物(如地松鼠)的冬眠生物學(xué)秋胚,或其他哺乳動(dòng)物在如干旱等其他極端環(huán)境下的基因序列豪服。
然后,運(yùn)用Convergence?將人類患者數(shù)據(jù)和能天然抵抗疾病動(dòng)物的數(shù)據(jù)弊刁,構(gòu)建了的生物醫(yī)學(xué)知識(shí)圖譜吁巫。再加以訓(xùn)練,挑選藥物靶點(diǎn)鞋族。
目前龟夜,F(xiàn)auna Bio總計(jì)收集了數(shù)千個(gè)轉(zhuǎn)錄組、蛋白質(zhì)組和表觀遺傳學(xué)組包竹。
2023年12月燕酷,如此清奇的研究方向被禮來發(fā)現(xiàn),雙方達(dá)成了近5億美元的合作周瞎,即利用Convergence?AI平臺(tái)支持苗缩,針對(duì)肥胖癥的臨床前藥物發(fā)現(xiàn)工作。
在面對(duì)Fierce Biotech采訪時(shí)声诸,F(xiàn)auna的CEO表示酱讶,“在早期阿爾茨海默病中看到的tau變化恰好發(fā)生在一些動(dòng)物身上每幾周一次,但它們每次從冬眠中出來都會(huì)清除它彼乌⌒嚎希”
此外,她列舉了急性腎損傷慰照、纖維化灶挟、心臟病和其他CNS疾病靶點(diǎn)琉朽,均可以通過旗下AI平臺(tái)發(fā)現(xiàn)。
Gilgamesh Pharmaceuticals成立于2019年稚铣,這是一家從哥倫比亞大學(xué)Dalibor Sames神經(jīng)化學(xué)實(shí)驗(yàn)室分拆出來的公司箱叁。
該公司致力于探索一類非致幻的迷幻化合物,用于治療精神疾病秽擦。
基于致幻劑的藥物可以在不引起幻覺的情況下使大腦細(xì)胞重新連接裹依。即利用迷幻劑刺激神經(jīng)元生長出名為樹突樹和樹突側(cè)支(Dendritic tree and branche)的新分支,從而對(duì)大腦產(chǎn)生持久影響资汛。
新分支可與其相鄰神經(jīng)元接觸帐捺,形成相互連接的復(fù)雜腦細(xì)胞網(wǎng)絡(luò)。這種神經(jīng)回路的重新布線有助于改善情緒呼雨、對(duì)抗抑郁并增加整體健康感赫捕。
Gilgamesh的目標(biāo)是開發(fā)具有相似治療效果但沒有致幻副作用的藥物。
目前摘裕,Gilgamesh擁有管線中有兩款處于二期臨床的候選藥物脸鸿。一款5-HT2a受體激動(dòng)劑GM-2505鹅但,用于治療重度及難治性抑郁癥拥耍。
另一款NMDA受體激動(dòng)劑GM-1020,同樣用于治療重度抑郁癥协熙,其優(yōu)勢是可以在家使用审拉。
如今,隨著裸蓋菇素饲窿、氯胺酮和二亞甲基雙氧苯丙胺 (MDMA) 等致幻劑越來越接近獲得監(jiān)管批準(zhǔn)煌寇,神經(jīng)塑性劑領(lǐng)域藥物研發(fā)也逐漸火熱。
今年5月逾雄,Gilgamesh與艾伯維達(dá)成合作阀溶,雙方共同開發(fā)基于致幻劑的新一代精神疾病療法。
Gilgamesh獲得首付款6500萬美元鸦泳,交易總價(jià)高達(dá)20.15億美元银锻。
iECURE成立于2021年,公司專注于基因編輯技術(shù)做鹰,治療領(lǐng)域?yàn)樘囟ǖ倪z傳性疾病击纬。
iECURE的聯(lián)合創(chuàng)始人為基因治療領(lǐng)域的先驅(qū)James Wilson教授,iECURE 從 Wilson 的實(shí)驗(yàn)室授權(quán)獲得了13條管線钾麸。
其中幾條管線是利用基因插入和替換的方式更振,用健康基因替換缺陷基因,在患者體內(nèi)進(jìn)行基因編輯工作饭尝。
這一意味著其療法具備一次性解決數(shù)百個(gè)突變的可能性肯腕。
2023年3月献宫,該公司的核心管線GTP-506,一款利用雙載體AAV遞送的基因療法缆月,被歐盟委員會(huì)授予孤兒藥稱號(hào)缩棉,用于治療鳥氨酸氨甲酰轉(zhuǎn)移酶(OTC)缺乏癥。
此前瑟哺,GTP-506已經(jīng)在該疾病領(lǐng)域獲得過FDA授予的孤兒藥稱號(hào)和兒科罕見疾病資格認(rèn)定颂梆。
iECURE自成立以來,已經(jīng)籌集的資金總額已經(jīng)超過1.15億美元弹梁。該公司CEO在接受Fierce Biotech采訪時(shí)暗示览雁,下一輪融資即將到來。
ILiAD Biotechnologies是本榜單中动院,“年齡”最大的入選企業(yè)胜通。該公司成立于2012年,研發(fā)領(lǐng)域也是相當(dāng)“老套”——百日咳疫苗芽堪。
近年來宅溃,百日咳發(fā)病率在世界各地都在上升,根據(jù) ILiAD 的數(shù)據(jù)苍煎,百日咳每年導(dǎo)致約1600萬人感染甚负,約20萬名兒童死亡。
而傳統(tǒng)的百日咳疫苗审残,無論是全細(xì)胞百日咳疫苗或無細(xì)胞百日咳疫苗均存在免疫持久性不足的問題梭域。
雖然通過優(yōu)化疫苗接種策略(如定期開展加強(qiáng)免疫),對(duì)全人群抵抗百日咳具有一定作用搅轿,但始終避免不了疫苗接種后免疫力迅速減弱的問題病涨。
ILiAD的CEO在接受Fierce Biotech采訪時(shí)說道,“地球上有超過70億人璧坟,但沒有一個(gè)人對(duì)博德特菌(Bordetella pertussis)百日咳得到了適當(dāng)?shù)拿庖呒饶隆!?/p>
目前處于最先進(jìn)開發(fā)階段的新型疫苗的百日咳減毒活疫苗雀鹃,就是ILiAD旗下的BPZE1幻工。只需一次鼻腔給藥,就可引起針對(duì)百日咳桿菌感染的高效保護(hù)性免疫反應(yīng)褐澎。
近日發(fā)表的2b期臨床試驗(yàn)結(jié)果顯示会钝,BPZE1在6-17歲青少年中激發(fā)針對(duì)百日咳桿菌的粘膜分泌型免疫球蛋白A。目前工三,該藥物已經(jīng)在6項(xiàng)臨床試驗(yàn)中獲得積極結(jié)果狞吏。
2022年9月,ILiAD為推進(jìn)BPZE1臨床進(jìn)展舍娜,完成D輪4280萬美元融資仁沃。
Kimer Med成立于2020年岖习,對(duì)于這家公司,筆者認(rèn)為其研發(fā)領(lǐng)域過于“超前”赡析。
該公司打算開發(fā)出一種可針對(duì)幾乎所有病毒的通用靶點(diǎn)创撼。
2011年,當(dāng)Todd Rider博士宣布他的DRACO突破性發(fā)現(xiàn)時(shí)奇搪,全世界都為之矚目曼中。該發(fā)現(xiàn)被白宮稱為“有遠(yuǎn)見的”,并被《時(shí)代》雜志評(píng)為年度最佳發(fā)明之一住龙。
DRACO可以簡單理解成一種具有三種功能的蛋白質(zhì)肯绅。
第一個(gè)功能是正常狀態(tài)下進(jìn)入細(xì)胞壁,第二個(gè)功能是與病毒產(chǎn)生的雙鏈RNA(dsRNA)的長片段結(jié)合监征,第三個(gè)功能是誘導(dǎo)細(xì)胞凋亡芽接。
雖然聽起來還不錯(cuò),但Todd Rider博士并沒有獲得籌款括眠。而Kimer Med成立于新冠疫情最嚴(yán)重的2020年3月彪标。
Kimer Med想從DRACO中獲取新冠治療的靈感,但由于DRACO論文和相關(guān)專利都省略了關(guān)鍵信息掷豺,該公司花了兩年時(shí)間和數(shù)百萬美元才公布Rider的成績并填補(bǔ)空白捞烟。
如今DRACO已改名為VTose。據(jù)Kimer Med披露萌业,已經(jīng)在超過15種人類病毒中觀察到這一治療模式的抗病毒活性坷襟,其中包括目前沒有獲批療法的病毒,比如登革熱病毒和寨卡病毒生年。
目前,該公司正在進(jìn)行A輪融資廓奕,計(jì)劃融資1400萬美元抱婉,用于支持治療登革熱病毒的主打在研療法進(jìn)入人體臨床試驗(yàn)。
值得一提的是桌粉,Kimer Med表示該療法在體外實(shí)驗(yàn)中表現(xiàn)出針對(duì)4種登革熱病毒高達(dá)100%的效力蒸绩。
NodThera成立于2016年,公司專注于NLRP3炎性小體抑制劑的開發(fā)铃肯,治療領(lǐng)域?yàn)楦鞣N炎癥性疾病独溯。
NLRP3炎癥小體是一種經(jīng)過高度驗(yàn)證的抗炎藥物靶點(diǎn),作為先天免疫反應(yīng)的關(guān)鍵調(diào)節(jié)因子宦逃,可以識(shí)別多種病原微生物和應(yīng)激相關(guān)內(nèi)源性信號(hào)分子葬爽,維持機(jī)體內(nèi)環(huán)境穩(wěn)定。
減重和PD作為目前炙手可熱的研發(fā)領(lǐng)域柄哀,NodThera獨(dú)辟蹊徑嘱董,利用老靶點(diǎn)NLRP3做到了“一招鮮听番,吃遍天”。
2024年2月图兑,NodThera在期刊上發(fā)表了NLRP3抑制劑在臨床前研究中表現(xiàn)出減重核看、抗炎療效的研究文章。
2024年3月蔫卦,NodThera又宣布其NLRP3抑制劑NT-0796用于治療帕金森踩颉(PD)患者的1b/2a期試驗(yàn)的積極數(shù)據(jù)。
分析顯示桨座,NT-0796能夠降低患者體內(nèi)血液和腦脊液(CSF)中的關(guān)鍵炎癥和神經(jīng)炎癥生物標(biāo)志物碍蚊。目前,在PD患者中的1a/2b期試驗(yàn)的開展準(zhǔn)備正在進(jìn)行中到旦。
四個(gè)月后(2024年6月)旨巷,NodThera還發(fā)現(xiàn)NT-0796在1a/2b期試驗(yàn)中,還可有效減少患者體內(nèi)C反應(yīng)蛋白(CRP)水平添忘,并造成患者體重顯著減少采呐。
NodThera的CEO在接受采訪時(shí)表示,公司將推進(jìn)另一款候選藥物進(jìn)入臨床搁骑,該藥物主要用于PD斧吐,而NT-0796將專注于心血管代謝疾病。
OMass Therapeutics成立于2016年仲器,由牛津大學(xué)衍生而來煤率。該公司將天然質(zhì)譜技術(shù),用于新藥開發(fā)乏冀。
具體而言蝶糯,OMass的技術(shù)可以觀察天然狀態(tài)下的膜蛋白生物學(xué),在保留非共價(jià)相互作用的基礎(chǔ)上發(fā)現(xiàn)這些蛋白靶點(diǎn)上的天然變構(gòu)結(jié)合位點(diǎn)辆沦,從而篩選先導(dǎo)化合物昼捍。
多年來,新的蛋白質(zhì)靶標(biāo)識(shí)別策略層出不窮丛滋。然而央匀,由于通量低、探針分子合成困難以及藥物分子-蛋白質(zhì)在體內(nèi)的原位信息偏差等諸多問題技窝,往往導(dǎo)致研究進(jìn)展緩慢或失敗试著。
事實(shí)上,幾乎所有的細(xì)胞生物學(xué)過程都會(huì)涉及蛋白質(zhì)和其他生物分子(包括DNA叙冕、RNA橱柒、脂質(zhì)、代謝物等)之間的相互作用。
因此砍毡,充分了解并整合復(fù)雜的細(xì)胞相互作用的信息十旗,將極大促進(jìn)藥物設(shè)計(jì)和疾病診斷等醫(yī)學(xué)技術(shù)的發(fā)展。
OMass的物發(fā)現(xiàn)平臺(tái)OdyssION?聂袱,整合了新型生物化學(xué)技術(shù)溯内、下一代原生質(zhì)譜法和定制化學(xué),以允許在其原生生態(tài)系統(tǒng)中審視蛋白質(zhì)的相互作用欠捶,同時(shí)避免了細(xì)胞的復(fù)雜性闷畸。
OMass在獲得A輪融資的四年后,于2022年再次獲得1億美元的B輪融資吞滞。
本輪融資將用于推進(jìn)公司旗下多個(gè)管線走向臨床試驗(yàn)佑菩,其中包括針對(duì)先天性腎上腺增生、炎癥性腸病和廣泛性炎癥等項(xiàng)目裁赠。
值得一提的事殿漠,在OMass的投資人名單中,還有GV與賽諾菲佩捞。
ProFound Therapeutics成立于2020年绞幌,由著名投資機(jī)構(gòu)Flagship孵化,該公司致力于探索人類細(xì)胞中的“暗物質(zhì)”蛋白質(zhì)一忱。
在人類基因組測序完成之后莲蜘,對(duì)人類基因組序列的研究顯示基因組中大約有2萬個(gè)編碼蛋白的基因。
然而帘营,在編碼序列之外票渠,仍然有大量DNA序列的存在。已有研究顯示芬迄,人類DNA序列中只有大約2%為蛋白編碼序列裙闪,其余大約80%的DNA序列被轉(zhuǎn)錄成RNA。
這些序列的功能仍然未能被完全揭示谷娇,而這類不知功能的蛋白又被稱為“暗物質(zhì)”哆念。
加上人類對(duì)蛋白質(zhì)的理解和利用僅始于幾十年前,對(duì)于未知蛋白仍有巨大開發(fā)空間灼鞋。其中,最顯著的例子之一是發(fā)現(xiàn)了促紅細(xì)胞生成素可以治療貧血凡盔。
如果研究發(fā)現(xiàn)孙悦,人類基因組中的編碼蛋白質(zhì)基因不止2萬個(gè),更多的RNA被翻譯成蛋白質(zhì)幅瑞,那將代表著生物學(xué)的范式轉(zhuǎn)變疤巩,并揭示了一個(gè)全新的治療和靶點(diǎn)的宇宙。
根據(jù)ProFound官網(wǎng)顯示,該公司以及利用其ProFoundry?平臺(tái)發(fā)現(xiàn)了數(shù)以萬計(jì)的新蛋白質(zhì)狮屏,極大擴(kuò)展了潛在的治療靶點(diǎn)數(shù)量结阅。
今年6月,該公司與輝瑞公司達(dá)成研發(fā)協(xié)議瞎嬉,將利用ProFoundry圖譜蝎毡,合作開發(fā)針對(duì)肥胖治療的新靶點(diǎn)。
Recludix Pharma成立于2019年氧枣,該公司圍繞SH2沐兵,致力于發(fā)現(xiàn)靶向SH2結(jié)構(gòu)域蛋白靶標(biāo),治療領(lǐng)域?yàn)槟[瘤與炎癥便监。
SH2結(jié)構(gòu)域?qū)τ谡{(diào)節(jié)蛋白質(zhì)的位置和活性至關(guān)重要扎谎,在細(xì)胞信號(hào)轉(zhuǎn)導(dǎo)中發(fā)揮關(guān)鍵作用。而Recludix則圍繞SH2烧董,聚焦STAT蛋白毁靶。
STAT蛋白位于JAK/STAT通路的下游。因此研究人員認(rèn)為逊移,選擇性STAT抑制劑能產(chǎn)生靶向性更強(qiáng)预吆、副作用更小的藥物。
Recludix的核心管線就是STAT6抑制劑螟左。2023年啡浊,賽諾菲以13.25億美元的交易總價(jià),引進(jìn)了該產(chǎn)品權(quán)益胶背。
目前扳辆,Recludix已經(jīng)篩選到高親和力的先導(dǎo)化合物REX-2787,目前正在進(jìn)一步優(yōu)化爹蒋,先導(dǎo)化合物已經(jīng)可以看到相比于JAK雷镀、TYK2小分子抑制劑的選擇性優(yōu)勢,媲美大分子抗體藥物遵非。
Recludix預(yù)計(jì)STAT6抑制劑2025年可以進(jìn)入一期臨床兆剃,如果項(xiàng)目進(jìn)展順利,該產(chǎn)品有望成為口服版Dupixent华媳。
根據(jù)合作協(xié)定被核,Recludix將把STAT6抑制劑從臨床前研發(fā)推進(jìn)到2期臨床試驗(yàn)開始。此后娇紊,賽諾菲將承擔(dān)全球臨床開發(fā)和商業(yè)化責(zé)任勃提。
Tubulis成立于2019年,公司致力于新一代ADC藥物的開發(fā)触茎,治療領(lǐng)域?yàn)槟[瘤凹尺。
Tubulis創(chuàng)建的目標(biāo)是通過在ADCs開發(fā)的所有方面進(jìn)行創(chuàng)新,解決該領(lǐng)域的主要瓶頸,以最大化ADCs的整體性能吊宋。
為此纲辽,該公司擁有三個(gè)技術(shù)平臺(tái):P5、Tubutecan璃搜、Tub-tag ?
P5平臺(tái)為半胱氨酸選擇性偶聯(lián)拖吼,可實(shí)現(xiàn)DAR為8的均一性,具有絕佳的連接體穩(wěn)定性和化學(xué)柔韌性腺劣,能夠快速識(shí)別先導(dǎo)物绿贞。
Tubutecan平臺(tái)專有的連接子-載荷平臺(tái)提供了優(yōu)化的強(qiáng)效拓?fù)洚悩?gòu)酶I抑制劑的靶向遞送,同時(shí)減少不必要的靶向毒性橘原。
在不影響整個(gè)ADC分子的生物物理特性的情況下籍铁,實(shí)現(xiàn)了穩(wěn)定和高DAR值(DAR8)的有效載荷附著。
Tub-tag ?平臺(tái)的靈感來自微管生物學(xué)趾断,TTL能夠通過將酪氨酸催化連接到α-微管蛋白的C末端拒名,參與微管穩(wěn)態(tài)的調(diào)控。
基于這套技術(shù)平臺(tái)芋酌,Tubulis公開發(fā)了 6 條在研管線增显,4 個(gè)自研項(xiàng)目,2 個(gè)與 BMS 和瑞士生物技術(shù)公司 Oncoteq 的合作項(xiàng)目菜臣。
其中伊丘,進(jìn)展最快的兩條管線是靶向腫瘤抗原Napi2b的TUB-040,以及靶向5T4的TUB-030萄天。
2024年3月异瞭,Tubulis完成1.28 億歐元B2 輪融資,本輪融資的主要目標(biāo)之一就是推進(jìn)這兩條管線的臨床概念驗(yàn)證卦须。
值得一提的是睛宝,加上2022年的6000萬B1輪融,該公司的B輪融資金額達(dá)到了1.88億歐元摊壳。
交易方面酬楚,2023年4月20日,BMS與Tubulis達(dá)成合作協(xié)議粒颂,利用后者的P5偶聯(lián)ADC技術(shù)平臺(tái)谜珠,共同開發(fā)新一代抗腫瘤ADC藥物。
百時(shí)美施貴寶支付2275萬美元預(yù)付款仑萧,超10億美元里程碑金額以及一定比例的銷售分成浸船。作為交換,BMS獲得了使用Tubulis技術(shù)獨(dú)家開發(fā)用于治療實(shí)體瘤的“高度差異化”ADC的權(quán)限寝蹈。
參考資料:
Fierce Biotech
各公司官網(wǎng)
其他公開資料

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識(shí)林
識(shí)林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽