
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-08-12
2024-08-12
 743
743
Citius Pharmaceuticals公司今天宣布捉为,美國FDA已批準(zhǔn)Lymphir(denileukin diftitox)上市轮拼,作為一種新型免疫療法筋悴,治療至少接受過一種全身治療的復(fù)發(fā)/難治性皮膚T細(xì)胞淋巴瘤(r/r CTCL)患者诲操。新聞稿指出犬岔,Lymphir是自2018年以來喇嘱,F(xiàn)DA批準(zhǔn)的首款治療r/r CTCL的創(chuàng)新全身性靶向療法信夫。它也是首款靶向惡性T細(xì)胞和調(diào)節(jié)性T細(xì)胞(Tregs)上的白細(xì)胞介素-2(IL-2)受體的CTCL療法。
Lymphir的批準(zhǔn)是基于關(guān)鍵性3期試驗302的結(jié)果,該研究包含至少接受過一種全身治療的CTCL患者她君。實際招募的患者接受前期全身性抗癌治療的治療線數(shù)中位數(shù)為4脚作。主要療效人群包括69名I-III期CTCL患者,這些患者接受了Lymphir(9 μg/kg/天)治療狈合。主要療效終點是由獨立審查委員會(IRC)評估的客觀緩解率(ORR)卓瞻。
試驗數(shù)據(jù)顯示,Lymphir的ORR為36.2%(95% CI:25.0-48.7)捏描,其中8.7%的患者達到了完全緩解(CR)更扰,疾病控制率達到49%。患者對療法迅速產(chǎn)生應(yīng)答肘蜘,大多數(shù)應(yīng)答者(約70%)在1-2個治療周期后看到效果装呢。獲得緩解的患者中52.0%的緩解持續(xù)時間至少為6個月。84.4%(54/64)的皮膚可評估受試者的皮膚腫瘤負(fù)擔(dān)減少讽空,12.5%(8/64)患者的皮膚病變完全清除猩禀。
安全性方面,在三項共119名接受9 μg劑量Lymphir的CTCL患者的研究中洒屡,最常見的(≥20%)不良反應(yīng)分別是轉(zhuǎn)氨酶升高,白蛋白減少等跳,惡心查奉,水腫,血紅蛋白減少萌狂,疲勞档玻,肌肉骨骼疼痛,皮疹茫藏,寒戰(zhàn)误趴,便秘,發(fā)熱和毛細(xì)血管滲漏綜合征(CLS)务傲。
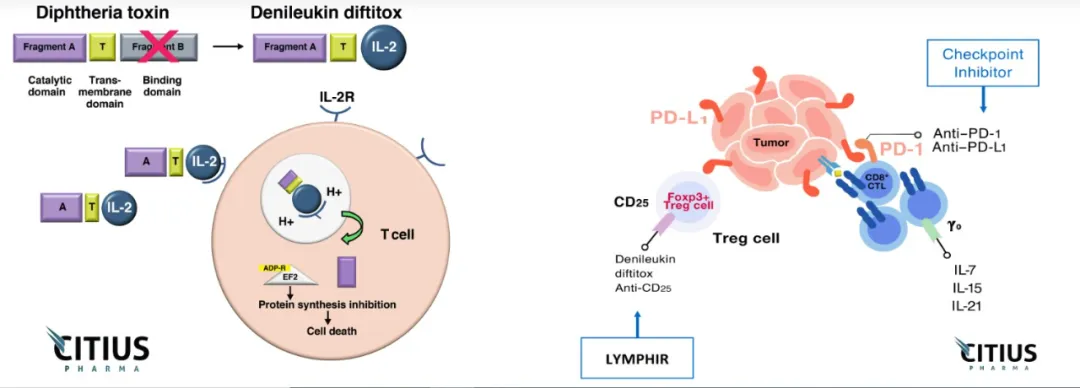
▲Lymphir的作用機制(圖片來源:Citius Pharmaceuticals官網(wǎng))
Lymphir是一款由IL-2和白喉毒素(diphtheria toxin)組合在一起的重組融合蛋白凉当,它與細(xì)胞表面的IL-2受體相結(jié)合,導(dǎo)致白喉毒素片段進入細(xì)胞抑制蛋白合成售葡。這一獨特的作用機制讓它可以同時靶向惡性T細(xì)胞和具有免疫抑制作用的調(diào)節(jié)性T細(xì)胞(Tregs)看杭。暫時消滅Tregs具有增強患者免疫系統(tǒng)抗癌免疫反應(yīng)的潛力。
在臨床前研究中挟伙,Lymphir能夠在小鼠腫瘤模型中清除Tregs楼雹,而且與抗PD-1抗體聯(lián)用,在實體瘤模型中顯著提高動物的生存時間尖阔。這款療法最初由衛(wèi)材(Eisai)公司開發(fā)贮缅,并在2021年在日本獲批上市。Citius公司擁有在日本和部分亞洲國家和地區(qū)以外全球其他地區(qū)開發(fā)和商業(yè)化Lymphir的權(quán)益。
目前焕鲸,Lymphir還在兩項研究者啟動的研究中接受檢驗忿韧,分別為與PD-1抑制劑Keytruda聯(lián)用,治療實體瘤患者盘贤,以及在復(fù)發(fā)/難治性B細(xì)胞血液癌癥患者接受淋巴細(xì)胞清除化療和CAR-T療法之前使用鱼练,增強對Tregs的清除。這些研究的結(jié)果可能進一步擴展Lymphir的應(yīng)用范圍蚣枝。
CTCL是一種罕見且常使人衰弱的慢性非霍奇金淋巴瘤响攘,主要影響皮膚。復(fù)發(fā)/難治性CTCL患者的治療選擇有限歼呼,此前沒有統(tǒng)一的單一治療方法可以用于治療這些無法治愈的癌癥患者千有。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 106
106

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 110
110

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 124
124