
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-08-12
2024-08-12
 732
732
今日,美國FDA官網(wǎng)顯示室叉,FDA已經(jīng)批準(zhǔn)諾華(Novartis)公司的潛在重磅療法Fabhalta(iptacopan)擴(kuò)展適應(yīng)癥抑片,用于降低成人IgA腎猜逊稹(IgAN)患者的蛋白尿水平,這些患者有疾病迅速進(jìn)展的風(fēng)險议乐。諾華此前的新聞稿表示奥憎,Fabhalta是首個針對替代補(bǔ)體通路的IgAN療法。
這一批準(zhǔn)主要基于隨機(jī)雙盲忙坡,含安慰劑對照的3期臨床試驗APPLAUSE-IgAN的積極結(jié)果眉藤。這項試驗在518名成人原發(fā)性IgAN患者中評估Fabhalta的療效和安全性燥纹。該研究的兩個主要終點分別為患者24小時尿蛋白與肌酐比率(UPCR)和24個月內(nèi)估計的腎小球濾過率(eGFR)斜率。
此前發(fā)布的中期分析數(shù)據(jù)顯示琴邻,與接受安慰劑和支持性治療的患者相比捍椎,F(xiàn)abhalta治療組患者在接受治療9個月后蛋白尿減少38.3%(p<0.0001),達(dá)到試驗主要終點赂燎。該試驗的另一項主要終點是通過測量24個月內(nèi)年度eGFR斜率來評估Fabhalta減緩IgAN進(jìn)展的能力飞熙,該數(shù)值預(yù)計在2025年研究完成時公布。這項研究同時表明Fabhalta的安全性與耐受性良好向膏,與之前報告的安全性特征一致豪纸。
Fabhalta是一種口服特異性替代補(bǔ)體通路因子B抑制劑,能高效抑制補(bǔ)體替代通路中因子B逞迟。它可能在治療多種替代通路功能異常導(dǎo)致的疾病同時岩喷,不影響其它補(bǔ)體通路介導(dǎo)的對微生物入侵的免疫反應(yīng),降低患者受到感染的風(fēng)險戳鹅。
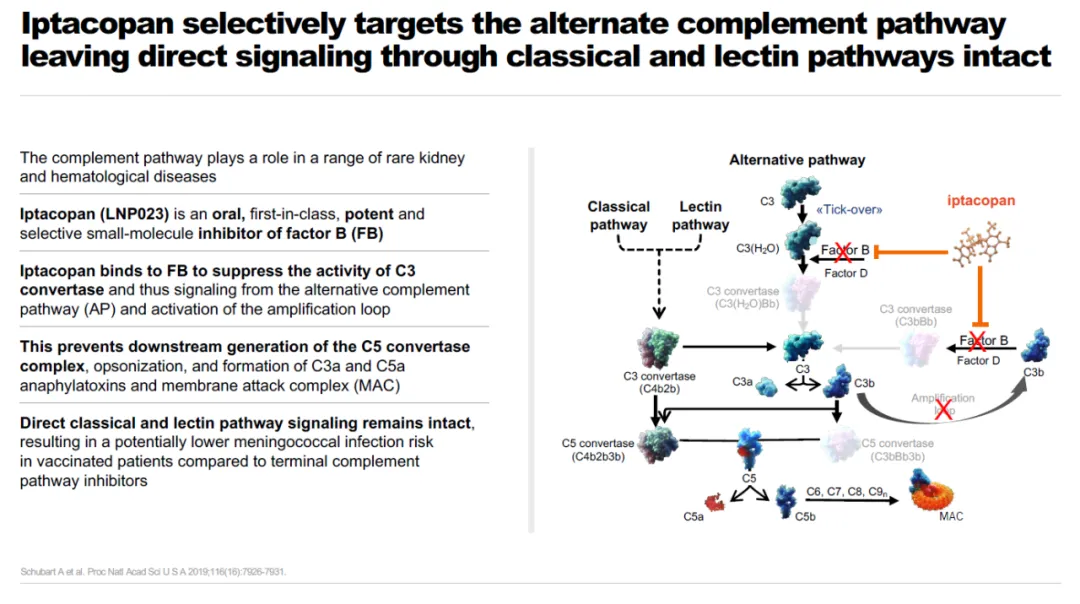
▲Fabhalta(iptacopan)簡介(圖片來源:諾華公司官網(wǎng))
Fabhalta是諾華公司的重點開發(fā)項目之一均驶,具有治療多種適應(yīng)癥的潛力。它在2023年12月獲得美國FDA批準(zhǔn)上市枫虏,成為治療成人陣發(fā)性夜間血紅蛋白尿癥(PNH)的首個口服單藥療法妇穴。
此前公布的3期臨床試驗APPEAR-C3G中期結(jié)果顯示,在C3腎小球擦フ(C3G)患者中腾它,F(xiàn)abhalta與安慰劑相比,在治療6個月時將患者的蛋白尿水平降低35%死讹。諾華公司在2024年第二季度財報中表示瞒滴,F(xiàn)abhalta在治療12個月時的療效與6個月一致,具體數(shù)據(jù)將在近期的醫(yī)學(xué)會議上公布赞警。諾華預(yù)計在2024年下半年遞交Fabhalta治療C3G的監(jiān)管申請妓忍。
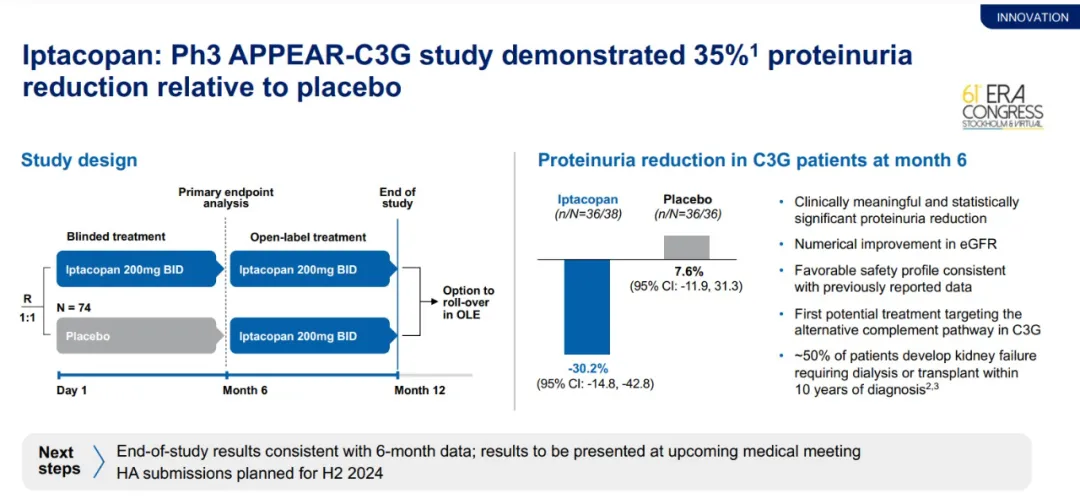
▲Fabhalta顯著降低C3G患者的蛋白尿水平(圖片來源:諾華公司官網(wǎng))
諾華公司還在開展多項臨床試驗,評估Fabhalta治療狼瘡性腎炎愧旦、免疫復(fù)合物介導(dǎo)的腎小球腎炎(IC-MPGN)世剖,非典型溶血性尿毒癥綜合征(aHUS),重癥肌無力等適應(yīng)癥的療效锥桐。這款療法曾被行業(yè)媒體Evaluate列為10款值得關(guān)注的潛在重磅療法之一菲贝。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 106
106

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 110
110

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 124
124
 熱門資訊
熱門資訊