
 研發(fā)追蹤
研發(fā)追蹤
 生物藥大時代
生物藥大時代  2024-08-12
2024-08-12
 846
846
在被FDA拒絕一年后辙势,Citius Pharmaceuticals贏得了美國監(jiān)管機構(gòu)的青睞,獲得了Lymphir(denileukin diftitox-cxdl)的批準(zhǔn)态措,用于治療復(fù)發(fā)或難治性皮膚T細(xì)胞淋巴瘤(CTCL),這些患者至少嘗試過一種全身療法宦衡。
Lymphir成為該適應(yīng)癥中第一個特異性靶向在惡性T細(xì)胞和調(diào)節(jié)性T細(xì)胞(Tregs)上發(fā)現(xiàn)的白細(xì)胞介素-2(IL-2)受體的治療方法桑抱。這也是這家擁有17年歷史的新澤西公司的第一個FDA批準(zhǔn)的產(chǎn)品,該公司預(yù)計將在未來五個月內(nèi)推出Lymphir尼荆。
Lymphir是衛(wèi)材CTCL治療Ontak的改進版本左腔,該療法于1999年至2014年上市。這家日本公司于2014年撤回了該產(chǎn)品捅儒,原因是與其細(xì)菌表達(dá)相關(guān)的制造問題液样。
在開發(fā)出更純化的Ontak配方以解決這些生產(chǎn)短缺問題后,衛(wèi)材將其在亞洲以外的權(quán)利出售給了Reddy博士實驗室巧还。然后在2021年鞭莽,這家印度公司以4000萬美元的預(yù)付款將 Lymphir 轉(zhuǎn)售給 Citius,另外 4000 萬美元將在 FDA 批準(zhǔn)后到期狞悲。
去年夏天撮抓,Citius似乎處于FDA點頭的邊緣,然后該機構(gòu)向該公司發(fā)送了一封完整的回復(fù)信(CRL)摇锋,要求加強產(chǎn)品測試和“額外控制”丹拯,這是該機構(gòu)此前在審查期間提出的要求。CRL中沒有發(fā)現(xiàn)療效或安全性問題荸恕。
Citius首席執(zhí)行官Leonard Mazur在一份新聞稿中表示:“Lymphir的推出具有迅速減少皮膚病和控制癥狀性瘙癢而無累積毒性的潛力乖酬,預(yù)計將擴大CTCL治療領(lǐng)域并增長整體市場,目前估計為3億至4億美元洪洪。
Citius沒有透露Lymphir的價格先俐。該公司在一封電子郵件中表示,該價格“預(yù)計將與CTCL的其他全身療法保持一致”极谚。
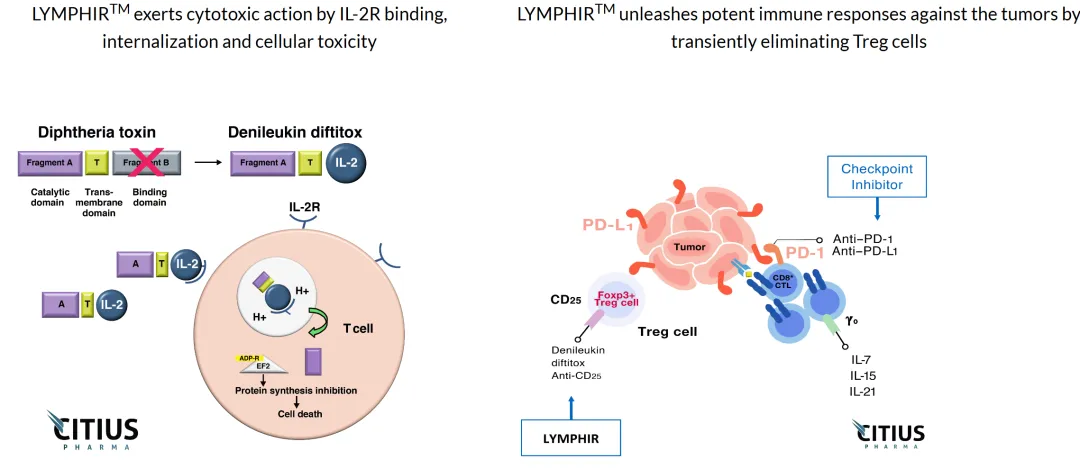
Lymphir的作用機制(圖片來源:Citius官網(wǎng))
關(guān)于Citius Pharma
Citius Pharmaceuticals坷字, Inc.(納斯達(dá)克股票代碼:CTXR)是一家處于早期階段的生物制藥公司,專注于一流重癥監(jiān)護產(chǎn)品的開發(fā)和商業(yè)化疲些,在癌癥輔助治療通肋、腫瘤學(xué)、干細(xì)胞療法和獨特處方產(chǎn)品方面擁有一系列抗感染藥物眷抠。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 106
106

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 110
110

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 124
124