
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥明康德
藥明康德  2024-08-16
2024-08-16
 83
83
吉利德科學(xué)(Gilead Sciences)今天宣布谭确,美國FDA已加速批準Livdelzi(seladelpar)與熊去氧膽酸(UDCA)聯(lián)合用于治療對UDCA應(yīng)答不足的原發(fā)性膽汁性肝硬化(PBC)成人患者将盾,或作為單藥治療對UDCA不耐受的患者赚导,但不建議患有或發(fā)展為失代償性肝硬化的患者使用Livdelzi冗宠。根據(jù)新聞稿录语,Livdelzi是在堿性磷酸酶(ALP)正郴昶化、關(guān)鍵生物標志物和瘙癢控制方面耸三,與安慰劑相比表現(xiàn)出統(tǒng)計學(xué)顯著改善的首個療法乱陡。目前英國藥品和健康產(chǎn)品管理局(MHRA)和歐洲藥品管理局(EMA)正在評估Livdelzi的上市申請。
原發(fā)性膽汁性膽管炎是一種有潛在生命危險的肝臟自身免疫性疾病仪壮。由于免疫系統(tǒng)持續(xù)攻擊膽管憨颠,膽汁流動受阻而淤積,毒性膽汁酸在肝內(nèi)留存积锅,可發(fā)展為肝纖維化爽彤、肝硬化和肝功能衰竭。其他臨床癥狀還包括疲勞和瘙癢缚陷。在40歲以上的女性中适篙,有千分之一患有PBC。
這次的加速批準主要基于關(guān)鍵安慰劑對照3期RESPONSE研究的數(shù)據(jù)牲耐。在該研究中师莫,62%接受每日一次口服Livdelzi的受試者在第12個月達到了綜合生化應(yīng)答的主要終點桂喂,而此數(shù)值在安慰劑組中只有20%琐惩。使用Livdelzi治療后,25%的患者在第12個月時ALP值恢復(fù)正常成揍,而安慰劑組中的患者均未出現(xiàn)這種變化目溶。ALP是一種膽汁淤積標志物,可預(yù)測肝移植和死亡的風(fēng)險冻款。
第6個月時瘙癢評分相對于基線的變化是試驗的關(guān)鍵次要終點咕隶。與安慰劑組相比,Livdelzi組患者的瘙癢癥狀顯著減少筝赶。根據(jù)新聞稿倚辟,Livdelzi是在3期試驗中,證明能夠顯著、持久改善瘙癢和膽汁淤積標志物的首個藥物早假,這些標志物與疾病進展風(fēng)險相關(guān)蠢挡。
最常見的不良事件(≥5% Livdelzi組患者報告,且高于安慰劑組)是頭痛凳忙、腹痛业踏、惡心、腹脹和頭暈涧卵,沒有觀察到與治療相關(guān)的嚴重不良事件(SAE)勤家。
目前為止,Livdelzi已在RESPONSE以及其他試驗(包括長期開放標簽ASSURE研究和之前的早期研究)中超過500名PBC患者中受檢視柳恐。進行中的研究包括驗證性3期AFFIRM研究伐脖,這是一項隨機、安慰劑對照的驗證性研究胎撤,旨在評估Livdelzi對因PBC導(dǎo)致的代償性肝硬化患者的臨床結(jié)果的影響晓殊。
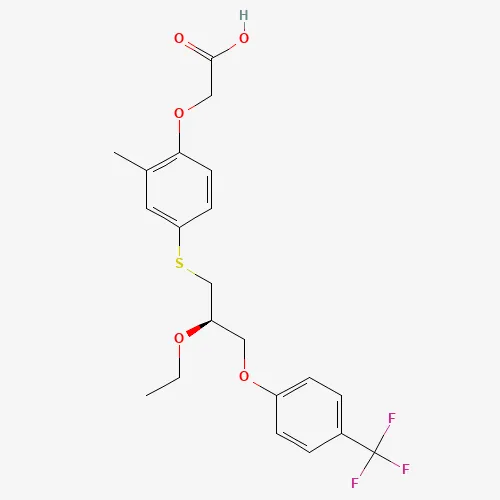
▲Seladelpar分子式(圖片來源:PubChem)
Livdelzi為一款口服的強效選擇性過氧化物酶體增殖物活化受體δ(PPAR δ)激動劑。PPARδ表達在肝臟的多種細胞類型中伤提,臨床前數(shù)據(jù)表明巫俺,它對調(diào)控膽汁酸合成、炎癥肿男、纖維化過程的多種基因有調(diào)節(jié)作用柿癞。該藥物曾于2019年2月獲得美國FDA授予突破性療法認定,用以治療PBC皂州。該療法原由CymaBay公司所研發(fā)哩讶,吉利德科學(xué)在2024年2月與該公司達成總金額達43億美元的收購協(xié)議,進而囊獲此款療法劈产。
今年6月美國FDA加速批準益普生(Ipsen)的Iqirvo(elafibranor)80毫克片劑與UDCA聯(lián)合用于治療對UDCA應(yīng)答不足的成人PBC患者誊配,或作為單藥療法治療對UDCA不耐受的患者。Iqirvo是一種每日一次卡涮、口服请状、“first-in-class"的PPAR α/δ激動劑,同時靶向活化PPAR α/δ可潛在治療PBC的炎癥皱耗、膽汁淤積和纖維化铝儒。根據(jù)新聞稿,Iqirvo是近十年來首個獲批用于治療罕見肝病原發(fā)性膽汁性膽管炎的新藥极棵。
除了Livdelzi與Iqirvo抬邑,目前開發(fā)用以治療PBC的療法還有由GSK開發(fā)、目前處于3期階段的回腸膽汁酸轉(zhuǎn)運體(IBAT)口服小分子抑制劑linerixibat嗤详,其3期試驗已募集238位患者个扰,預(yù)計今年10月會有初步結(jié)果瓷炮。而由Calliditas Therapeutics開發(fā)的NOX1/4抑制劑setanaxib也在近期完成臨床2期試驗,預(yù)計在今年下半年公布完整試驗結(jié)果递宅。該療法曾獲EMA與美國FDA授予孤兒藥資格崭别,并獲FDA授予快速通道資格,用以治療PBC恐锣。Mirum Pharmaceuticals也正在開發(fā)選擇性ASBT小分子抑制劑volixibat用于PBC治療茅主,目前該療法的2期試驗正在進行患者招募,預(yù)計在明年12月會有初步結(jié)果土榴。同樣地诀姚,凱思凱迪(Cascade Pharmaceuticals)開發(fā)的FXR靶向激動劑linafexor(CS0159)的2期試驗也正在招募患者,初步結(jié)果預(yù)計在今年10月公布玷禽。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8