
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 火石創(chuàng)造
火石創(chuàng)造  2024-08-16
2024-08-16
 86
86
引言
2024年7月撵彻,全球批準(zhǔn)多款新藥上市膝舅。FDA批準(zhǔn)12款新藥(NDA/BLA),其中包括1款新獲批的新分子實體藥物(NDA:Type 1 - New Molecular Entity),2款生物制品藥物(BLA)。NMPA本月暫無批準(zhǔn)的創(chuàng)新藥上市。
美國FDA批準(zhǔn)情況
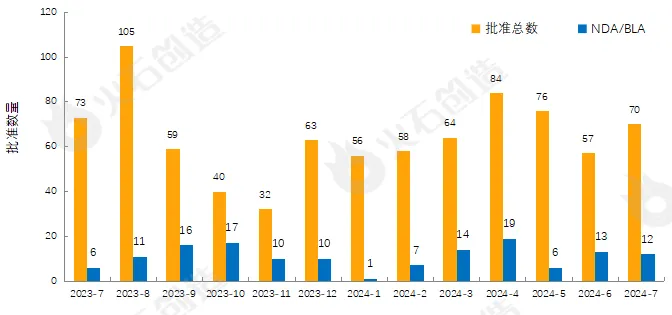
圖1 2023年7月—2024年7月FDA藥物批準(zhǔn)數(shù)量變化情況 來源:火石創(chuàng)造產(chǎn)業(yè)數(shù)據(jù)中心
如圖1,截至2024年8月13日FDA官網(wǎng)披露,2024年7月FDA共完成70項藥品首次批準(zhǔn)(不包含暫時批準(zhǔn))蝌秕,其中NDA/BLA批準(zhǔn)12款(不包含暫時批準(zhǔn)),見表1残膜。其中包括1款新獲批的新分子實體藥物(NDA:Type 1 - New Molecular Entity)镐赖,2款生物制品藥物(BLA)。
2024年7月商爆,F(xiàn)DA批準(zhǔn)了太陽藥業(yè)的藥物Leqselvi(deuruxolitinib)上市从巾,用于治療成人重度斑禿。這也是FDA批準(zhǔn)的第三種用于治療斑禿的JAK抑制劑爬姓。資料顯示趣临,Leqselvi是一款口服JAK1/JAK2抑制劑,可以破壞導(dǎo)致毛囊自體免疫攻擊的信號轉(zhuǎn)導(dǎo)慢沉,從而阻止毛囊被破壞幸膨,促進(jìn)毛發(fā)再生。Leqselvi原研公司為Concert Pharmaceuticals备洽,2023年初太陽藥業(yè)以5.76億美元收購了Concert慷甩,將該藥收入囊中。
Epysqli(eculizumab-aagh)的生物制品許可申請獲FDA批準(zhǔn)了嚎,作為Soliris(eculizumab泪漂,依庫珠單抗)的生物仿制藥。這是FDA批準(zhǔn)的第二個Soliris生物仿制藥歪泳。Epysqli是一種補(bǔ)體抑制劑萝勤,被批準(zhǔn)用于治療陣發(fā)性睡眠性血紅蛋白尿(PNH)患者以減少溶血,以及用于治療非典型溶血性尿毒癥綜合征(aHUS)患者以抑制補(bǔ)體介導(dǎo)的血栓性微血管病夹囚。在美國以外纵刘,Epysqli于2023年5月獲得歐盟委員會批準(zhǔn)邀窃,成為歐洲首個依庫珠單抗生物仿制藥荸哟。
禮來(Eli Lilly and Company)的Kisunla(donanemab),用于治療出現(xiàn)早期癥狀的阿爾茨海默菜膊丁(AD)的成年人鞍历。這些患者包括有輕度認(rèn)知障礙(MCI)患者以及處于輕度癡呆階段的AD患者,患者確認(rèn)存在淀粉樣蛋白病理。每月一次的Kisunla是首個有證據(jù)表明在淀粉樣斑塊清除后可停止治療的淀粉樣斑塊靶向療法劣砍,因此預(yù)計該療法可以降低治療成本并減少輸液次數(shù)惧蛹。表1 7月FDA批準(zhǔn)NDA/BLA藥物
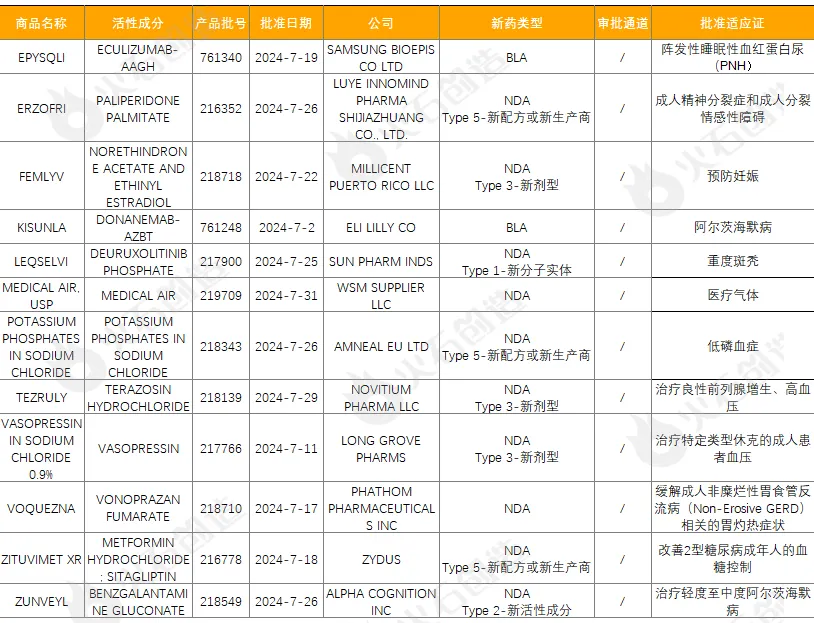
來源:火石創(chuàng)造產(chǎn)業(yè)數(shù)據(jù)中心
NMPA批準(zhǔn)情況
截至2024年8月13日NMPA披露,2024年7月共批準(zhǔn)國產(chǎn)首次注冊藥品255件就肪。按劑型去重后弥败,共159個藥品品種(不同廠家生產(chǎn)同一藥物按同一品種計算)。本月暫無1類創(chuàng)新藥獲批赊设。
仿制藥一致性評價情況
截至2024年8月13日CDE官網(wǎng)披露渣先,CDE共承辦藥品一致性評價受理號5864個,2024年7月共新增承辦68個受理號未奋。截至2024年8月13日赫淋,共8967個品規(guī)上市藥品通過一致性評價(包含視同通過4903個品規(guī)),本月共53個品規(guī)的藥品通過一致性評價(包含視同通過53個品規(guī))冻绊,按劑型去重后期庆,共37個藥品品種。
目前一致性評價品種通過的注射劑共3789個品規(guī)(387個品種)瓷忙,本月過評藥品中共計27個品規(guī)(20個品種)的注射劑耐陵。2023年7月至2024年7月通過一致性評價數(shù)量見圖2。
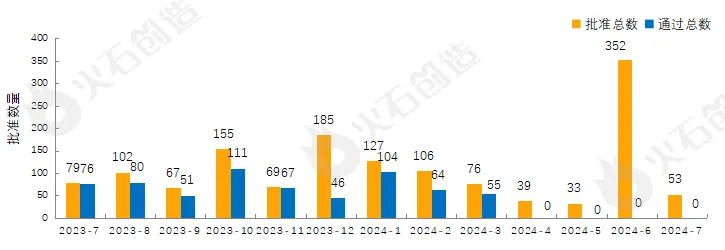
圖2 2023年7月—2024年7月仿制藥一致性評價批準(zhǔn)數(shù)量變化情況 來源:火石創(chuàng)造產(chǎn)業(yè)數(shù)據(jù)中心

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8
 熱門資訊
熱門資訊