
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-08-16
2024-08-16
 148
148
近日茉兰,深圳零一生命科技(以下簡(jiǎn)稱“零一生命”)临颈,一家專注于人體微生態(tài)資源開發(fā)和應(yīng)用的技術(shù)平臺(tái)型公司螺垢,官宣其用于治療特應(yīng)性皮炎(Atopic Dermatitis, AD)的新藥AD101的臨床試驗(yàn)申請(qǐng)(IND)已獲得美國(guó)食品藥品監(jiān)督管理局(FDA)批準(zhǔn),即將啟動(dòng)Ⅰ期臨床試驗(yàn)摇天。
AD101是由零一生命自主研發(fā)的的一款全球First-in-Class小分子原創(chuàng)新藥线盔,是零一生命原創(chuàng)新藥業(yè)務(wù)的核心產(chǎn)品之一专稼,其IND獲批是零一生命皮膚微生態(tài)新藥研發(fā)的一個(gè)重要里程碑拄抄。該藥物主要作用于臨床證實(shí)的炎癥性皮膚病治療靶點(diǎn)——芳香烴受體(AhR)除搞,可高效調(diào)節(jié)Th2及Th1型免疫應(yīng)答,并促進(jìn)皮膚屏障功能蛋白如FLG的表達(dá)徽探,同時(shí)其還作用于組胺H1受體(傳統(tǒng)過敏癥靶點(diǎn))等其他潛在靶點(diǎn)治东。
AD101在臨床前研究中表現(xiàn)出強(qiáng)效治療AD的活性,藥效優(yōu)于其他多種已上市外用藥物封豆。由于AD101來源于人體皮膚共生菌群的代謝產(chǎn)物缔禾,因此具有優(yōu)異的安全性以及與良好的皮膚相容性,臨床前研究數(shù)據(jù)顯示其系統(tǒng)暴露和局部刺激/過敏風(fēng)險(xiǎn)均極低恢憋,有成為嬰幼兒用藥的潛力像样。作為一個(gè)非激素類、安全有效的局部外用創(chuàng)新藥坡牛,AD101不僅對(duì)輕中度AD具有單獨(dú)成藥的潛力掸绞,還具有與系統(tǒng)性治療方法如生物制劑等聯(lián)合用于中重度AD治療的可能泵三,有望在提升療效及應(yīng)答率的同時(shí)不增加毒副作用耕捞,具有廣闊的臨床開發(fā)前景。
零一生命皮膚微生態(tài)研究歷程
零一生命創(chuàng)始團(tuán)隊(duì)高度重視基礎(chǔ)科學(xué)研究和臨床應(yīng)用相結(jié)合烫幕,在2016年創(chuàng)業(yè)之前俺抽,創(chuàng)始團(tuán)隊(duì)已在腸道菌群領(lǐng)域積累了豐富的研究經(jīng)驗(yàn),并在包括CNS及其主要子刊在內(nèi)的高水平國(guó)際雜志上發(fā)表過多篇研究論文较曼。
基于前期的經(jīng)驗(yàn)磷斧,創(chuàng)始團(tuán)隊(duì)預(yù)測(cè)皮膚菌群方面的轉(zhuǎn)化和應(yīng)用可以更快產(chǎn)生突破。因此在2016年創(chuàng)辦零一生命后捷犹,團(tuán)隊(duì)便與皮膚研究領(lǐng)域弛饭,尤其是炎癥性皮膚病研究方面居于國(guó)內(nèi)外領(lǐng)先水平的兩家機(jī)構(gòu)——復(fù)旦大學(xué)附屬華山醫(yī)院和中國(guó)醫(yī)學(xué)科學(xué)院皮膚病研究所——聯(lián)合啟動(dòng)了一系列皮膚微生態(tài)創(chuàng)新性研究項(xiàng)目。
過去八年間萍歉,三方通過持續(xù)的良性合作侣颂,在皮膚微生態(tài)領(lǐng)域共發(fā)表了12 篇高質(zhì)量學(xué)術(shù)論文,總影響因子達(dá)到135.8枪孩,包括Immunity憔晒、Cell Host & Microbe 、Allergy硝迁、Cell Reports Medicine等高降。這些產(chǎn)學(xué)研聯(lián)動(dòng)項(xiàng)目不但深度擴(kuò)展了特應(yīng)性皮炎AD研究的理論基礎(chǔ),還產(chǎn)生了數(shù)個(gè)針對(duì)AD以及瘙癢、痤瘡等炎癥性皮膚疾病的潛在First-in-Class候選創(chuàng)新藥物殷淮,其中代表性研究成果包括:
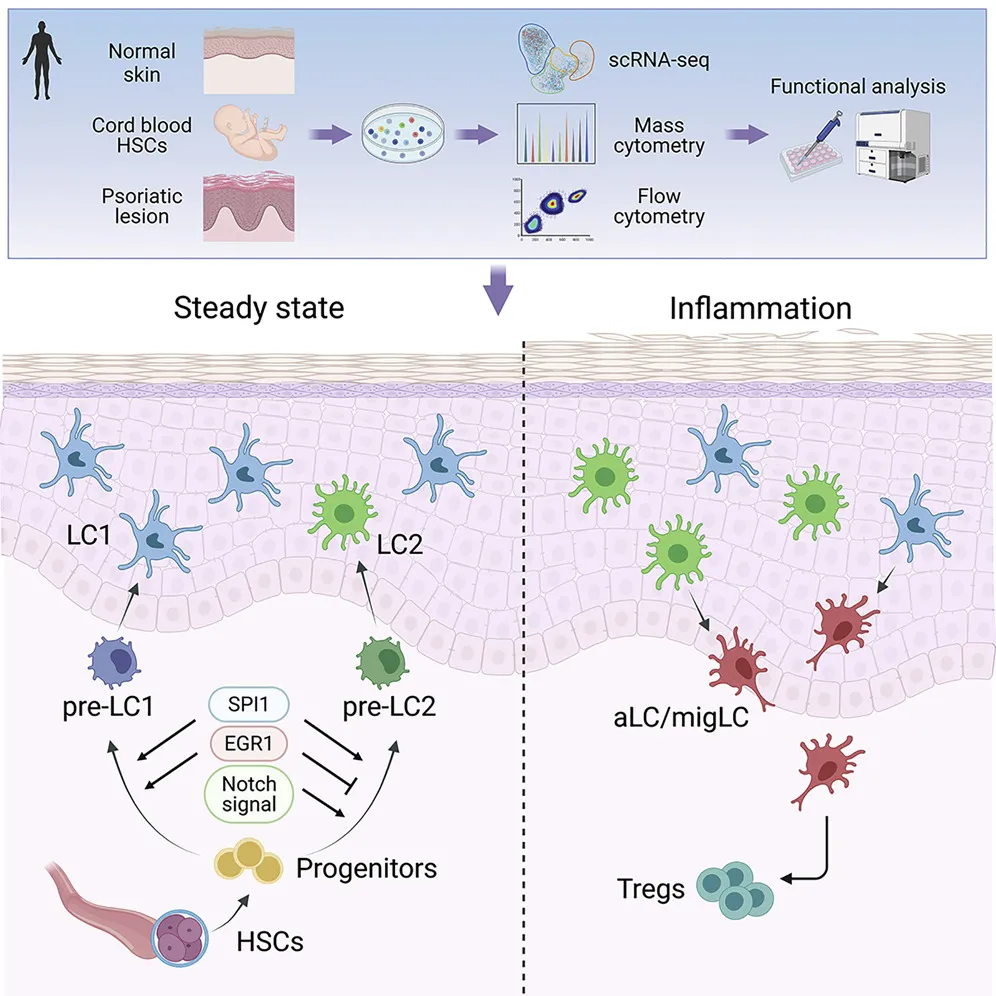
1沧牧、2019年2月發(fā)表于Journal of Investigative Dermatology 的研究,系統(tǒng)性地揭示了AD患者皮膚两靖、腸道和口腔菌群的特點(diǎn)1莲轮。該項(xiàng)目不僅利用生物信息學(xué)和機(jī)器學(xué)習(xí)等方式揭示了AD患者皮損的關(guān)鍵細(xì)菌物種,還鑒定出了其中一個(gè)關(guān)鍵微生物代謝功能改變?cè)贏D中的作用缤贯。結(jié)合靶向代謝組學(xué)研究既帜,團(tuán)隊(duì)找到了其中最為關(guān)鍵的小分子物質(zhì)AD101(原型分子),并利用基因敲除瑰柄、RNA干擾等技術(shù)揭示了它在角質(zhì)形成細(xì)胞上的作用靶點(diǎn)2制私,以及通過動(dòng)物模型驗(yàn)證了其拮抗AD炎癥應(yīng)答的作用。2020年12月蚣碰,研究團(tuán)隊(duì)發(fā)表進(jìn)一步的研究揖膜,發(fā)現(xiàn)這一分子可通過朗格漢斯細(xì)胞(LC)調(diào)控皮膚炎癥,從而在維持皮膚穩(wěn)態(tài)中發(fā)揮重要的作用3梅桩。
2壹粟、2021年10月,通過單細(xì)胞轉(zhuǎn)錄組測(cè)序等技術(shù)宿百,團(tuán)隊(duì)全面系統(tǒng)地描繪了人類朗格漢斯細(xì)胞(LC)在表型和功能上的異質(zhì)性趁仙,揭示了LC的分化軌跡以及關(guān)鍵調(diào)控分子,闡明了不同LC亞群在靜息和疾病狀態(tài)下的功能差異4垦页。鑒于LC介導(dǎo)了菌群與宿主免疫系統(tǒng)的相互作用雀费,這一發(fā)表于Immunity 的成果為本領(lǐng)域研究微生物與皮膚相互作用及其在皮膚發(fā)育、炎癥應(yīng)答等中的作用提供了全新視角痊焊。
3盏袄、2022年7月,團(tuán)隊(duì)首次揭示了AD患者皮脂腺脂質(zhì)的成分特征薄啥,發(fā)現(xiàn)皮脂腺的功能失調(diào)可能參與了AD的發(fā)病機(jī)制辕羽,為探究AD防治策略提供了“皮脂腺-皮膚菌群”軸的新思路5。利用靶向代謝組垄惧、基因敲除等手段刁愿,團(tuán)隊(duì)深入研究了以皮脂為底物的皮膚菌群代謝物對(duì)皮膚炎癥的影響,解釋了其中一個(gè)核心代謝物減輕AD炎癥的作用及機(jī)制锉择,并通過臨床研究證實(shí)局部外用該小分子可顯著減輕AD患者的皮膚炎癥和瘙癢評(píng)分6土霞。在此基礎(chǔ)上,團(tuán)隊(duì)進(jìn)一步運(yùn)用鈣成像沟脓、電生理每访、在體微型雙光子成像等手段發(fā)現(xiàn)了該小分子可以減輕瘙癢這個(gè)AD主要臨床癥狀7盘肺。該研究2024年發(fā)表于Allergy,不但首次揭示了皮膚菌群對(duì)AD瘙癢的調(diào)控及機(jī)制康蚯,也為后續(xù)開發(fā)針對(duì)瘙癢的微生態(tài)治療提供了理論基礎(chǔ)和潛在候選藥物灾纱。
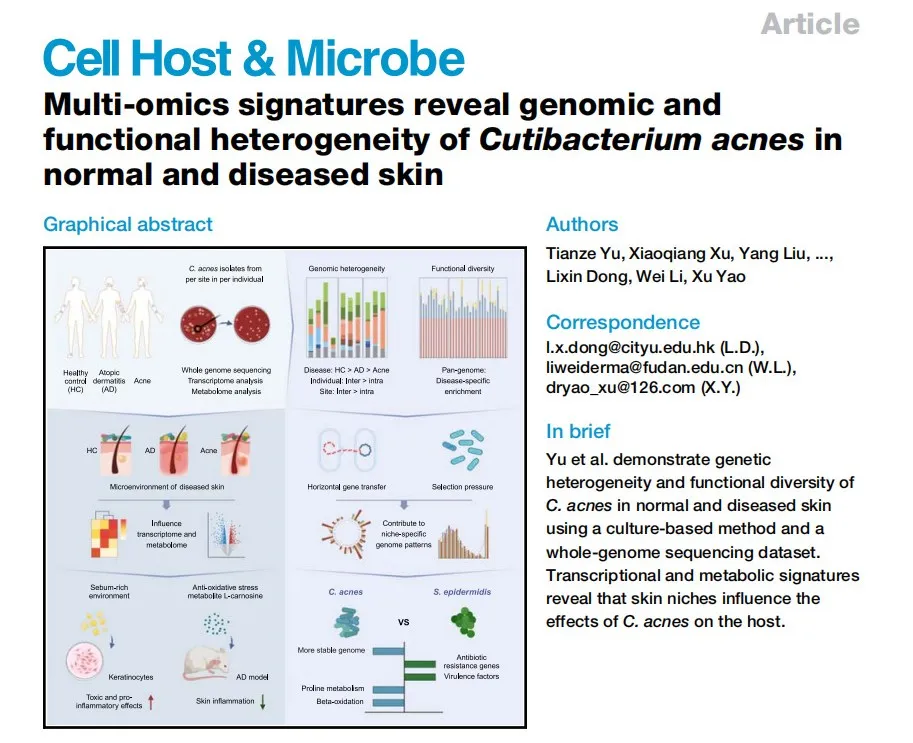
4、2023-2024年間侦纳,團(tuán)隊(duì)揭示了表皮葡萄球菌與痤瘡丙酸桿菌兩大主要皮膚微生物的菌株多樣性在AD中的作用时损。團(tuán)隊(duì)利用宏基因組學(xué)、培養(yǎng)組學(xué)勤焕、轉(zhuǎn)錄組分析脾膨、基因工程等多種不同的手段,探索了健康人群與AD患者表皮葡萄球菌的菌株異質(zhì)性疮丛,以及特定菌株在治療AD中的作用8幔嫂。另外,針對(duì)從健康皮膚誊薄、AD患者和痤瘡患者皮膚分離的痤瘡丙酸桿菌(C. acnes)菌株履恩,團(tuán)隊(duì)開展了全球范圍內(nèi)為數(shù)最多的全基因組、轉(zhuǎn)錄組呢蔫、和代謝組測(cè)序以及功能研究切心,首次從單菌株層面揭示了C. acnes的基因和功能異質(zhì)性,該研究于2024年6月以封面文章發(fā)表在Cell Host & Microbe 9片吊。這兩項(xiàng)高精度的單菌株群體分析不但為研究人員理解皮膚微生物在炎癥性皮膚病中的作用奠定了堅(jiān)實(shí)的基礎(chǔ)绽昏,而且極大地充實(shí)了零一生命的皮膚菌株庫(kù),方便后續(xù)針對(duì)痤瘡和AD篩選活體生物藥及創(chuàng)新小分子藥物定鸟。
5而涉、團(tuán)隊(duì)還發(fā)現(xiàn)并證實(shí)人體腸道菌群對(duì)AD的影響。研究團(tuán)隊(duì)觀察到在AD發(fā)生發(fā)展過程中联予,除了皮膚微生物之外,腸道菌群及其代謝產(chǎn)物也可通過影響炎癥通路材原、免疫穩(wěn)態(tài)以及腸-腦-皮膚軸偏团,來調(diào)控痤瘡、AD以及銀屑病的發(fā)生發(fā)展猎递。團(tuán)隊(duì)的前期研究也發(fā)現(xiàn)了人群腸道菌群在AD中的改變库忽,因此利用動(dòng)物模型研究了益生菌干預(yù)腸道微生物治療AD的機(jī)制,發(fā)現(xiàn)其可以增加腸道菌群多樣性和腸道中的丁酸鹽水平乡试,進(jìn)而誘導(dǎo)調(diào)節(jié)性樹突狀細(xì)胞(DCregs) 的增加拌九,最終達(dá)到AD癥狀的緩解10。這一研究揭示了零一生命旗下因微品牌多個(gè)皮膚益生菌產(chǎn)品的作用機(jī)制吻蟹。
同時(shí)恐丧,聯(lián)合研究團(tuán)隊(duì)在人群層面研究了環(huán)境暴露因子與腸道微生物瀑乡、AD的發(fā)生及IgE水平的關(guān)系,闡述了衛(wèi)生相關(guān)的居住環(huán)境與AD的IgE水平有關(guān)晚沙,首次揭示了內(nèi)源性AD和外源性AD在腸道微生物的組成和功能上的不同11橙挽。基于這一研究喝赎,團(tuán)隊(duì)隨后開展了一項(xiàng)過敏原特異性免疫治療(allergen?specific immunotherapy冶驴,AIT)與腸道菌群相關(guān)性的研究,于2023年12月發(fā)表于Cell Reports Medicine田炭,該研究在群落和個(gè)體微生物層面全面系統(tǒng)地分析了AD患者在AIT過程中口腔菌群和腸道菌群在組成和功能上的變化师抄,揭示了菌群影響AIT療效的因素12。未來有望通過調(diào)節(jié)腸道微生物教硫,為AD的有效治療提供更多選擇司澎。
零一生命研發(fā)管線與展望
八年磨一劍。零一生命研發(fā)團(tuán)隊(duì)圍繞著皮膚疾病與微生物的研究栋豫,從皮膚生物學(xué)特征挤安、炎癥性皮膚病發(fā)病機(jī)制、菌群在皮膚病中的作用丧鸯、菌群與宿主相互作用等多個(gè)方面蛤铜,從皮膚、腸道丛肢、口腔等多種角度深度闡釋了微生物與皮膚疾病的關(guān)系围肥。在這個(gè)過程中,零一生命也成功建立了全球領(lǐng)先的人體微生物資源挖掘和分析平臺(tái)HoloBioXTM蜂怎,并集成了龐大的穆刻、具中國(guó)人群代表性的微生物菌株庫(kù)和細(xì)菌衍生代謝物庫(kù)。
前期的大量研究工作不但為公司后續(xù)加速開發(fā)基于人體微生物的創(chuàng)新藥提供了堅(jiān)實(shí)的理論基礎(chǔ)以及技術(shù)支持登彪,也為管線的未來發(fā)展提供了許多新的思路和方向籍勘。

零一生命創(chuàng)新藥物管線
未來五年內(nèi),零一生命除了在皮膚微生態(tài)領(lǐng)域持續(xù)圍繞AD标狼、脫發(fā)挤胃、痤瘡等疾病展開系統(tǒng)性研究,在腸道微生態(tài)領(lǐng)域也將陸續(xù)推出圍繞IBD和肥胖等疾病的管線纠徘,將前期積累的理論轉(zhuǎn)化開發(fā)為更多革命性君博、且高度安全有效的全球首創(chuàng)新藥、護(hù)膚品原料和食品原料暴雕,以中國(guó)原始創(chuàng)新服務(wù)世界各地患者和用戶的需求慧贩。
參考資料
[1] Li W, Xu X, Wen H, et al. Inverse Association Between the Skin and Oral Microbiota in Atopic Dermatitis. The Journal of investigative dermatology. Aug 2019;139(8):1779-1787.e1712.
[2]Yu J, Luo Y, Zhu Z, et al. A tryptophan metabolite of the skin microbiota attenuates inflammation in patients with atopic dermatitis through the aryl hydrocarbon receptor. The Journal of allergy and clinical immunology. Jun 2019;143(6):2108-2119.e2112.
[3] Liu X, Zhang X, Zhang J, et al. Activation of aryl hydrocarbon receptor in Langerhans cells by a microbial metabolite of tryptophan negatively regulates skin inflammation. Journal of dermatological science. Dec 2020;100(3):192-200.
[4] Liu X, Zhu R, Luo Y, et al. Distinct human Langerhans cell subsets orchestrate reciprocal functions and require different developmental regulation. Immunity. Oct 12 2021;54(10):2305-2320.e2311.
[5] Yin H, Qiu Z, Zhu R, et al. Dysregulated lipidome of sebum in patients with atopic dermatitis. Allergy. Jun 2023;78(6):1524-1537.
[6]Qiu Z, Zhu Z, Liu X, et al. A dysregulated sebum-microbial metabolite-IL-33 axis initiates skin inflammation in atopic dermatitis. The Journal of experimental medicine. Oct 3 2022;219(10).
[7] Xu Y, Qiu Z, Gu C, et al. Propionate alleviates itch in murine models of atopic dermatitis by modulating sensory TRP channels of dorsal root ganglion. Allergy. May 2024;79(5):1271-1290.
[8]Zhou Y, Xu X, Liu Y, et al. Heterogeneous Regulation of StaphylococcusAureus by Different StaphylococcusEpidermidisagr Types in Atopic Dermatitis. The Journal of investigative dermatology. Dec 2023;143(12):2484-2493.e2411.
[9] Yu T, Xu X, Liu Y, et al. Multi-omics signatures reveal genomic and functional heterogeneity of Cutibacterium acnes in normal and diseasedskin. Cell Host Microbe. Jul 10 2024;32(7):1129-1146.e1128.
[10] Xu B, Ling S, Xu X, et al. A New Formulation of Probiotics Attenuates Calcipotriol-Induced Dermatitis by Inducing Regulatory Dendritic Cells. Frontiers in immunology. 2021;12:775018.
[11] Liu X, Xu J, Wang Z, et al. Differential changes in the gut microbiota between extrinsic and intrinsic atopic dermatitis. Journal of autoimmunity. Dec 2023;141:103096.
[12] Liu X, Xu B, Xu X, et al. Attenuation of allergen-specific immunotherapy for atopic dermatitis by ectopic colonization of Brevundimonas vesicularis in the intestine. Cell reports. Medicine. Dec 19 2023;4(12):101340.

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識(shí)林
識(shí)林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽