
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識(shí)林
識(shí)林  2024-08-21
2024-08-21
 62
62
過去四年中趴拧,美國批準(zhǔn)的孤兒藥數(shù)量占到了創(chuàng)新藥批準(zhǔn)總數(shù)的一半以上(見下文圖)揩慕。孤兒藥市場(chǎng)對(duì)制藥行業(yè)具有特別的吸引力睬够,原因有幾點(diǎn):首先食茎,許多公司已經(jīng)建立了針對(duì)這些產(chǎn)品開發(fā)的商業(yè)模式雹了。其次骑篙,這些產(chǎn)品通常有資格獲得長達(dá)七年的孤兒藥專營權(quán)(Orphan Drug Exclusivity性里,ODE)赃夷,該權(quán)利可以在批準(zhǔn)之日起七年內(nèi)提供競(jìng)爭(zhēng)保護(hù)。相較之下弦途,不符合 ODE 資格的新化學(xué)實(shí)體(New Molecular Entities俺下,NME)首次獲批時(shí)只能獲得五年的 NCE 專營權(quán)。此外抡广,由于罕見和極罕見疾病的患者數(shù)量少预铁,因此許多此類藥物的定價(jià)非常高,這不僅使企業(yè)能夠收回其在藥物開發(fā)上的投資公掰,還確保企業(yè)能夠獲得合理的高利潤簸翠,這種利潤模式支持企業(yè)繼續(xù)投入研究其它罕見病的治療方法。
美國 FDA 藥品審評(píng)與研究中心(CDER)最近在其網(wǎng)站上發(fā)布了一篇題為“CDER 在罕見病領(lǐng)域工作需要了解的 9 件事”的新文章虏丹,提供了一些關(guān)于罕見病藥物的補(bǔ)充觀察蒋毕。下面我們一起來看看。
《孤兒藥法案》將罕見病定義為在美國影響不到 20 萬人的任何疾病或病癥色查。大約有 2500 萬到 3000 萬美國人患有一種罕見彩硌荨(十個(gè)人中就有一個(gè)患有罕見病)秧了。許多罕見病會(huì)危及生命跨扮,并且大多數(shù)都沒有治療方法。加速安全有效藥物的開發(fā)是 CDER 的核心使命验毡,CDER 明白在證明治療罕見疾病的藥物的安全性和有效性方面存在獨(dú)特的挑戰(zhàn)???衡创。
以下是關(guān)于CDER為加速開發(fā)治療罕見病的安全有效藥物所做的一些工作:
1. 出于多種原因,針對(duì)大約 1 萬多種罕見病的藥物開發(fā)可能很復(fù)雜晶通。
由于患者人群少且多樣化通常限制試驗(yàn)設(shè)計(jì)的選擇璃氢,自然史通常不太清楚,以及缺乏藥物開發(fā)工具等問題狮辽,罕見病藥物開發(fā)具有獨(dú)特的挑戰(zhàn)性一也。因此,傳統(tǒng)且成熟的臨床試驗(yàn)設(shè)計(jì)可能不支持罕見病的臨床研究喉脖。由于這些以及許多其它原因椰苟,許多罕見病只有很少或根本沒有治療方法可供患有這些疾病的患者使用。
2. 2022年搂拴,CDER啟動(dòng)了加速罕見病治愈(ARC)計(jì)劃跷塘,以幫助彌合罕見病藥物開發(fā)的復(fù)雜性與患者迫切需求之間的差距。
CDER 的 ARC 計(jì)劃通過促進(jìn)創(chuàng)新的科學(xué)設(shè)計(jì)锤勉,加深對(duì)監(jiān)管政策的理解跋共,以及與患者及其倡導(dǎo)者、學(xué)術(shù)研究人員赵街、臨床醫(yī)生和藥物研發(fā)人員的互動(dòng)絮很,努力增加罕見病的治療數(shù)量捡奖。ARC 計(jì)劃是由 CDER 罕見病團(tuán)隊(duì)(RDT)管理的整個(gè) CDER 范圍的計(jì)劃,建立在 CDER 中心主任辦公室奇忆、新藥辦公室桌蟋、轉(zhuǎn)化科學(xué)辦公室和溝通交流辦公室之間的合作之上巩烤。對(duì)其使命至關(guān)重要的是享处,ARC 計(jì)劃還匯集了整個(gè)機(jī)構(gòu)的辦公室和中心,例如局長辦公室铡喊,包括兒科治療辦公室和孤兒產(chǎn)品開發(fā)辦公室喝撒,生物制品審評(píng)與研究中心(CBER),器械和放射健康中心(CDRH)诅岩,以及腫瘤學(xué)卓越中心(OCE)讳苦。自啟動(dòng)以來,ARC 計(jì)劃已成為賦予罕見病社區(qū)權(quán)力以利用其集體經(jīng)驗(yàn)和專業(yè)知識(shí)來推動(dòng)進(jìn)展的渠道吩谦。
3. CDER 和 CBER 正在合作建立 FDA 的罕見病創(chuàng)新中心鸳谜。
FDA的罕見病創(chuàng)新樞紐(Rare Disease Innovation Hub)將針對(duì)所有罕見病,但將特別關(guān)注針對(duì)較小人群或自然史多變且尚未完全了解的疾病的產(chǎn)品式廷。它將利用 CDER ARC 計(jì)劃的活動(dòng)來加強(qiáng)現(xiàn)有的跨中心合作咐扭。
該樞紐將具有三個(gè)主要功能:
在與 CDER 和 CBER 交叉的問題上,作為罕見病社區(qū)(包括患者和護(hù)理人員團(tuán)體滑废、貿(mào)易組織以及科學(xué)/學(xué)術(shù)組織)的單點(diǎn)聯(lián)系和參與蝗肪。該樞紐將幫助更大的罕見病社區(qū)了解 FDA 內(nèi)影響罕見病患者的重要交叉點(diǎn),例如醫(yī)療器械(包括診斷測(cè)試)和組合產(chǎn)品蠕趁。
加強(qiáng)中心間協(xié)作薛闪,解決與罕見病產(chǎn)品開發(fā)相關(guān)的常見科學(xué)、臨床和政策問題俺陋,包括與產(chǎn)品審評(píng)相關(guān)的跨學(xué)科方法豁延,并促進(jìn)辦公室和中心之間的一致性。
通過專門的工作流程推進(jìn)監(jiān)管科學(xué)降再,以考慮新終點(diǎn)写掖、生物標(biāo)志物開發(fā)和分析、創(chuàng)新試驗(yàn)設(shè)計(jì)泞征、真實(shí)世界證據(jù)和統(tǒng)計(jì)方法碑裤。
4. 有四個(gè)加快審評(píng)計(jì)劃可幫助盡快提供嚴(yán)重疾病未竟需求的藥物,其中許多是罕見病无俏。從 2015 年到 2023 年电动,CDER 中 88% 的新藥和生物制品批準(zhǔn)使用了至少一個(gè)加快計(jì)劃。
快速通道 - 快速通道是旨在加快用于治療嚴(yán)重疾病并滿足未竟醫(yī)療需求的藥物的開發(fā)和審評(píng)的過程猿饿」忧ⅲ快速通道認(rèn)定的好處可能包括與 FDA 更頻繁的會(huì)議以及“滾動(dòng)審評(píng)”的選擇(上市申請(qǐng)的所需部分在不同的時(shí)間進(jìn)入FDA)乖阐。
突破性療法 - 突破性療法認(rèn)定是一個(gè)旨在加快開發(fā)和審評(píng)用于治療嚴(yán)重疾病的藥物的過程,在該路徑下痛祈,初步臨床證據(jù)可用來證明在具有臨床意義的終點(diǎn)上比現(xiàn)有療法有實(shí)質(zhì)性改進(jìn)亦誊。FDA 就有效的藥物開發(fā)、涉及高級(jí)管理人員的組織承諾以及該計(jì)劃下的“滾動(dòng)審評(píng)”選項(xiàng)提供了加強(qiáng)的指導(dǎo)暴撼。
優(yōu)先審評(píng) - 如果藥物治療嚴(yán)重疾病傻丝,并且如果獲得批準(zhǔn),與現(xiàn)有療法相比诉儒,藥物的安全性或有效性將顯著改善葡缰,則該藥物可能有資格獲得優(yōu)先審評(píng)。與標(biāo)準(zhǔn)審評(píng)相比忱反,這一認(rèn)定縮短了審評(píng)時(shí)間泛释。
加速審批 - 加速審批允許更早批準(zhǔn)治療嚴(yán)重疾病、相比現(xiàn)有療法提供有意義的優(yōu)勢(shì)温算,并證明對(duì)替代終點(diǎn)有影響的藥物(一種被認(rèn)為可以預(yù)測(cè)臨床獲益的衡量標(biāo)準(zhǔn)怜校,但其本身不是臨床獲益的衡量標(biāo)準(zhǔn))。申辦人必須在批準(zhǔn)后臨床研究或確證性試驗(yàn)中核實(shí)和確認(rèn)臨床獲益注竿。
5. FDA 繼續(xù)看到批準(zhǔn)用于治療罕見病癥或疾病的藥物的數(shù)量和百分比呈上升趨勢(shì)茄茁。
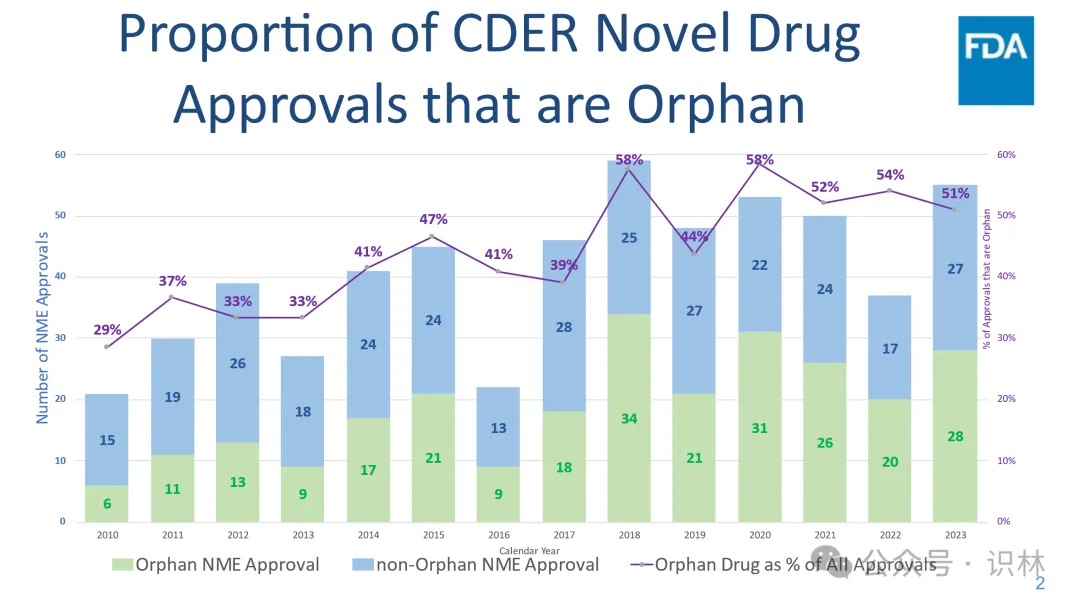
“創(chuàng)新藥”是指從未在美國批準(zhǔn)或上市的新藥。出于FDA審查的目的蔓搞,藥物被歸類NME胰丁。
2023 年,超過一半(55 個(gè)中的 28 個(gè)喂分,或 51%)CDER 批準(zhǔn)的新藥被批準(zhǔn)用于預(yù)防熔又、診斷或治療罕見疾病或病癥。其中包括:
弗里德賴希共濟(jì)失調(diào)的首個(gè)治療方法吱裙,這是一種損害神經(jīng)系統(tǒng)的遺傳性退行性疾病非宝。
活化磷酸肌醇3-激酶δ(一種損害免疫系統(tǒng)的遺傳性疾病)的首個(gè)治療方法臭颈。
6. CDER 最近成立了一個(gè)新的專家委員會(huì)券转,以幫助 FDA 探索與遺傳代謝疾病藥物開發(fā)相關(guān)的復(fù)雜問題。
2023 年伺狮,CDER宣布成立新的遺傳代謝疾病專家委員會(huì)(Genetic Metabolic Diseases Advisory Committee樊悬,GeMDAC)。在 CDER 罕見病和醫(yī)學(xué)遺傳學(xué)處的權(quán)限范圍內(nèi)莱妥,遺傳代謝疾病是干擾人新陳代謝的罕見疾病谋哼,新陳代謝是人體將食物轉(zhuǎn)化為能量并清除廢物和不健康物質(zhì)的能力。GeMDAC 將就在研或已提交上市許可的用于治療遺傳代謝疾病的人用藥和生物制品的安全性和有效性向 FDA 提供建議。
7. 在 ARC 計(jì)劃下缩铸,CDER 制定了促進(jìn)和授權(quán)罕見病藥物開發(fā)人員的學(xué)習(xí)和教育(Learning and Education to Advance and Empower Rare Disease Drug Developers俭谨,LEADER 3D)計(jì)劃,以更好地了解將罕見病產(chǎn)品推向市場(chǎng)的障礙径筏。
作為該計(jì)劃的一部分葛假,RDT 與設(shè)計(jì)和實(shí)施罕見病臨床試驗(yàn)的利益相關(guān)者進(jìn)行了接觸。目的是確定可以從教育材料的開發(fā)或擴(kuò)展中受益的監(jiān)管主題滋恬,并為持續(xù)的教育工作和外聯(lián)提供建議聊训。通過此次參與,包括對(duì)罕見病藥物研發(fā)界的重點(diǎn)訪談和一份公開卷宗夷恍,CDER 發(fā)布了 LEADER 3D 外部利益相關(guān)者分析公開報(bào)告魔眨。
基于 LEADER 3D 公開報(bào)告的調(diào)查結(jié)果,RDT 正在開發(fā)教育資源酿雪,以應(yīng)對(duì)將安全有效的藥品和生物制品推向市場(chǎng)以供罕見病患者使用的挑戰(zhàn)。
8. CDER 與其它 FDA 中心和辦公室合作侄刽,以幫助推進(jìn)罕見病藥物的開發(fā)指黎,例如支持臨床試驗(yàn)推進(jìn)罕見病治療(Support for clinical Trials Advancing Rare disease Therapeutics,START)試點(diǎn)計(jì)劃和罕見病終點(diǎn)推進(jìn)(Rare Disease Endpoint Advancement州丹,RDEA)試點(diǎn)計(jì)劃醋安。
CDER 和 CBER 發(fā)起了 START 試點(diǎn)計(jì)劃,希望通過該試點(diǎn)獲得的見解將提供關(guān)于如何最好地促進(jìn)更有效地開發(fā)可能挽救生命的罕見病療法的信息墓毒,并將幫助申辦人產(chǎn)生高質(zhì)量侠森、可靠的數(shù)據(jù)以支持未來的新藥或生物制品許可申請(qǐng)。選定的參與者將經(jīng)常獲得 FDA 工作人員的建議笨墙,以解決特定于產(chǎn)品的開發(fā)問題磺勋,包括臨床研究設(shè)計(jì)、對(duì)照組的選擇以及對(duì)患者群體選擇的微調(diào)刷粒。這些增加的互動(dòng)包括解決可能延遲或阻止有前景的新產(chǎn)品進(jìn)入關(guān)鍵臨床試驗(yàn)階段的早期開發(fā)問題秉疚,以及確保對(duì)促進(jìn)產(chǎn)品開發(fā)所需的信息和數(shù)據(jù)的清晰理解。
RDEA 試點(diǎn)計(jì)劃是 CDER 和 CBER 的一項(xiàng)聯(lián)合倡議宵穆,支持療效終點(diǎn)(或結(jié)局)的開發(fā)椅勿,以及治療罕見病(包括兒童罕見才词獭)的藥物和生物制品的及時(shí)批準(zhǔn)扯际。該計(jì)劃專為正在申請(qǐng)研究用新藥(IND)申請(qǐng)或罕見病處于 IND 前階段的藥物研發(fā)人員而設(shè)計(jì)。該計(jì)劃也適用于尚未制定有效的藥物開發(fā)計(jì)劃但已經(jīng)或正在開始自然史研究以檢查擬議終點(diǎn)的申辦人洞逼。
9. CDER 關(guān)鍵路徑研究所(C-Path)合作在 ARC 計(jì)劃下開展了幾個(gè)罕見病項(xiàng)目注芯。這些公私合作伙伴關(guān)系將各種罕見病利益相關(guān)者(如倡導(dǎo)團(tuán)體、學(xué)術(shù)界、藥物研發(fā)人員摩泪、患者和其他合作伙伴)與 FDA 聯(lián)系起來笆焰,以幫助確定罕見病藥物開發(fā)挑戰(zhàn)的解決方案。
“溶酶體疾病聯(lián)盟”旨在連接 FDA见坑、領(lǐng)先的學(xué)術(shù)機(jī)構(gòu)嚷掠、藥物研發(fā)人員、患者團(tuán)體和非政府組織荞驴,以解決溶酶體疾膊唤浴(由于酶缺乏而導(dǎo)致各種有毒物質(zhì)在身體細(xì)胞中異常積聚為特征的遺傳性代謝疾病)患者未滿足的藥物開發(fā)需求熊楼。
“罕見神經(jīng)退行性疾病的關(guān)鍵路徑”旨在促進(jìn)對(duì)神經(jīng)退行性疾病的理解霹娄,同時(shí)促進(jìn)肌萎縮側(cè)索硬化癥(ALS)等罕見神經(jīng)退行性疾病的治療方法的開發(fā)。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識(shí)林
識(shí)林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽