
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥明康德
藥明康德  2024-08-21
2024-08-21
 89
89
今日咆下,第一三共(Daiichi Sankyo)宣布其與阿斯利康(AstraZeneca)聯(lián)合開發(fā)的重磅抗體偶聯(lián)藥物(ADC)Enhertu(trastuzumab deruxtecan)獲得美國FDA授予突破性療法認(rèn)定(BTD)蝠肤,用于治療激素受體(HR)陽性HER2低表達(dá)(IHC 1+或IHC 2+/ISH-)或HER2超低表達(dá)(定義為帶有膜染色的IHC 0)不可切除或轉(zhuǎn)移性乳腺癌患者忆某,這些患者接受過兩線內(nèi)分泌療法治療其轉(zhuǎn)移性疾病几垃,或在接受一線內(nèi)分泌療法聯(lián)合CDK4/6抑制劑后6個月內(nèi)或在接受內(nèi)分泌輔助療法后24個月內(nèi)發(fā)生疾病進(jìn)展唤邻。此外勾徽,第一三共也同時宣布歐洲藥品管理局(EMA)已接受Enhertu新適應(yīng)癥的監(jiān)管申請迫横,將針對Enhertu作為單藥治療不可切除或轉(zhuǎn)移性HER2低或超低表達(dá)成年乳腺癌患者進(jìn)行評估绒障,這些患者至少接受過一次內(nèi)分泌療法治療轉(zhuǎn)移性疾病晃烟。
乳腺癌是最常見的癌癥之一,也是全球癌癥相關(guān)死亡的主要原因之一场恬。據(jù)統(tǒng)計翠柄,2022年全球確診乳腺癌病例超過200萬,死亡人數(shù)超過66.5萬吝寒。HER2是一種酪氨酸激酶受體生長促進(jìn)蛋白皿完,在包含乳腺癌等多種類型的腫瘤細(xì)胞表面表達(dá)。HER2表達(dá)水平高(IHC 3+或IHC2+/ISH+)的患者被歸類為HER2陽性办煞,并接受HER2靶向療法治療狈馏,約占所有乳腺癌的15%至20%。在過去害恋,未被歸類為HER2陽性的腫瘤被歸類為HER2陰性缘说,盡管這些腫瘤中許多仍然帶有一定程度的HER2表達(dá)。據(jù)估計赎丢,大約60%至65%的HR陽性劣零、HER2陰性乳腺癌為HER2低表達(dá),另外25%可能為HER2超低表達(dá)腫瘤探橱。目前沒有專門針對HER2超低表達(dá)患者的靶向療法獲得批準(zhǔn)申屹。
這次美國FDA授予BTD以及EMA接受監(jiān)管申請,主要是基于DESTINY-Breast06試驗的積極數(shù)據(jù)隧膏。這是一項全球性哗讥、隨機(jī)、開放標(biāo)簽的3期試驗胞枕,旨在評估Enhertu(5.4 mg/kg)與研究者選擇的化療對HR陽性杆煞、HER2低或超低表達(dá)的晚期或轉(zhuǎn)移性乳腺癌患者的療效和安全性。受試者均未接受過針對晚期或轉(zhuǎn)移性疾病的化療腐泻,并且接受過至少兩線內(nèi)分泌療法治療轉(zhuǎn)移性疾病决乎。如果患者在轉(zhuǎn)移性環(huán)境中接受過一線內(nèi)分泌療法聯(lián)合CDK4/6抑制劑,并且在一線治療后6個月內(nèi),或在接受過內(nèi)分泌輔助療法后24個月內(nèi)出現(xiàn)疾病進(jìn)展构诚,他們也符合入組條件蚌斩。該試驗共招募了866例患者,包含713名HER2低表達(dá)范嘱,以及153名HER2超低表達(dá)患者送膳。
DESTINY-Breast06試驗的主要分析顯示:
在HER2低表達(dá)患者中,與化療相比斤间,Enhertu通過盲法獨立中心審查(BICR)將疾病進(jìn)展或死亡風(fēng)險降低了38%(HR=0.62穆烹;95% CI:0.51-0.74;p<0.0001)稿棚。Enhertu組的中位無進(jìn)展生存期(PFS)為13.2個月败何,而化療組為8.1個月。
在整體試驗人群中采缎,Enhertu與化療相比诺骏,疾病進(jìn)展或死亡風(fēng)險降低了37%,中位PFS為13.2個月哈滥,而化療組為8.1個月(HR=0.63糊扑;95% CI:0.53-0.75;p<0.0001)喷总。
此外樟闽,預(yù)定的探索性分析顯示,在HER2低表達(dá)和HER2超低表達(dá)患者中柳卒,患者PFS的臨床顯著改善表現(xiàn)一致笨扁。在HER2超低表達(dá)患者中,Enhertu將疾病進(jìn)展或死亡風(fēng)險降低了22%列疗,中位PFS為13.2個月滑蚯,而化療組為8.3個月(HR=0.78;95% CI:0.50-1.21)抵栈。在Enhertu組中觀察到13例完全緩解告材,包括9例HER2低表達(dá)患者。在HER2超低表達(dá)亞組中古劲,Enhertu組有4例完全緩解斥赋,而在化療組中沒有觀察到完全緩解。詳細(xì)數(shù)據(jù)請見下表:
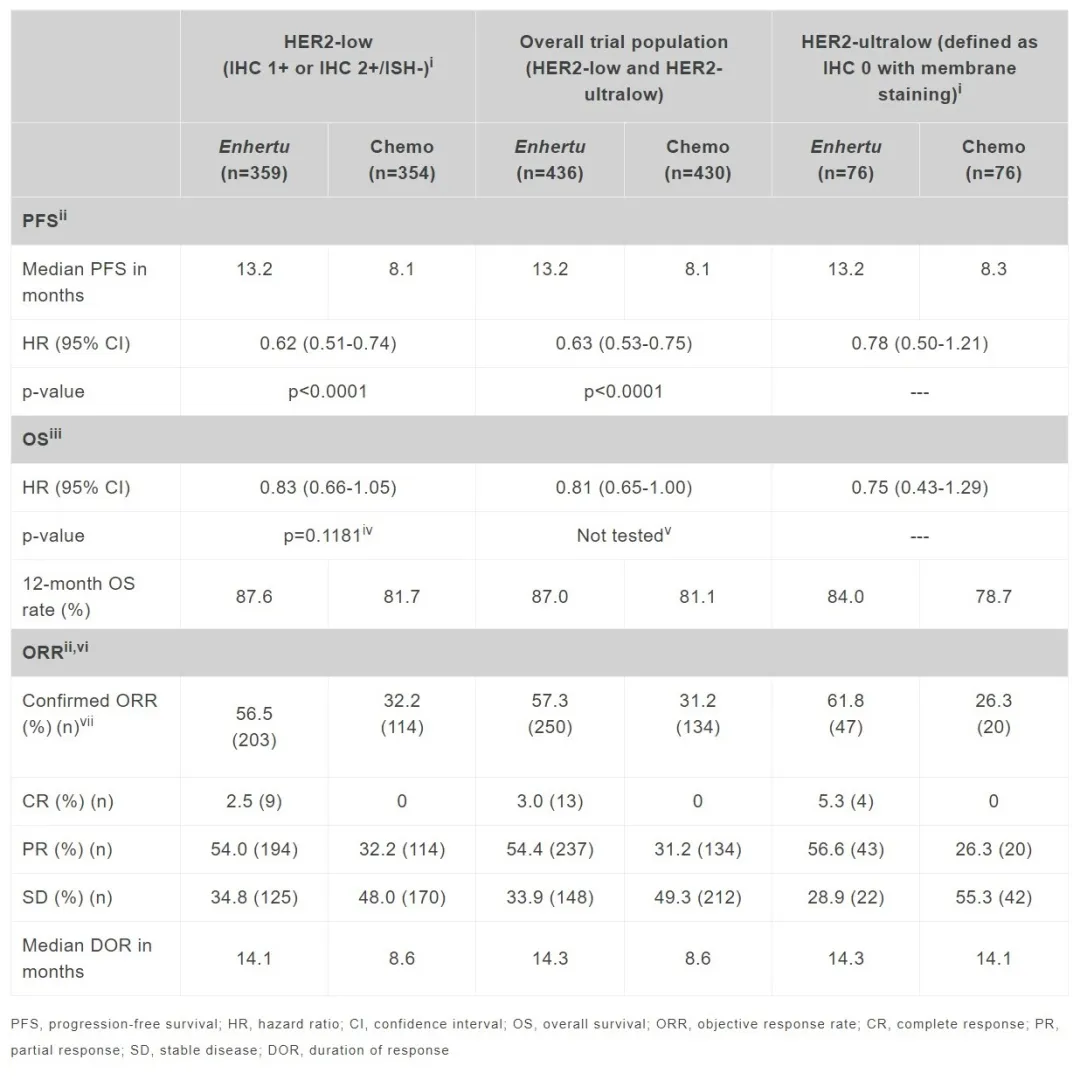
▲DESTINY-Breast06試驗的數(shù)據(jù)總結(jié)(圖片來源:參考資料[3])
Enhertu是阿斯利康和第一三共聯(lián)合開發(fā)的ADC療法产艾。它采用第一三共專有的DXd ADC技術(shù)平臺設(shè)計疤剑,由靶向HER2的人源化單克隆抗體通過四肽可裂解連接子,與拓?fù)洚悩?gòu)酶1抑制劑有效載荷連接組成闷堡。Enhertu在2019年首次獲美國FDA批準(zhǔn)隘膘,用以治療無法切除或轉(zhuǎn)移性HER2陽性乳腺癌患者。今年4月,F(xiàn)DA批準(zhǔn)該療法用于治療不可切除或轉(zhuǎn)移性HER2陽性實體瘤成年患者弯菊,這些患者已接受過先前治療且缺乏滿意的替代治療選項昵乾。之前新聞稿指出,Enhertu是首款具有不限癌種適應(yīng)癥的HER2靶向ADC療法田蕴。
直至目前為止伦够,Enhertu已獲得8項BTD,其中4項是針對轉(zhuǎn)移性乳腺癌寂齐。除了這次新授予的BTD之外,之前乳腺癌相關(guān)的3項BTD分別是針對后線HER2低表達(dá)轉(zhuǎn)移性乳腺癌尺笼、二線HER2陽性轉(zhuǎn)移性乳腺癌和后線HER2陽性轉(zhuǎn)移性乳腺癌肃逐。Enhertu還獲得了另外4項BTD,包括針對HER2陽性轉(zhuǎn)移性實體瘤林下、HER2陽性轉(zhuǎn)移性結(jié)直腸癌袄肩、HER2突變轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)和HER2陽性轉(zhuǎn)移性胃癌。
除了共同開發(fā)Enhertu腋芜,阿斯利康和第一三共也共同開發(fā)Trop2靶向ADC datopotamab deruxtecan(Dato-DXd)再副。美國FDA在這個月接受兩家公司所遞交該療法的生物制品許可申請,用于治療無法切除或轉(zhuǎn)移性HR陽性花炭、HER2陰性乳腺癌成人患者躬拢,這些患者已接受過前期全身治療。
除了與阿斯利康進(jìn)行合作以外见间,第一三共也在去年10月與默沙東(MSD)就該公司的三個ADC候選藥物:patritumab deruxtecan(HER3-DXd)聊闯、ifinatamab deruxtecan(I-DXd)和raludotatug deruxtecan(R-DXd)達(dá)成了全球開發(fā)和商業(yè)化協(xié)議,將在全球范圍內(nèi)共同開發(fā)和潛在商業(yè)化這些候選ADC療法米诉。
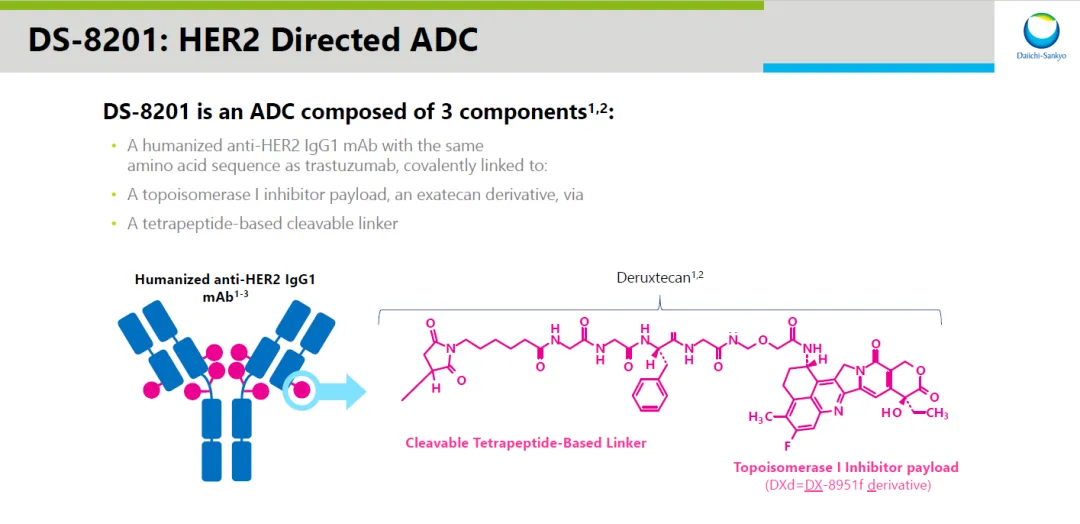
▲Enhertu(DS-8201)結(jié)構(gòu)示意圖(圖片來源:參考資料[4])
ADC是新藥開發(fā)的熱點領(lǐng)域之一菱蔬,近年多家大藥企通過并購或授權(quán)協(xié)議在這一領(lǐng)域加碼布局。去年3月史侣,輝瑞(Pfizer)以430億美元收購了ADC先驅(qū)公司Seagen以擴(kuò)展其腫瘤學(xué)管線拴泌。去年12月,艾伯維(AbbVie)以總額達(dá)約101億美元收購ImmunoGen惊橱,獲得其“first-in-class”抗體偶聯(lián)藥物Elahere(mirvetuximab soravtansine)蚪腐。今年1月,強生(Johnson & Johnson)斥資高達(dá)約20億美元收購Ambrx Biopharma李皇,囊獲其分別靶向前列腺特異性膜抗原(PSMA)與HER2的抗體偶聯(lián)藥物ARX517與ARX788削茁。宜聯(lián)生物(MediLink Therapeutics)也在同月宣布與羅氏(Roche)達(dá)成全球合作和許可協(xié)議,將合作開發(fā)靶向間質(zhì)表皮轉(zhuǎn)化因子(c-MET)的下一代ADC候選產(chǎn)品YL211(c-MET ADC)掉房,用于治療實體瘤茧跋。
此外,在研ADC的開發(fā)也呈爆發(fā)式增長趨勢。根據(jù)摩根士丹利(Morgan Stanley)公司去年發(fā)布的一項報告捉肄,目前至少有1400項ADC的臨床試驗正在進(jìn)行中乃屈。
參考資料:
[1] ENHERTU? Granted Breakthrough Therapy Designation in U.S. for Certain Patients with HER2 Low or HER2 Ultralow Metastatic Breast Cancer. Retrieved August 19, 2024 from https://www.businesswire.com/news/home/20240818195338/en
[2] ENHERTU? Type II Variation Application Validated by EMA for Patients with HER2 Low or HER2 Ultralow Metastatic Breast Cancer Following At Least One Endocrine Therapy. Retrieved August 19, 2024 from https://www.businesswire.com/news/home/20240818615324/en
[3] Enhertu demonstrated a median progression-free survival of 13.2 months in HR-positive, HER2-low and HER2-ultralow metastatic breast cancer following one or more lines of endocrine therapy. Retrieved June 2, 2024, from https://www.astrazeneca.com/media-centre/press-releases/2024/Enhertu-demonstrated-median-progression-free-survival-thirteen-months.html
[4] Global Pharma Innovator with Competitive Advantage in Oncology. Retrieved April 5, 2024, from https://www.daiichisankyo.com/files/investors/library/materials/2020/pdf/20210113%E2%80%97JPM%20Conference.pdf

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8
 熱門資訊
熱門資訊