
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 細胞與基因治療領域
細胞與基因治療領域  2024-08-22
2024-08-22
 127
127
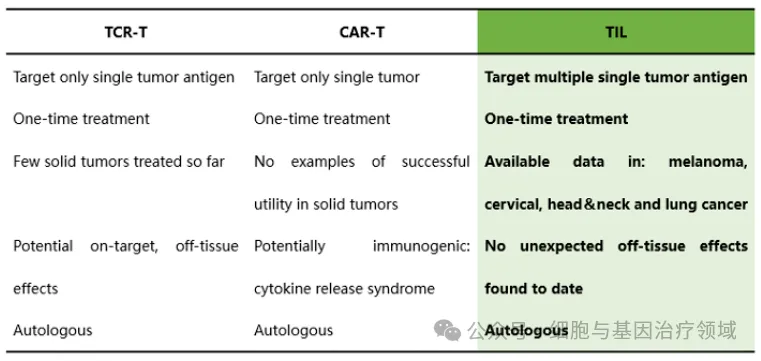
當下氧腰,國內(nèi)外企業(yè)研發(fā)熱度較高且已取得重大臨床進展的免疫細胞療法主要為CAR-T療法、CAR-NK療法左刽、TCR-T療法及TIL(Tumor Infiltrating Lymphocyte Cell,腫瘤浸潤淋巴細胞)療法。其中針對CAR-T療法的研發(fā)最為火熱恬砂,也已有數(shù)款針對血液腫瘤的CAR-T療法獲批上市肪禾,但由于實體瘤的特異性抗原少屋廓、異質(zhì)性及腫瘤微環(huán)境等,CAR-T療法在治療實體瘤方面存在諸多挑戰(zhàn)氧液,鑒于TIL療法在攻克實體瘤方面的優(yōu)勢,此療法被給予攻克實體瘤的厚望囱悴;此外沧仿,相比來看,TIL還具有臨床副作用小甫题,優(yōu)異的腫瘤定位能力馁筐、制備成本低等優(yōu)勢。
圖片來源:倚鋒資本
最近坠非,國外TIL細胞療法公司Iovance發(fā)布二季度財報敏沉,公司營收3110萬美元,其中首款上市的TIL療法Amtagvi銷售額1280萬美元炎码,與Amtagvi搭配使用的Proleukin銷售額為1830萬美元盟迟。Iovance預計今年三季度營收5300-5500萬美元,全年營收1.60-1.65億美元潦闲,2025年產(chǎn)品收入達4.50-4.75億美元攒菠。從今年2月Amtagvi獲批上市以來,累計治療超過55例患者歉闰,潛在適用患者每年超2萬例辖众,其年銷售峰值將超過10億美元。
當下和敬,國內(nèi)多家藥企已布局TIL細胞療法凹炸,國內(nèi)TIL細胞治療領域正逐步加速前進。
近年來肚乓,國內(nèi)多家布局TIL細胞療法的企業(yè)獲得融資运诺,例如:(1)2024年6月18日,萊芒生物宣布完成共5000萬元的天使+輪和天使++輪兩輪新增融資案帆;(2)2023年12月既倾,華賽伯曼宣布公司已經(jīng)完成數(shù)千萬元A輪融資,疊加政府給予的產(chǎn)業(yè)支持寨铸,企業(yè)共獲得近億元資本注入队屋;(3)2023年9月8日,沙礫生物(Grit Biotechnology)宣布完成4億元人民幣的B輪融資妖啸;(4)2023年2月卵手,原啟生物宣布完成4500萬美元的B1輪融資(5)2022年8月15日,畢諾濟生物宣布完成逾億元人民幣的天使+輪融資高坚。(6)2022年8月1日诫列,原啟生物宣布完成總金額超過1.2億美元的B輪融資;(7)2022年6月12日,北京循生生物醫(yī)學研究有限公司宣布完成數(shù)千萬元Pre-A輪融資剂东;(8)2022年5月18日迂卢,河北森朗生物科技有限公司宣布完成2億元人民幣融資;(9)2022年3月1 日桐汤,蘇州藍馬醫(yī)療技術有限公司宣布獲得數(shù)千萬美元Pre-A輪融資而克;(10)2022年2月,天科雅宣布完成超過3億元的新一輪融資怔毛。(11)2022年1月员萍,萊芒生物宣布完成近億元天使輪融資。
除上述公司外拣度,國內(nèi)布局TIL療法的公司還有很多家碎绎。例如:勁風生物、西比曼生物抗果、智瓴生物筋帖、卡替醫(yī)療、君賽生物冤馏、厚無生物幕随、百吉生物等。
1宿接、君賽生物
君賽生物是一家致力于基因細胞創(chuàng)新療法開發(fā)的生物醫(yī)藥公司赘淮,是國內(nèi)TIL療法細分領域的領軍企業(yè)。公司成立于2019年醇盏,已建成高標準的GMP級生產(chǎn)車間與質(zhì)控實驗室腔族,君賽生物依托自主開發(fā)、全球領先的DeepTIL?細胞培養(yǎng)與NovaGMP?基因修飾技術平臺秘乍,已先后開發(fā)全球首款無需清淋羽折、無需IL-2注射的天然TIL細胞新藥GC101及全球首款非病毒載體基因修飾TIL細胞新藥GC203。
其中崖郎,GC101已于2022年4月經(jīng)國家藥監(jiān)局批準進入臨床I期(國內(nèi)首批)巍樟。2023年12月,君賽生物與北京大學腫瘤醫(yī)院合作開展的一項針對GC101治療黑色素瘤的臨床驗證試驗完成首例受試者回輸給藥写雾;GC203于2024年4月28日獲得國家藥品監(jiān)督管理局(NMPA)臨床試驗默示許可(受理號:CXSL2400102)捍幽,用于治療晚期實體瘤。2024年5月29日蓬抖,GC203的I期臨床試驗(KUNLUN-01)啟動會在復旦大學附屬腫瘤醫(yī)院順利召開衩缘,據(jù)悉,這是國內(nèi)第一個正式啟動注冊臨床的基因修飾TIL療法肝浴。
此外延都,君賽生物另有多款TIL候選藥物正處于臨床前研究階段雷猪。GC101與GC203作為公司兩款臨床階段的TIL細胞新藥,已在治療黑色素瘤晰房、宮頸癌求摇、子宮內(nèi)膜癌、卵巢癌殊者、肺癌等多個瘤種中展現(xiàn)優(yōu)異的安全性與臨床療效与境。其中6例晚期患者腫瘤被完全清除,獲得CR療效幽污,且無瘤生存最久時間超2年嚷辅。與Amtagvi不同簿姨,所有接受君賽生物TIL療法治療的患者僅需入住普通病房距误,回輸前僅需接受低強度化療預處理,回輸后無需任何劑量的IL-2聯(lián)合用藥扁位,擴寬患者適用范圍准潭,大幅提高TIL療法安全性與可及性。
2域仇、沙礫生物
沙礫生物成立于2019年完骑,是一家專注于腫瘤免疫細胞治療,以TIL藥物為代表研發(fā)管線的創(chuàng)新型醫(yī)藥公司础恰。公司的核心研發(fā)平臺包括StemTexp?干性TIL擴增技術平臺谢佩、StaViral?病毒穩(wěn)轉株工藝、ImmuT Finder?免疫調(diào)節(jié)靶點發(fā)現(xiàn)平臺呻舆、KOReTIL?高效基因敲除系統(tǒng)绷举。沙礫生物已完成多輪股權融資,得到了國內(nèi)外多家知名創(chuàng)投基金的支持芯拇。沙礫生物自主研發(fā)的GT101注射液是國內(nèi)首個獲批注冊臨床的TIL藥物嘉散,目前已進入關鍵二期臨床試驗(全文鏈接:中國首個進入臨床的TIL產(chǎn)品正式開啟關鍵II期臨床試驗),預計于2025年底申報上市双漫。沙礫生物的下一代產(chǎn)品GT201完憨,已經(jīng)正式獲得國家藥品監(jiān)督管理局的臨床試驗默示許可,成為國內(nèi)首款進入注冊臨床試驗的基因編輯型TIL藥物刑吕,在IIT人體試驗中巫庵,該產(chǎn)品在多個晚期實體瘤患者體內(nèi)均表現(xiàn)出良好的安全性,并展示出穩(wěn)定的擴增和初步臨床療效端伪,并可以降低對于IL-2的依賴性兜叨。2024年6月1日,沙礫生物公布其基因編輯型TIL注射液GT316最新研究成果衩侥,在多名晚期實體瘤患者體內(nèi)表現(xiàn)出良好的安全性和臨床療效国旷,據(jù)悉矛物,該產(chǎn)品是全球首個進入臨床階段的CRISPR雙敲TIL產(chǎn)品。
公司TIL療法研發(fā)管線如下:

來源:沙礫生物官網(wǎng)
3跪但、華賽伯曼
青島華賽伯曼醫(yī)學細胞生物有限公司成立于2019年3月履羞,致力于做全球創(chuàng)新性、領先性的抗實體腫瘤TIL細胞藥物屡久。公司通過自主研發(fā)忆首,搭建了PowerTexp? 高效TIL生產(chǎn)工藝平臺,TMExpT? 腫瘤微環(huán)境調(diào)控表達平臺被环,為第二代基因改造的超級TIL及通用T細胞產(chǎn)品提供強有力的研發(fā)支撐糙及。目前已經(jīng)布局的管線有自體天然加強TIL產(chǎn)品HS-IT101和基因改造超級TIL產(chǎn)品HS-IT201、HS-IT301筛欢。其中浸锨,HS-IT101注射液于2023年11月獲得CDE臨床默示許可,2024年3月蝴勉,由國家癌癥中心/中國醫(yī)學科學院腫瘤醫(yī)院副院長李寧教授牽頭的HS-IT101注射液I期臨床試驗順利完成首例受試者給藥私庇。HS-IT101具有微量腫瘤組織即可滿足生產(chǎn)需求,相較AMTAGVI生產(chǎn)周期更短只需16天生肖,臨床端清淋劑量更低舀蚕、IL-2用量更低等特點優(yōu)勢。截至目前盘瞄,公司已完成A輪融資并獲得政府產(chǎn)業(yè)支持厢申,近億元資本注入,助力華賽伯曼推進TIL藥物臨床試驗及研發(fā)進程裹侍。
4钧饥、藍馬醫(yī)療
藍馬醫(yī)療是一家以TILs療法為核心的細胞免疫治療產(chǎn)品開發(fā)公司,公司成立于202年狰碟,創(chuàng)始人團隊在TIL療法領域深耕多年童唧,積累了近20年的產(chǎn)品優(yōu)化、生產(chǎn)及團隊管理經(jīng)驗钉呐。2021年4月镐胃,公司獲得天使輪融資,2022年3月桶现,公司宣布獲得數(shù)千萬美元的Pre-A輪融資躲雅。2023年7月,藍馬醫(yī)療的LM103注射液(TILs)正式獲得國家藥品監(jiān)督管理局(NMPA)的臨床試驗默示許可骡和,這是國內(nèi)TIL領域首個使用滋養(yǎng)細胞(Feeder)工藝的臨床許可相赁,藍馬醫(yī)療利用自己的T-Feeder平臺對Feeder的制備及其在TILs培養(yǎng)中的使用工藝進行了優(yōu)化,有效縮短TILs培養(yǎng)制備時間慰于,提高制備效率钮科,同時通過嚴格的質(zhì)控策略確保使用產(chǎn)品安全性唤衫,并通過研究者發(fā)起臨床研究初步證明了采用Feeder工藝的TILs在臨床上的安全性和有效性。2024年年3月绵脯,藍馬醫(yī)療在北京大學腫瘤醫(yī)院開展的LM103注射液1期臨床研究已經(jīng)為兩例惡性黑色素瘤受試者完成了細胞回輸佳励,其中一例受試者到達了首次療效評估隨訪點,且評估結果為部分緩解(PR)蛆挫。
5赃承、森朗生物
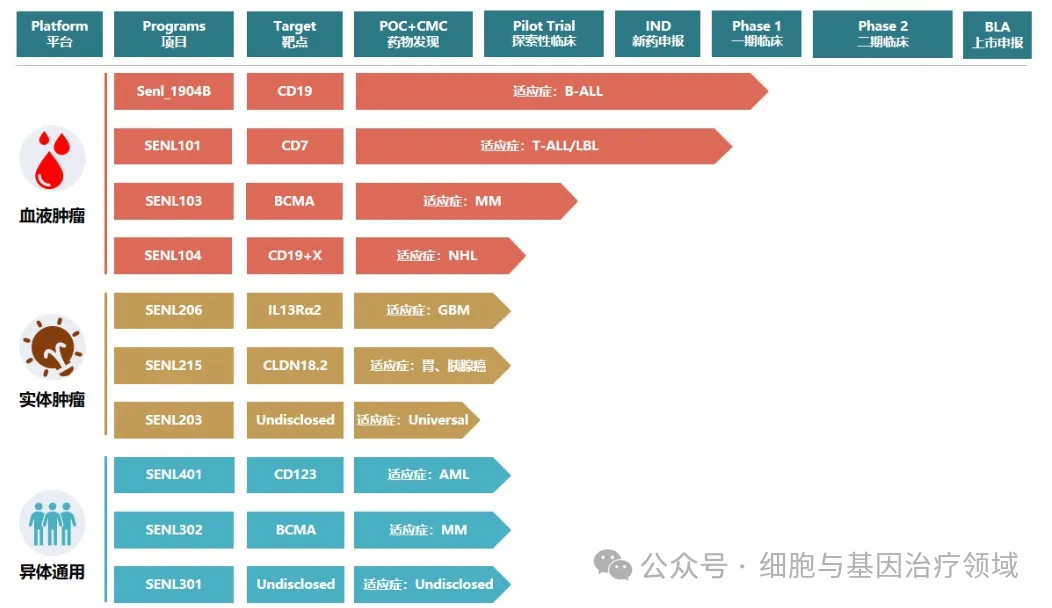
森朗生物全稱河北森朗生物科技有限公司是一家專注于細胞治療新技術研發(fā)與應用的生物醫(yī)藥公司,成立于2016年悴侵,位于河北省石家莊高新區(qū)瞧剖。經(jīng)過近幾年的壯大發(fā)展,公司已擁有一站式自主基因細胞藥物研發(fā)和產(chǎn)業(yè)化平臺灌滤、納米抗體開發(fā)和篩選平臺名娶,掌握規(guī)模化質(zhì)粒敲非、慢病毒載體衅洞、原代免疫細胞制備等核心技術源照,自主研發(fā)的“Senl_1904B自體T細胞注射液笋窍、SENL101自體T細胞注射液”均已獲得IND批準進入Ⅰ期臨床試驗,其中“SENL101自體T細胞注射液”更是于近日被美國藥品食品監(jiān)督管理局(FDA)授予孤兒藥資格認定(ODD)锁销,公司的整體實力與技術水平在國內(nèi)細胞治療行業(yè)已處于領先地位项凉。
公司擁有高效的細胞治療創(chuàng)新技術平臺,涉及自體CAR-T細胞療法赦牧、同種異體細胞療法巧糖、TIL細胞療法等,擁有面積5000平米的CAR-T研究中心胳瑟,公司在研產(chǎn)品管線見下圖蜻蒋,此外,公司在http://ClinicalTrials.gov網(wǎng)站已登記兩項TIL療法臨床試驗項目厢岂。2022年5月光督,公司宣布完成2億元人民幣融資。此外塔粒,值得一提的是结借,2023年10月,森朗生物的“細胞治療產(chǎn)品商業(yè)化生產(chǎn)基地項目”開工卒茬。該項目位于石家莊國際生物醫(yī)藥園內(nèi)船老,總建筑面積1.4萬平方米,總投資1.2億元圃酵,主要建設質(zhì)粒車間柳畔、慢病毒生產(chǎn)車間馍管、細胞生產(chǎn)車間以及研發(fā)實驗室等配套設施,建成后將成為森朗生物國內(nèi)生物細胞科研成果的重要轉化基地薪韩,預計2024年完成GMP廠房驗證咽斧。
來源:森朗生物官網(wǎng)
6、勁風生物
勁風生物成立于2020年躬存,是一家致力于腫瘤細胞治療產(chǎn)品研發(fā)與臨床應用的生物醫(yī)藥公司糯锦,善于利用生物信息技術、人工智能技術深度挖掘腫瘤多組學數(shù)據(jù)灶花,以生物信息數(shù)據(jù)驅動設計優(yōu)化T細胞治療產(chǎn)品值膝,提高產(chǎn)品療效。勁風生物的技術源頭依靠雙輪驅動—從美國勁風技術引進和本地化團隊研發(fā)并重艰吏。勁風生物生信團隊提出的TABR-BERT學習模型欺垛,基于AI深度學習的預測方法極大提高了對T細胞與抗原相互作用的精準識別,為預測未知抗原提供了新途徑涣累,助力了細胞免疫療法發(fā)展隆鹤。勁風生物是“下一代的 TIL產(chǎn)品”,具備治療實體腫瘤更高效的特點蹦争,是個性化的精準細胞治療產(chǎn)品汪请。2021年10月,公司完成A輪融資瑞捂。2022年2月贸左,公司宣布其TILs療法產(chǎn)品臨床I期申請獲得FDA批準,成為國內(nèi)首家TILs療法獲批臨床的TILs療法研發(fā)公司酷麦。
7矿卑、西比曼生物
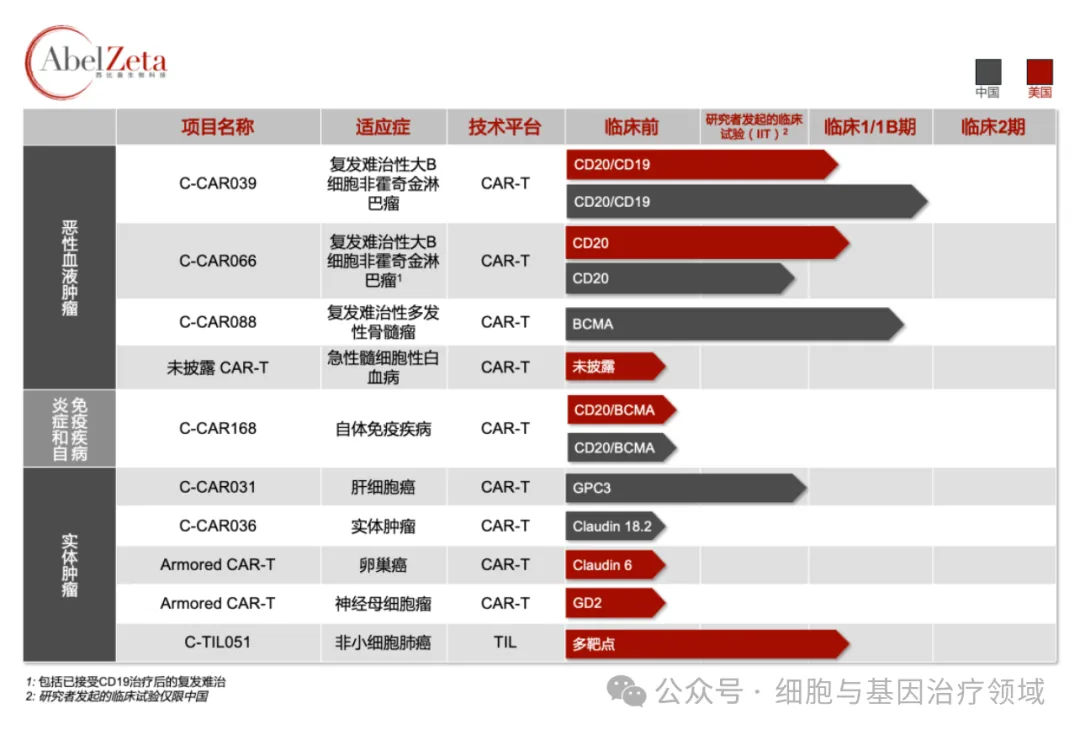
西比曼生物科技是一家處于臨床階段的全球性生物制藥公司,在中國上海和美國馬里蘭都設有創(chuàng)新中心沃饶,專注于開發(fā)創(chuàng)新型細胞治療產(chǎn)品母廷,致力于通過定制化治療,利用人體自身的免疫系統(tǒng)來對抗惡性血液腫瘤和實體腫瘤以及炎癥和免疫疾病糊肤。公司在各個創(chuàng)新中心內(nèi)均設有符合生產(chǎn)質(zhì)量管理規(guī)范(GMP)的生產(chǎn)基地琴昆,用于推動產(chǎn)品研發(fā)和早期臨床研究,管線覆蓋CAR-T和TIL療法轩褐。2021年9月椎咧,獲得1.2億美元的A輪融資。2022年10月把介,F(xiàn)DA正式批準了公司新型TIL療法C-TIL051 的I期臨床開發(fā)申請勤讽,適應癥為PD-1抗體難治或復發(fā)的晚期非小細胞肺癌。截至目前拗踢,西比曼免疫細胞療法管線中有10項已在中美開展臨床試驗脚牍。
來源:西比曼生物科技官網(wǎng)
8向臀、循生生物醫(yī)學
循生生物醫(yī)學是一家主攻腫瘤免疫治療開發(fā)的創(chuàng)新型生物醫(yī)藥公司,成立于2021年碗品,目前在研產(chǎn)品包括腫瘤細胞免疫治療產(chǎn)品和腫瘤治療性疫苗隆文。2022年6月公司宣布完成數(shù)千萬元Pre-A輪融資,將用于推進公司TILs療法產(chǎn)品人體臨床試驗芽嗓、HPV治療性疫苗動物試驗及其工藝開發(fā)方面的研究韧践。同年8月,循生醫(yī)學的TIL細胞治療藥物“腫瘤浸潤T淋巴細胞”臨床試驗的申請獲得受理班卖。
9随象、智瓴生物
廣州智瓴生物醫(yī)藥有限公司成立于2016年,是一家專注細胞免疫治療呆纤,集研發(fā)聪蔬、生產(chǎn)和臨床應用于一體的醫(yī)藥企業(yè),主要產(chǎn)品管線包括實體瘤自體腫瘤浸潤淋巴細胞(TIL)藥物屯片,自然殺傷細胞(NK)藥物无价、雙陰性T細胞(DNT)藥物,其中第一代TIL細胞藥物已經(jīng)完成在晚期宮頸癌的IIT研究床重,第二代產(chǎn)品已經(jīng)獲得中國國家藥品監(jiān)督管理局的臨床試驗默示許可琳柱。除此以外,智瓴生物第三代TIL產(chǎn)品及其他細胞產(chǎn)品也在七個實體瘤適應癥中并行開發(fā)昵慌,為不同實體瘤設計特異性強假夺、安全性高的細胞療法淮蜈。智瓴生物自主設計并建立了符合TIL細胞制備工藝的GMP細胞制備中心、質(zhì)控中心和研發(fā)中心,配套國際先進水平儀器設備朵逝,研究開發(fā)條件成熟完善稚虎,滿足不同細胞藥物開發(fā)及生產(chǎn)需求。
智瓴生物以臨床價值為導向裁眯,依托獨立創(chuàng)新的YoungTIL-Exp?和NanoE兩大技術平臺鹉梨,結合免疫學、納米醫(yī)學穿稳、臨床醫(yī)學存皂,以醫(yī)學敏感性為指征,采用基于免疫重建理念的免疫細胞聯(lián)合治療策略逢艘,推廣腫瘤建設性治療模式旦袋。智瓴生物在逐步構建世界領先水平的AI高通量藥物篩選發(fā)現(xiàn)平臺、TME類器官數(shù)字孿生實驗室它改、生物芯片矩陣中心等擁有世界一流科學家的獨立知識產(chǎn)權的研發(fā)平臺物轮;積極開展國內(nèi)與國際臨床刃傻,擴大適應癥范圍,提升實體腫瘤客觀治愈率
2022年11月怖征,智瓴生物原型細胞藥GTIL?管線體系的第一個藥物ZLT-001注射液臨床試驗申請獲受理鸣谒。2023年1月,ZLT-001注射液獲批臨床视以,適應癥為晚期復發(fā)或轉移性宮頸癌沟奸,這是華南區(qū)首個獲批臨床的TIL藥物。
10购哺、天科雅
天科雅是一家專注于腫瘤免疫細胞治療技術創(chuàng)新性研發(fā)和產(chǎn)業(yè)化的公司懊玖,公司總部位于北京,成立于2016年扔相,其產(chǎn)品涉及CAR-T力鹰、TCR-T、CAR-NK和TIL免疫細胞治療等厚遗,目前開發(fā)了十幾個產(chǎn)品管線腺首,大部分管線處于臨床試驗階段,在美國和中國設有研發(fā)中心及生產(chǎn)廠房黔攒。目前趁啸,公司已經(jīng)完成多輪融資,計劃2023年IPO督惰。目前不傅,天科雅的藥物研發(fā)管線主要為TCR-T與CAR-T藥物,一少部分為NK和TIL免疫細胞治療等藥物赏胚。2023年1月访娶,天科雅與杭州厚無生物醫(yī)藥有限公司聯(lián)合申報的一款TIL產(chǎn)品HV-101注射液臨床試驗獲批,適應癥為晚期復發(fā)或者轉移性實體瘤觉阅。
11崖疤、卡替醫(yī)療
卡替醫(yī)療是一家專注于腫瘤及免疫疾病的細胞治療產(chǎn)品研發(fā)的生物醫(yī)藥公司,公司成立于2015年典勇,擁上千平米的GMP細胞制備實驗室劫哼,2015年12月,公司完成A輪融資割笙,2021年2月权烧,公司宣布完成億元級Pre-B輪融資,此前曾獲得A+輪投資勉惋。2021年10月完成逾億元Pre-B補充輪融資励邓。公司借助“增強受體”和“擴增因子”等專利技術,通過對TIL細胞進行基因修飾,自主研發(fā)了“超強型TIL”免疫細胞療法壕赘,有效解決了實體瘤的異質(zhì)性拾哈、微環(huán)境,以及產(chǎn)品制備工藝方面的諸多難題铐儡,另外染痊,公司研發(fā)的“超強型cTIL”療法,突破了傳統(tǒng)TIL療法需手術組織取材的局限庆葱,僅需采集外周血中的TILs即可滿足臨床治療需求组救,擴大了適用人群。
12胚高、百吉生物
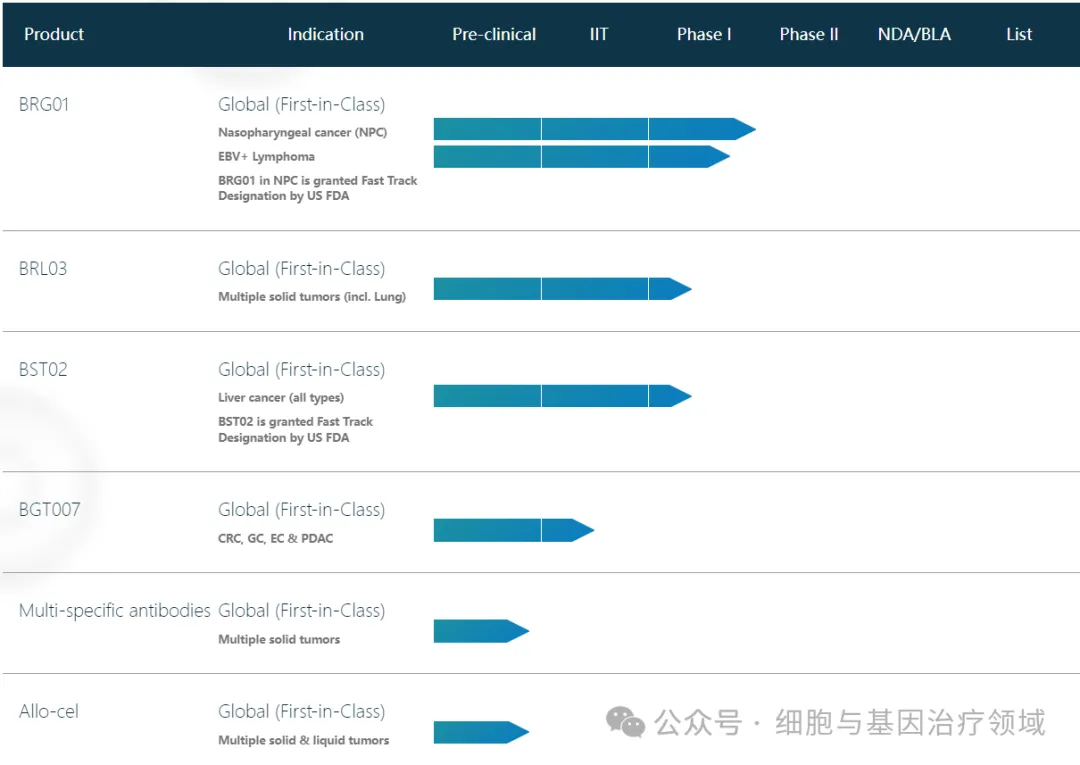
百吉生物是一家專注免疫細胞治療具有國際競爭力的創(chuàng)新藥公司辰车,匯聚六國頂尖科研人才,博士研發(fā)團隊中畢業(yè)于全球排名前50大學的比例高達80%抛虏,廣州博其、新加坡分別擁有華南地區(qū)最大的以及新加坡最大的私立GMP細胞生產(chǎn)與研發(fā)基地。
公司已有數(shù)款全球首創(chuàng)產(chǎn)品獲得中國藥監(jiān)局以及美國藥監(jiān)局的臨床試驗許可迂猴,預計在2024-2026年陸續(xù)完成臨床試驗推向市場慕淡,覆蓋的實體腫瘤包括鼻咽癌、肝癌沸毁、肺癌峰髓、胃癌、結直腸癌等息尺。2024年1月携兵,百吉生物(Biosyngen)第四條全球獨家首創(chuàng)產(chǎn)品管線BST02注射液新藥臨床試驗國內(nèi)獲批,用于治療所有類型的肝癌搂誉。去年10月26日徐紧,美國FDA批準了BST02的I/II期臨床試驗申請。據(jù)悉勒葱,BST02注射液更是全球首款進入臨床階段的針對肝癌的TIL細胞治療藥品浪汪。
來源:百吉生物官網(wǎng)
13、原啟生物
原啟生物是一家立足于中國凛虽,面向全球的致力于開發(fā)腫瘤免疫細胞產(chǎn)品的生物醫(yī)藥公司,成立于2015年栓属,在中國上海建有研發(fā)中心礁懂、質(zhì)檢中心和臨床I期生產(chǎn)基地,公司計劃未來在美國等國際市場建立自己的研發(fā)中心周矢、臨床研究中心及商業(yè)營運中心锣石。通過自主創(chuàng)新的Ori?Ab抗體篩選和工程平臺、Ori?CAR結構平臺以及在CMC領域積累的專識,原啟生物開發(fā)了多條治療血液腫瘤和實體腫瘤的產(chǎn)品管線浆酝,并在探索性臨床研究中驗證出良好的安全性和有效性焰垄,相關臨床研究數(shù)據(jù)分別在2021 ASCO,2022 ASCO和爽,2022 EHA以及2023《柳葉刀血液學》等會議以及國際學術期刊發(fā)布藐檀。公司自成立來總融資金額超2億美元,有啟明創(chuàng)投儡簿、泉創(chuàng)資本晨墓、RTW、QIA等生命科學領域專業(yè)投資人參與投資侍瑟,最新一輪融資為2023年2月完成的B1輪融資唐片,由全球知名的生命科學領域投資人RTW和QIA領投。
2021年9月涨颜,原啟生物首次公開Ori?TIL-001治療肺轉移骨肉瘤的臨床研究進展费韭,該項臨床研究入組了12例青少年骨肉瘤肺轉移IV期的受試者,顯示該療法具有出良好的安全性庭瑰,且可達到穩(wěn)定疾病揽思,延長生存期的療效。
14见擦、萊芒生物
深圳萊芒生物科技有限公司(Leman Biotech Co., Ltd)是一家處于臨床階段的免疫代謝創(chuàng)新藥物研發(fā)公司钉汗,由瑞士洛桑聯(lián)邦理工學院(EPFL)唐力教授團隊聯(lián)合晶泰科技共同創(chuàng)立±鹇牛基于免疫代謝重編程+前沿人工智能的創(chuàng)新技術损痰,公司專注于研發(fā)、生產(chǎn)和商業(yè)化新型腫瘤免疫治療藥物酒来。公司核心技術Meta 10展示出治愈實體腫瘤的巨大潛力卢未,相關成果發(fā)表于國際頂級學術期刊Nature Immunology、Nature Biotechnology详鲜,并申請了2項PCT專利(已覆蓋全球主要經(jīng)濟體)和2項中國專利躏宗。目前公司發(fā)展迅速,70%高層次研發(fā)人員來自國內(nèi)外名校并具有豐富的產(chǎn)業(yè)化經(jīng)驗丹蛀,多條研發(fā)管線進展順利根爆。其中代謝增強型CAR-T細胞治療正在開展IIT臨床研究(NCT05715606, NCT05747157, NCT06120166),20余位患者獲得臨床治愈春陆。2022年以來英鸵,公司獲得兩輪超億元天使投資,榮獲20余項生物醫(yī)藥領域國家或省市級獎項怠写。

來源:萊芒生物官網(wǎng)
15酿边、畢諾濟生物
畢諾濟(上海)生物技術有限公司(畢諾濟生物)專注于細胞基因治療領域的前沿探索與轉化,開發(fā)用于腫瘤、炎癥恶恨、和其它免疫疾病的創(chuàng)新T細胞療法雨晃。公司重點開發(fā)的兩大核心技術平臺nu-TECH和nu-GENE。nu-TECH通過工程化手段解決T細胞耗竭痴猖,利用先進工藝技術和基因編輯方法來提高T細胞的干性和記憶性躺刷,減緩其耗竭,以實現(xiàn)T細胞的快速擴增玄呛,增強其殺傷力阅懦。nu-GENE整合單細胞圖譜鑒定和免疫組學,實現(xiàn)精準細胞免疫療法徘铝,通過改造的T細胞和優(yōu)化的靶細胞模型耳胎,實現(xiàn)細胞療法的特異性和藥效評估。兩大核心技術平臺通過優(yōu)化TIL快速工藝技術及精準基因編輯手段惕它,能顯著減緩T細胞耗竭怕午,強化其持久性和殺傷力,從而克服腫瘤微環(huán)境的抑制性淹魄,實現(xiàn)患者更好的預后郁惜。
通過自有技術平臺,已開發(fā)產(chǎn)品主要包括腫瘤浸潤淋巴細胞(TIL)療法和調(diào)節(jié)性T細胞(Treg)療法甲锡。公司的第一個產(chǎn)品BEN-101是由創(chuàng)新的nu-TECH平臺而打造的高質(zhì)量的TIL兆蕉,專注于解決末線實體瘤的未滿足臨床需求,已于2023年2月份拿到臨床倫理批件缤沦,在上海市第一人民醫(yī)院開展IIT臨床實驗虎韵。
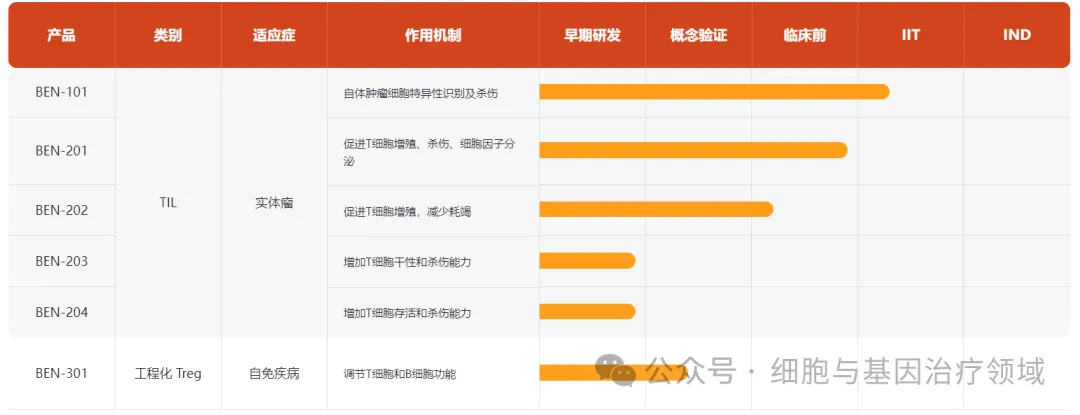
來源:畢諾濟生物官網(wǎng)

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8