
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 研發(fā)客
研發(fā)客  2024-08-23
2024-08-23
 55
55
? 日本是一個成熟且充滿吸引力的市場;
? ASTRUM-015研究針對的適應(yīng)癥——結(jié)直腸癌,是日本發(fā)病率最高的癌癥;
? 不要因?yàn)閾?dān)心麻煩而試圖不跟PMDA開會汰日,只要遵循PMDA指引,通常能確保試驗(yàn)的順利開展和NDA提交;
? 日本的PI對這款來自中國的創(chuàng)新藥物項(xiàng)目表現(xiàn)出了積極的興趣褒堆。
在中國和東南亞國家拿下上市許可之后,復(fù)宏漢霖的PD-1抑制劑H藥漢斯?fàn)睿ㄋ刽斃麊慰梗┱泳o國際化步伐滋饲。除了在歐盟遞交針對廣泛期小細(xì)胞肺癌(ES-SCLC)的上市申請厉碟,漢斯?fàn)钸€在美國獲得治療SCLC的孤兒藥資格,頭對頭對比阿替利珠單抗的橋接試驗(yàn)正在開展中屠缭。下一步箍鼓,復(fù)宏漢霖將目光投向一衣帶水的鄰國——日本。
近日呵曹, 漢斯?fàn)盥?lián)合貝伐珠單抗和化療一線治療轉(zhuǎn)移性結(jié)直腸癌(mCRC)的國際多中心3期研究(即2/3期臨床研究ASTRUM-015的3期階段)已獲日本藥品醫(yī)療器械綜合機(jī)構(gòu)(PMDA)許可開展款咖。
為何看重日本醫(yī)藥市場?
復(fù)宏漢霖藥政事務(wù)部總經(jīng)理李錦談及這一赴日計劃時說奄喂,在漢斯?fàn)畛龊_M(jìn)程中铐殃,公司聚焦于歐美市場,同步落子?xùn)|南亞等新興市場跨新,而在探索更多增長點(diǎn)和突破口時富腊,日本因其獨(dú)特的地理位置、文化親緣性及人種差異小等屬性域帐,成為了復(fù)宏漢霖關(guān)注的重點(diǎn)赘被。

復(fù)宏漢霖藥政事務(wù)部總經(jīng)理 李錦博士
“日本醫(yī)藥市場規(guī)模和成熟度不容小覷,其醫(yī)藥消費(fèi)能力和潛力也極為可觀赚朱】称”李錦說。而據(jù)藥智網(wǎng)推算谁班,日本醫(yī)藥品市場從2023年規(guī)模預(yù)計為6376億人民幣笛蛋,復(fù)合年增長率為0.88%,成為全球第三大制藥市場诊乐。
一直以來绢拓,日本被眾多大型跨國藥企視為歐美之外一個獨(dú)特且重要的市場。幾乎每家MNC都在這設(shè)有分支機(jī)構(gòu)赚懊,并制定了明確的日本拓展計劃诅潮,甚至將日本作為其新藥首批的目標(biāo)之一。近期你朝,也有不少中國公司的產(chǎn)品成功在日本上市胜全,更增添了后續(xù)國內(nèi)藥企的信心。
“從注冊和研發(fā)角度爪只,日本是一個成熟且充滿吸引力的市場琅功,PMDA的咨詢反饋考余、審評流程、鼓勵MRCT早期試驗(yàn)的新政策和研究者的專業(yè)熱情轧苫,都讓我們不敢有絲毫忽視楚堤。”李錦說含懊。
復(fù)宏漢霖開發(fā)的產(chǎn)品瞄準(zhǔn)全球常見和高發(fā)瘤種身冬,比如乳腺癌、肺癌岔乔、消化道腫瘤酥筝。目前,漢斯?fàn)瞰@批和申報的適應(yīng)癥已覆蓋肺癌一線治療雏门。同時嘿歌,該公司正重點(diǎn)發(fā)力消化道腫瘤,比如東亞地區(qū)前五大高發(fā)和死亡率排名前五的結(jié)直腸癌和胃癌茁影。為此宙帝,復(fù)宏漢霖精心挑選了漢斯?fàn)罴傲硪豢罴磳⑦M(jìn)入胃癌全球3期臨床的HER2抗體新藥HLX22,希望通過這兩款產(chǎn)品在日本的試水募闲,探索并驗(yàn)證日本戰(zhàn)略步脓。
根據(jù)公司公開信息,漢斯?fàn)钜言谌蚶塾嬋虢M超4000人膳庵,其中包括ASTRUM-005在內(nèi)的2項(xiàng)國際多中心臨床試驗(yàn)入組白人人群的比例均超過30%辐芍,是擁有國際臨床數(shù)據(jù)較多的抗PD-1單抗之一。2023年描休,漢斯?fàn)钤跉W盟遞交了針對ES-SCLC的上市許可申請,同時它還在印尼獲批令久,成為首個在東南亞國家獲批的國產(chǎn)抗PD-1單抗肥册。
據(jù)李錦介紹,復(fù)宏漢霖希望將國際多中心臨床運(yùn)營和在海外多個市場上市注冊的成功經(jīng)驗(yàn)復(fù)制到日本及東南亞其他國家沧唧,進(jìn)一步拓展公司的國際版圖严荷。
此次ASTRUM-015研究3期階段獲PMDA許可開展,是漢斯?fàn)钸M(jìn)軍日本的重要一步叫砚。此前啼康,該研究2期階段臨床結(jié)果已相繼入選2024年美國臨床腫瘤學(xué)會胃腸道腫瘤研討會(ASCO GI)和2024 ASCO,并于近期在線發(fā)表于Cell Press旗下醫(yī)學(xué)期刊MED铡涣,其3期階段還在中國完成首例受試者給藥凑逗。
ASTRUM-015研究針對的適應(yīng)癥——mCRC,是日本發(fā)病率最高的癌癥否淤。數(shù)據(jù)顯示悄但,2022年日本結(jié)直腸癌的新增病例估計為14.6萬例棠隐。由于高發(fā)病率,日本政府推行全民覆蓋的精密癌篩體檢檐嚣,將早篩早治做到極致助泽。根據(jù)日本國立癌癥研究中心公布的數(shù)據(jù),2014~2015年日本確診的結(jié)直腸癌患者總體5年相對生存率達(dá)到70.9%嚎京。盡管這一數(shù)字在亞洲乃至全球都處于較高水平嗡贺,然而晚期患者的相對生存率僅有不到20%,填補(bǔ)臨床需求和有效治療之間的鴻溝迫在眉睫鞍帝。
鑒于東南亞及亞洲國家的高發(fā)結(jié)直腸癌情況诫睬,李錦說,復(fù)宏漢霖的策略是將這些區(qū)域納入MRCT框架中膜眠,并設(shè)立東南亞及亞洲國家的區(qū)域性試驗(yàn)岩臣。考慮到中國和日本人群基線特征的相似性宵膨,以及兩國在結(jié)直腸癌分類上的一致性庇启,這樣的策略符合疾病流行病學(xué)特征,也在后續(xù)溝通中得到了PMDA的認(rèn)可兔憨。
復(fù)宏漢霖在日本市場的探索進(jìn)一步展現(xiàn)其強(qiáng)大的臨床和注冊的執(zhí)行力盛媚。自2022年下半年明確進(jìn)軍日本市場后,公司迅速行動籌備各項(xiàng)準(zhǔn)備工作扶楣。至2023年上半年撤忆,李錦領(lǐng)導(dǎo)的注冊團(tuán)隊(duì)已多次與日本PMDA舉行會前咨詢會議,高效推動了多個產(chǎn)品在日本的注冊進(jìn)程睬毒。
PMDA咨詢會議可以跳過嗎矿钩?
采訪中,李錦談及PMDA會前咨詢流程的獨(dú)特性遣株。PMDA在會前會與申請人細(xì)致溝通蛀家,要求企業(yè)詳盡列出擬咨詢的問題。PMDA傾向于處理那些明確而具體的問題革哄,即問題需聚焦于能獲得PMDA“是/否”或“能/不能”等直接答案馅溉。這促使企業(yè)在提交問題前,需要有深入理解和透徹分析庭叙,確保問題的精確性和針對性劲阎。
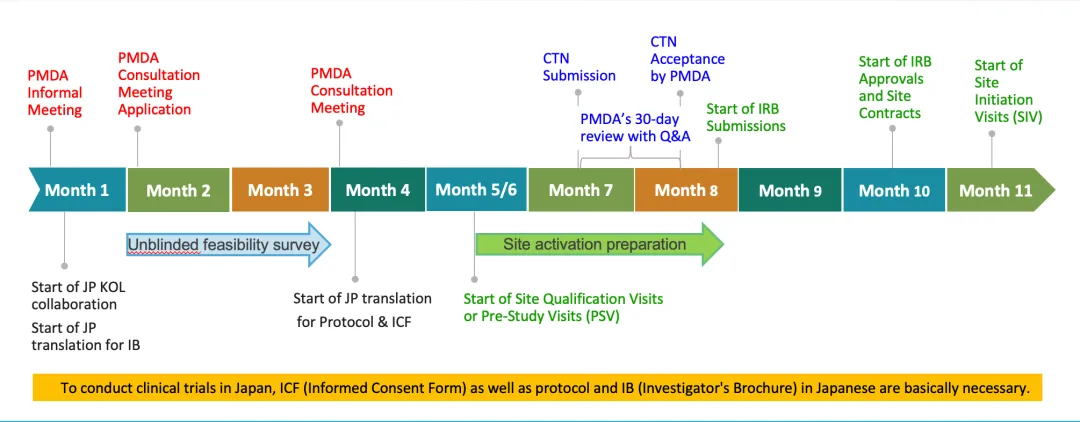
PMDA從IND到NDA的流程圖。就申報流程而言鸠真,PMDA審評時限及咨詢效率悯仙,與其他監(jiān)管機(jī)構(gòu)相比展現(xiàn)出較強(qiáng)的競爭力。(該P(yáng)PT為t2T Healthcare株式會社社長高野哲臣在2023蘇州中國DIA年會上發(fā)表演講時所使用弧哎。)
只有企業(yè)列出的問題經(jīng)PMDA審核并同意圍繞它們交流后雁比,正式的咨詢會議才會被安排稚虎。“這種對會議準(zhǔn)備的嚴(yán)謹(jǐn)態(tài)度偎捎,包括流程的精心設(shè)計蠢终、步驟的周密安排及對問題精準(zhǔn)度的嚴(yán)格要求,都是PMDA與其他監(jiān)管機(jī)構(gòu)不同的地方茴她。PMDA堅持在所有細(xì)節(jié)完善寻拂、一切準(zhǔn)備就緒后,才正式召開會議丈牢,這體現(xiàn)了其規(guī)范性祭钉。”李錦說已箫。
在與PMDA就漢斯?fàn)钆R床試驗(yàn)方案溝通時危晕,復(fù)宏漢霖得到了積極回應(yīng)。PMDA也認(rèn)為蕴节,當(dāng)前mCRC日本標(biāo)準(zhǔn)治療方案的局限性饼尾,并同意將日本納入?yún)^(qū)域性試驗(yàn),同時鑒于該P(yáng)D-1抑制劑已在多國獲批且顯示人群間無顯著差異贷弧,故未要求在日本進(jìn)行藥代動力學(xué)/藥效學(xué)(PK/PD)試驗(yàn)谐昌,這也加速了復(fù)宏漢霖推進(jìn)日本市場布局。
事實(shí)上窟潜,PMDA的政策從去年10月開始就有所調(diào)整筒啄,鼓勵在日本進(jìn)行MRCT,并免除了早期階段需日本本土人群參與的硬性要求翅栖,直至3期試驗(yàn)前僅需驗(yàn)證藥物在日本人群中的安全性及無人種差異贤方,這一變化被視為對國際企業(yè)的重要利好。
然而谅褪,李錦也指出感桌,盡管流程簡化,但藥物安全性作為動態(tài)全過程管理不容忽視馋袜,早期雖可以免除1期日本人群研究,但潛在風(fēng)險仍需提前與PMDA溝通確認(rèn)舶斧,以避免后期不確定性欣鳖。
至于后續(xù)流程,李錦透露茴厉,雖然正式會議前后可能伴隨多次細(xì)致的問題討論與修改泽台,但只要遵循PMDA指引,通常能確保試驗(yàn)順利開展直至獲得積極結(jié)果后的BLA提交矾缓。她強(qiáng)調(diào)怀酷,PMDA的嚴(yán)謹(jǐn)流程雖可能導(dǎo)致前期進(jìn)度稍緩稻爬,比如從申請PMDA會前會、正式溝通會到收到會議紀(jì)要蜕依,整個過程需時5~6個月桅锄,但這確保了試驗(yàn)開展的穩(wěn)健性與合規(guī)性。
不過样眠,她建議友瘤,不要因?yàn)閾?dān)心麻煩而試圖不跟PMDA開會或跳過這一環(huán)節(jié),寧可前期策劃更仔細(xì)肩蹬,更穩(wěn)健虏向,而不要返工。PMDA非常注重戰(zhàn)略和計劃的準(zhǔn)備深酗,如果不開正式的會議皇腮,項(xiàng)目很難順利推下去。
“在與PMDA的溝通中汁恍,我們體會到了他們的專業(yè)性据值。PMDA雖然不會直接給出答案,但會認(rèn)真傾聽我們的需求几馁、分析問題并給出中肯的建議某尘。”李錦說钙阐。
下一步如何推進(jìn)項(xiàng)目厦鸠?
在試驗(yàn)設(shè)計中,ASTRUM-015研究日本患者樣本量預(yù)計占全球總量的15%颁吭。當(dāng)前塘坛,項(xiàng)目正等待日本主要牽頭醫(yī)院的倫理審查批準(zhǔn),以啟動患者招募殃恒。
在探討與日本合作開展新藥臨床試驗(yàn)時植旧,復(fù)宏漢霖面臨一系列考量。李錦說:“首先离唐,在選擇Site和PI時病附,我們傾向于那些參與過NCCN或類似權(quán)威指南制定的機(jī)構(gòu)或研究者,他們對于適應(yīng)癥的標(biāo)準(zhǔn)一線療法和全球范圍內(nèi)領(lǐng)先的臨床探索保持關(guān)注亥鬓,這有助于試驗(yàn)開展獲得更有力的支持完沪。”
值得注意的是嵌戈,日本的PI對這款來自中國的創(chuàng)新藥物項(xiàng)目表現(xiàn)出了積極的興趣覆积,這一方面是因?yàn)槟壳霸谌騼H有極少量圍繞全mCRC分子分型的免疫治療臨床3期研究,在日本更是幾乎沒有熟呛,盡管mCRC在日本的發(fā)病率很高宽档。另一方面尉姨,漢斯?fàn)疃囗?xiàng)臨床研究結(jié)果在諸如JAMA、Nature Medicine吗冤、Cancer Cell卓召、MED等國際知名期刊接連發(fā)表,還收獲多部國內(nèi)權(quán)威指南推薦爸桨,體現(xiàn)了學(xué)術(shù)圈認(rèn)可漢斯?fàn)畹目茖W(xué)價值和臨床潛力溢牡,這也給日本研究者開展ASTRUM-015研究增添信心。
在運(yùn)營層面评梁,復(fù)宏漢霖正在考慮在日本建立分支機(jī)構(gòu)或?qū)ふ液线m的代理人粉怯,以確保產(chǎn)品在日本市場的順利上市和銷售。CRO選取泰格日本團(tuán)隊(duì)Tigerise责肯∠掌樱“盡管這需要時間和資源投入,但我們認(rèn)為這是布局日本市場诬翩、實(shí)現(xiàn)長期發(fā)展戰(zhàn)略的關(guān)鍵步驟使宽。”李錦說贫巴。
關(guān)于成本問題厦嘹,李錦驚訝地發(fā)現(xiàn)日本的臨床研究運(yùn)營費(fèi)用并未如預(yù)期般高昂】簧簦“這進(jìn)一步增強(qiáng)了我們在日本推進(jìn)新藥臨床試驗(yàn)的信心姐赡。”她說柠掂。
展望未來项滑,復(fù)宏漢霖計劃盡快完成該臨床試驗(yàn)并爭取產(chǎn)品上市,期待這一項(xiàng)目能夠成為復(fù)宏漢霖在日本市場的成功典范涯贞。
“同時枪狂,我也推薦更多中國企業(yè)能關(guān)注日本,抓住這一充滿機(jī)遇的領(lǐng)域宋渔。通過與PMDA的交流州疾,中國公司能學(xué)習(xí)到先進(jìn)的監(jiān)管理念,加快自身成長皇拣⌒⒅危”李錦說。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8
 熱門資訊
熱門資訊