
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-08-26
2024-08-26
 400
400
今天,百時美施貴寶(Bristol Myers Squibb)宣布云茸,美國FDA已接受其重磅PD-1抑制劑Opdivo(nivolumab)與CTLA-4靶向抗體Yervoy(ipilimumab)聯合療法的補充生物制品許可申請(sBLA)翻萨,作為不可切除性肝細胞癌(HCC)成人患者的潛在一線治療方案渠欺。臨床3期試驗結果顯示习环,與活性對照藥物相比轴踱,Opdivo聯合Yervoy可顯著改善患者的總生存期(OS)汤踏,且聯合療法組患者的客觀緩解率(ORR)是對照組的近3倍泥从。該申請的PDUFA日期為2025年4月21日句占。
肝癌是全球第三大癌癥死亡原因。HCC是最常見的原發(fā)性肝癌類型躯嫉,占所有肝癌的90%纱烘。HCC通常在晚期才被診斷出來,此時有效的療法有限和敬,并且患者通常預后不佳凹炸。高達70%的患者在五年內會復發(fā)戏阅,尤其是那些在手術后仍被認為具有高風險的患者。
此次申請主要是基于3期CheckMate-9DW研究的結果运诺。CheckMate-9DW是一項3期隨機做法、開放標簽試驗,評估Opdivo聯合Yervoy與研究者選擇的索拉非尼(sorafenib)或樂伐替尼(lenvatinib)單藥治療相較幢垮,用以治療既往未接受過全身治療的晚期HCC患者的療效與安全性反饲。共有約668例患者入組,該試驗的主要終點是總生存期邓刻,關鍵次要終點包括客觀緩解率和癥狀惡化的時間堵闪。
在中位隨訪期約為35.2個月期間,Opdivo聯合Yervoy治療顯示:
在臨床與統(tǒng)計學上顯著延長主要終點OS锦是。接受Opdivo加Yervoy聯合療法患者的中位OS為23.7個月(95% CI:18.8–29.4)涤玷,而接受活性對照藥物治療患者的中位OS為20.6個月(95% CI:17.5–22.5),風險比為0.79(0.65–0.96漓琢;p=0.018)称几。總生存期獲益在各患者亞組中大致一致。
在臨床與統(tǒng)計學上顯著改善關鍵次要終點ORR稿施,接受Opdivo加Yervoy聯合療法患者的ORR為36%(95% CI:31-42)疫稿,而接受活性對照藥物治療患者的ORR為13%(95% CI:10-17)。
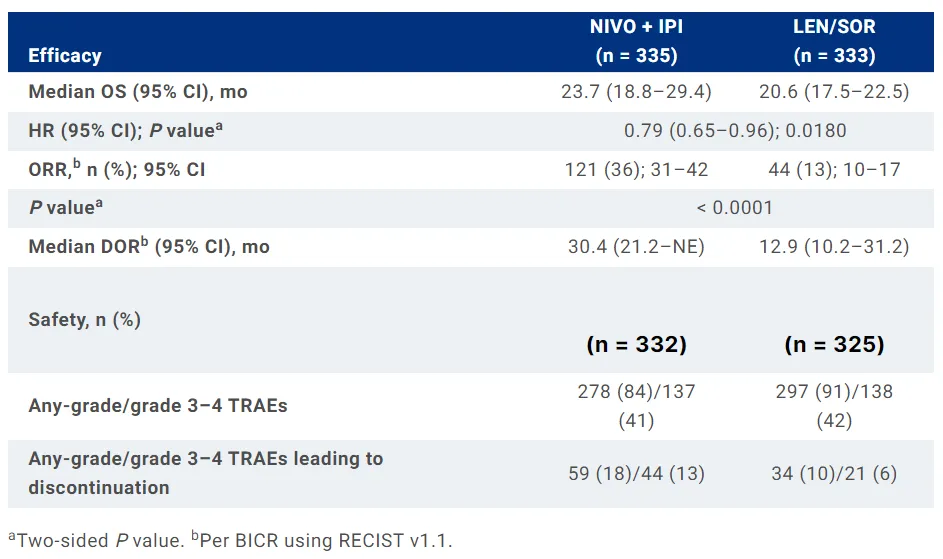
▲CheckMate-9DW試驗的療效結果摘要(圖片來源:參考資料[3])
Opdivo加Yervoy聯合療法組的完全緩解(CR)率更高鹃两,達7%遗座,而活性對照藥物組患者的CR僅為2%。此外俊扳,患者展現持久緩解途蒋。在達成緩解的患者中,Opdivo加Yervoy聯合療法組的中位緩解持續(xù)時間為30.4個月(95% CI:21.2-NE)馋记,而活性對照藥物組的中位緩解持續(xù)時間為12.9個月(95% CI:10.2-31.2)碎绎。
與活性對照藥物相比,Opdivo加Yervoy可顯著降低患者癥狀惡化的風險達24%(HR:0.76抗果,95% CI:0.62-0.93;p=0.0059)奸晴。
Opdivo加Yervoy組合療法的安全性與之前報告的數據一致冤馏,可通過既定方案進行控制。84%的Opdivo加Yervoy組患者報告了任何級別的治療相關不良事件(TRAE)寄啼,此數值在活性對照藥物組患者為91%逮光。
Opdivo是一種PD-1免疫檢查點抑制劑,旨在幫助恢復抗腫瘤免疫反應诬簇,利用人體自身的免疫系統(tǒng)來對抗癌癥蔬澜。Yervoy則靶向抑制CTLA-4人薯。CTLA-4抗體通過增強T細胞活性來提高腫瘤殺傷能力。該產品已于2011年獲得美國FDA批準治療晚期黑色素瘤阶糖,是全球首個獲批上市的CTLA-4抗體藥物吸辑。Opdivo和Yervoy的組合療法在過去已被批準為晚期HCC患者的二線治療方案。
近年來秃练,免疫療法逐漸成為肝癌患者的治療新方向串飘。2022年10月,阿斯利康(AstraZeneca)的抗CTLA-4抗體Imjudo(tremelimumab)獲得美國FDA批準雁痪,與抗PD-L1抗體Imfinzi(durvalumab)聯用钳砰,治療不可切除的HCC患者。今年1月猴襟,阿斯利康的Imfinzi與動脈化療栓塞(TACE)和貝伐珠單抗(bevacizumab)聯用许话,在治療適合栓塞治療HCC患者的3期臨床試驗中達到主要終點。組合療法組的無進展生存期(PFS)為15個月曼庆,而只接受TACE療法的對照組PFS為8.2個月稍途,將PFS延長接近1倍。類似地睛竣,羅氏(Roche)在去年1月宣布其抗PD-L1抗體Tecentriq(atezolizumab)與貝伐珠單抗聯用晰房,在3期臨床試驗的中期分析達到主要終點,可作為輔助療法顯著改善早期HCC患者在接受手術治療后的無復發(fā)生存期(RFS)射沟。根據新聞稿殊者,這是首項顯示免疫療法組合能夠降低早期HCC患者復發(fā)風險的臨床3期試驗。
除了免疫檢查點抑制劑验夯,新興的肝癌免疫治療還包括腫瘤浸潤淋巴細胞(TIL)療法猖吴。百吉生物(Biosyngen)所開發(fā)的BST02注射液是一款從患者自身TIL中擴增所得到的T細胞治療產品,屬于過繼性免疫細胞治療技術挥转。該療法的1/2期臨床試驗申請在去年10月獲得美國FDA批準海蔽,用于治療所有類型的肝癌。新聞稿指出绑谣,這是全球首款進入臨床開發(fā)階段的肝癌TIL療法党窜。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 106
106

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 110
110

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 124
124