
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 研發(fā)客
研發(fā)客  2024-08-26
2024-08-26
 96
96
? 許多以上市為目的的臨床研究結(jié)果并未發(fā)布鞠撑。
? 充分盯捌、可靠的試驗數(shù)據(jù)與醫(yī)生的臨床用藥決策緊密相關(guān)队淳。
? 臨床研究發(fā)起方在公示平臺信息登記的及時性和完善性需進(jìn)一步加強(qiáng)轩缤。
? 數(shù)據(jù)公開必須與數(shù)據(jù)保護(hù)制度相結(jié)合概给。
藥物臨床試驗數(shù)據(jù)是否需要充分披露渔肩?這個被反復(fù)討論的敏感話題逼友,一直沒有實質(zhì)性推進(jìn)呀闻。就此化借,研發(fā)客從臨床端切入,調(diào)研了來自全國多個省市三級醫(yī)院的21位副主任/主任醫(yī)師捡多。
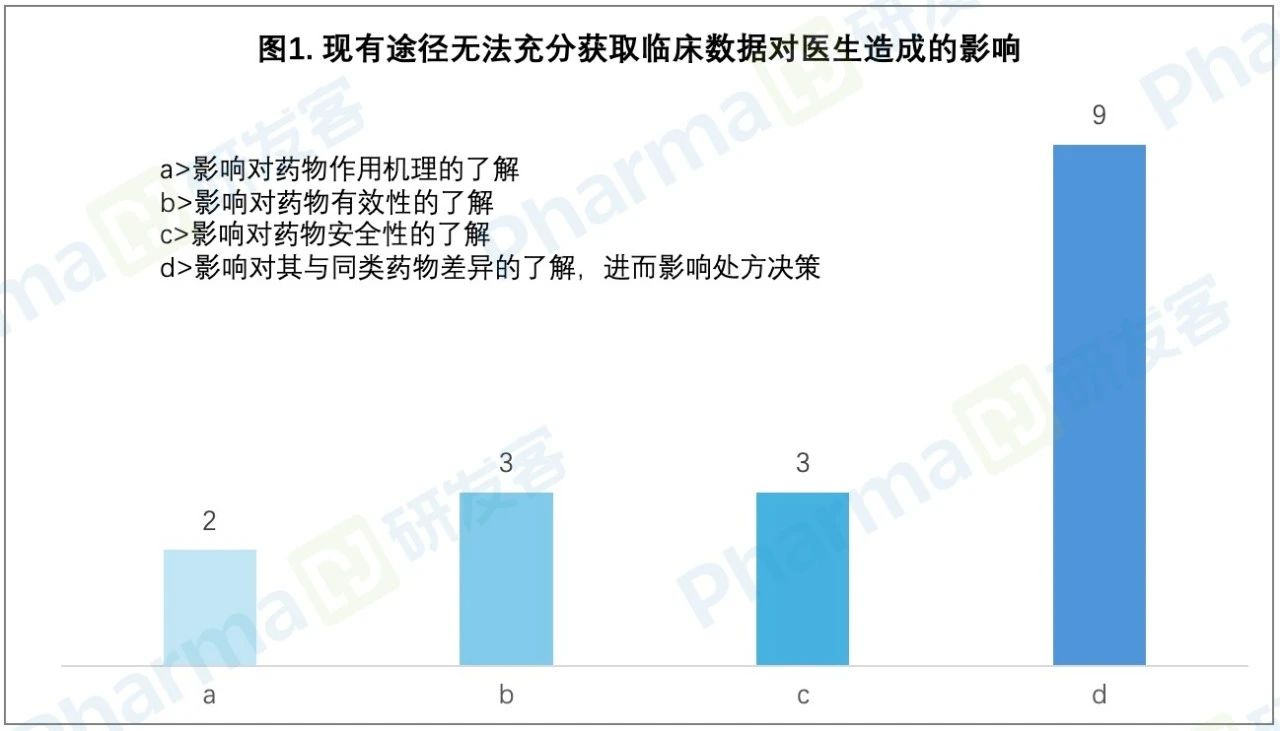
調(diào)研結(jié)果顯示蓖康,其中有9位醫(yī)生反映目前獲取藥物臨床試驗數(shù)據(jù)的途徑不能滿足工作需求,難以充分了解同類藥物的差異垒手,進(jìn)而影響到處方?jīng)Q策蒜焊。受到影響的具體場景還包括:不能全面及時充分地了解藥物品性倒信、藥物選擇不精準(zhǔn)、不能預(yù)防和有效管理不良反應(yīng)泳梆、不能找到最合適的病人浪費醫(yī)療資源鳖悠、超適應(yīng)癥用藥導(dǎo)致嚴(yán)重后果等。
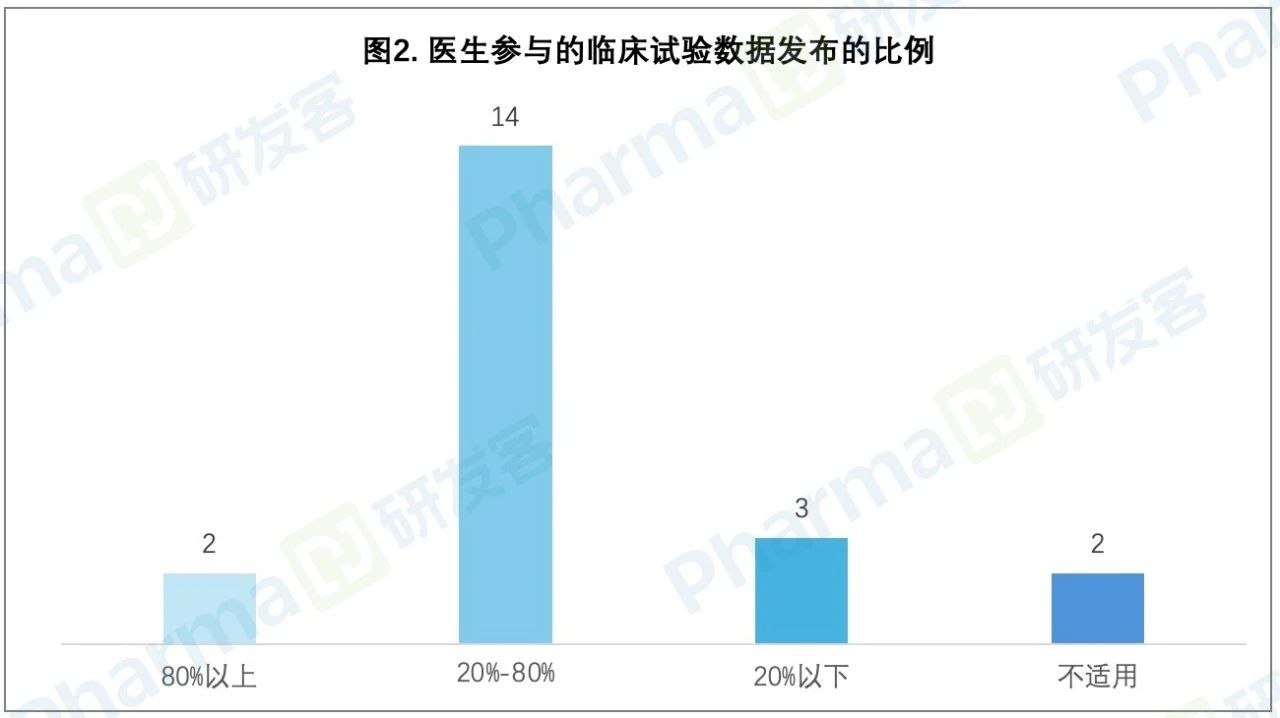
在21位醫(yī)生參與的企業(yè)申辦的臨床試驗或者研究者發(fā)起的試驗中捣睬,試驗數(shù)據(jù)發(fā)布比例在80%以上的僅有2位血洞,發(fā)布比例在20%~80%的有14位,發(fā)布比例在20%以下的有3位克蝶。這一定程度上反映了還有許多以上市為目的的臨床研究結(jié)果并未發(fā)布僻携。
調(diào)研發(fā)現(xiàn)一:缺少法律強(qiáng)制性
獲得研究數(shù)據(jù)的渠道通常包括臨床試驗數(shù)據(jù)庫、審評報告搔肉、學(xué)術(shù)發(fā)表(期刊和會議)疹返、公司財報、企業(yè)宣講蓉止、同行交流等律跺。其中,國家的藥物臨床試驗數(shù)據(jù)登記與公示平臺溶绢,成為臨床試驗數(shù)據(jù)查詢的主要渠道刚肠。
盡管藥物臨床試驗登記與信息公示平臺的建立對于保障公眾知情權(quán)、促進(jìn)信息共享亦弛、充分整合珍貴的試驗證據(jù)等均具有重要意義冒晰,但從實際使用上來看,仍存在一定的局限性竟块。

楊悅
“通過該平臺登記臨床試驗數(shù)據(jù)在正常申報注冊程序中沒有問題壶运,但目前該平臺主要靠藥企和研究者申報的自覺性,不具有法律強(qiáng)制性浪秘,這可能導(dǎo)致許多臨床試驗數(shù)據(jù)未公開或公開不充分蒋情。”清華大學(xué)藥學(xué)院藥品監(jiān)管科學(xué)研究院院長楊悅教授表示耸携。
此外棵癣,即便臨床試驗結(jié)果在該平臺登記上傳,公眾也并不一定能查看到夺衍。在2020年發(fā)布的《藥物臨床試驗登記填寫指南中》狈谊,臨床試驗結(jié)果摘要在小標(biāo)題中標(biāo)注為公示項,而內(nèi)文又著重提到附件結(jié)果摘要和備注說明僅用于監(jiān)管目的沟沙,為非公示項河劝。

只有已公示的內(nèi)容,公眾才可查詢和下載。這是否意味著該部分內(nèi)容公示與否是經(jīng)過選擇的赎瞎?
“我們有時也只能看到部分研究結(jié)果燕紊,或只是登記了研究的基礎(chǔ)信息,并沒有階段性的更新進(jìn)展癣吝±竽”廈門大學(xué)附屬翔安醫(yī)院藥物臨床試驗機(jī)構(gòu)辦公室主任康欣梅表示。

康欣梅
在康欣梅的印象中体涡,前幾年有許多臨床研究僅通過醫(yī)院的倫理審查就開始進(jìn)行噩五,往往在后期學(xué)術(shù)發(fā)表的時候,由于需要備案號才去公示平臺補(bǔ)充登記素牌。而有許多項目可能因為安全性、患者招募和資金等原因患漆,中途就終止了墓且。
“臨床研究發(fā)起方在公示平臺信息登記的及時性和完善性需進(jìn)一步加強(qiáng)∪未。”科倫藥物研究院臨床中心主任齊偉表示讲媚。
除了信息公示平臺,藥監(jiān)部門發(fā)布的審評報告焰究、學(xué)術(shù)期刊和會議也是醫(yī)生和醫(yī)藥研發(fā)人員重要的了解渠道裆操,這些渠道也存在不足之處÷剑“如CDE公開的創(chuàng)新藥審評報告里面包含部分臨床試驗結(jié)果的數(shù)據(jù)踪区,但目前公眾無法查到所有的創(chuàng)新藥審評報告〉踔瑁”楊悅表示缎岗。

史冬梅
“對于一些處在開發(fā)早期階段的創(chuàng)新性產(chǎn)品,其試驗結(jié)果出來后白粉,跨國研發(fā)型企業(yè)通常會選擇等到大型學(xué)術(shù)會議召開時公布传泊,或者在學(xué)術(shù)期刊上發(fā)表,但是這種‘慣例’同樣可能會造成數(shù)據(jù)公開的滯后性鸭巴,會影響行業(yè)第一時間解讀這些前沿產(chǎn)品的安全性和有效性眷细。”默克中國研發(fā)中心負(fù)責(zé)人史冬梅表示鹃祖。
調(diào)研發(fā)現(xiàn)二:雪藏陰性結(jié)果
研發(fā)客了解到溪椎,數(shù)據(jù)未公布的具體原因錯綜復(fù)雜,尤其是部分小型初創(chuàng)企業(yè)可能并不完全清楚數(shù)據(jù)登記與公示平臺的規(guī)定和要求恬口。
對于一些試驗的陰性結(jié)果池磁,小型初創(chuàng)企業(yè)可能存在信心不足,擔(dān)心對后續(xù)的開發(fā)工作產(chǎn)生影響葬籽,或者需要更多時間來分析試驗結(jié)果等情況捻尉。然而饮茬,陰性結(jié)果的不公開或者滯后公開,會影響藥物研發(fā)的相關(guān)工作候钟,可能損害臨床研究的整體可信度拉狸。
于醫(yī)生而言,“尤為關(guān)注一款產(chǎn)品既往研究中可能被雪藏的陰性結(jié)果和相關(guān)原始數(shù)據(jù)滤萝,但只能僅憑企業(yè)自發(fā)公示稿纺,并沒有完全可靠的了解渠道。即便參與了相關(guān)臨床研究碗履,也僅能了解自己所在醫(yī)院的數(shù)據(jù)谭驮,并不能看到全景。醫(yī)生與臨床用藥緊密相關(guān)勾萌,需要更大的權(quán)限查看到更多權(quán)威可靠的數(shù)據(jù)齐秕。”康欣梅表示仙蛉。

齊偉
齊偉認(rèn)為笋敞,在產(chǎn)品研發(fā)階段所獲得關(guān)鍵數(shù)據(jù)應(yīng)及時登記或更新,及時與監(jiān)管部門進(jìn)行溝通交流荠瘪。
“可以在關(guān)鍵階段獲得監(jiān)管部門的意見及建議夯巷,完善和優(yōu)化研究方案及策略,有利于降低臨床試驗風(fēng)險哀墓、提升臨床研究效率趁餐。”齊偉表示篮绰,“也有助于及時了解同治療領(lǐng)域澎怒,特別是同靶點產(chǎn)品的研發(fā)狀態(tài),以明確產(chǎn)品定位阶牍,提高后期臨床資源的使用效率喷面。”
此外走孽,隨著以患者為中心和聚焦臨床價值的新藥臨床試驗?zāi)J嚼砟畎l(fā)展惧辈,患者對藥物臨床試驗關(guān)注程度顯著提升。不斷探索和深化數(shù)據(jù)共享符合患者實際的利益需求伶葵。
調(diào)研發(fā)現(xiàn)三:注冊藥物數(shù)據(jù)未充分公開
研發(fā)客了解到承蠕,注冊藥物也無法做到充分披露數(shù)據(jù)。比如蕴续,生物類似藥充分公開數(shù)據(jù)的比例相對較低扳啃,部分改良型新藥的數(shù)據(jù)也沒有充分公開。特別是生物類似藥說明書中的數(shù)據(jù)披露,很大程度會依賴原研藥的數(shù)據(jù)危婚∪炱郏“受到數(shù)據(jù)保護(hù)授權(quán)的內(nèi)容可以相同,否則不應(yīng)該照搬照抄峦仲】恚”楊悅表示。
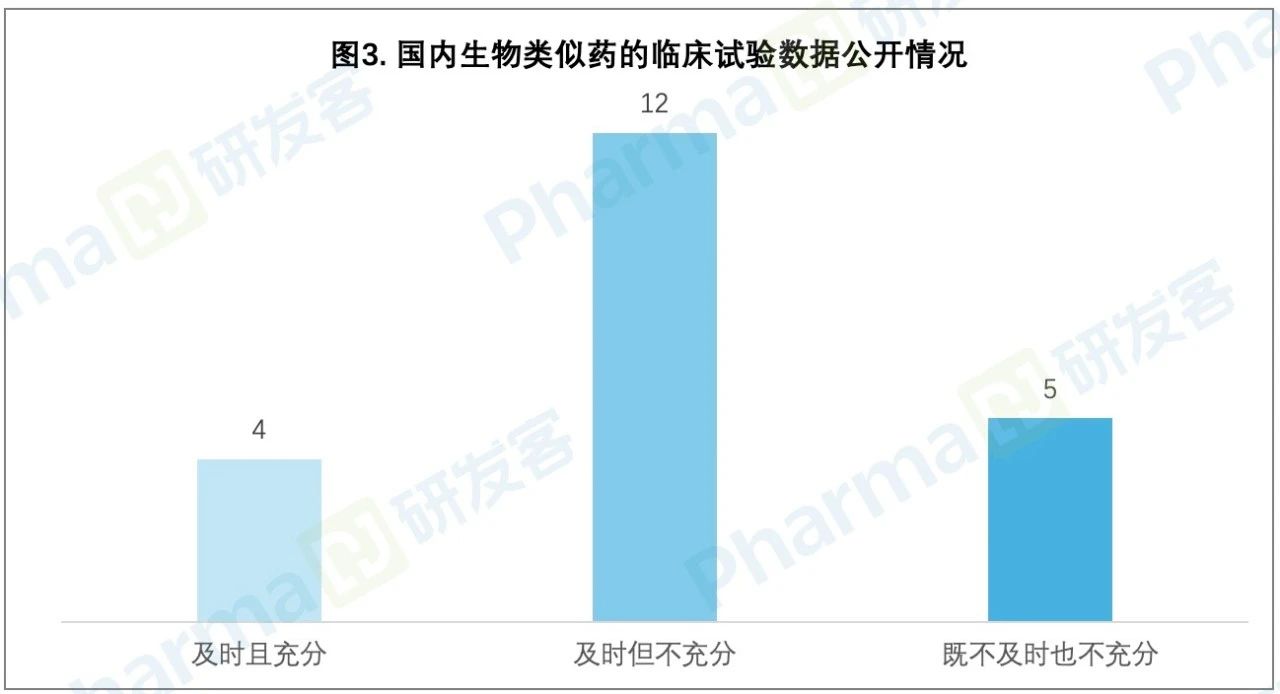
“在這樣的情況下质瘸,原研藥企難以充分了解監(jiān)管機(jī)構(gòu)的審評思路女饺。這對原研藥企了解生物類似藥是否與原研藥可比,改良型新藥是否較原研藥具有突出優(yōu)勢造成了影響磨爪,也會影響相應(yīng)醫(yī)療機(jī)構(gòu)和公眾獲得相關(guān)數(shù)據(jù)來支持醫(yī)療決策儒恋。” 史冬梅說黔漂。
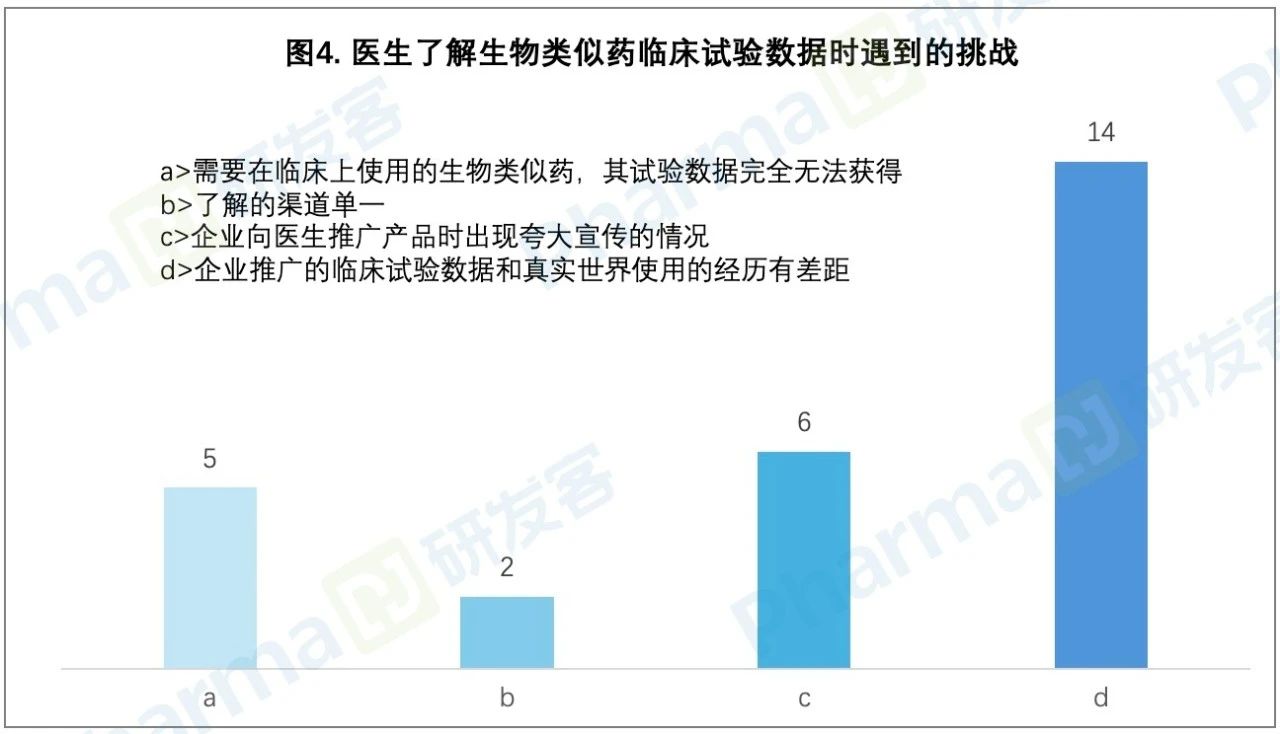
臨床醫(yī)生獲取試驗數(shù)據(jù)很多時候是通過企業(yè)宣傳推廣活動诫尽。在調(diào)研中,就有14位醫(yī)生反映瘟仿,企業(yè)推廣的生物類似藥臨床試驗數(shù)據(jù)和真實世界使用的經(jīng)驗有差距。6位醫(yī)生提到比勉,企業(yè)向醫(yī)生推廣產(chǎn)品時出現(xiàn)過夸大宣傳的情況劳较。
在醫(yī)學(xué)會議溝通中,經(jīng)常有醫(yī)生問詢某些生物類似藥究竟和原研藥有沒有差距的的情況浩聋,這表明醫(yī)生在用藥選擇观蜗、藥物替換等方面可能需要更多更可靠的臨床數(shù)據(jù)支持。
“這種情況的發(fā)生可能是因為生物類似藥的審評終點和臨床醫(yī)生關(guān)心的臨床終點之間存在一定差距衣洁。監(jiān)管的審評理念更看重生物相似度墓捻,臨床醫(yī)生則更看重生物類似藥能不能獲得和原研一樣的長期臨床獲益,尤其是在考慮外推適應(yīng)癥的時候坊夫∽┑冢”史冬梅表示。
不過蛾藐,隨著監(jiān)管層面對創(chuàng)新藥的鼓勵和支持力度不斷加大瘤希,其對生物類似藥的要求也在不斷提高,這種差距正在彌合保懈。提高數(shù)據(jù)公開的透明度可以讓業(yè)界更清晰的看到這種變化答艘。
至于現(xiàn)階段數(shù)據(jù)缺少透明度會不會造成嚴(yán)重的用藥安全問題,康欣梅則認(rèn)為不必太過擔(dān)憂锉辫。
因為在臨床研究過程中息体,GCP機(jī)構(gòu)倫理委員會有嚴(yán)格的監(jiān)管系統(tǒng),定期開分析會評估臨床研究的風(fēng)險和繼續(xù)推進(jìn)的價值。在藥品上市后的處方環(huán)節(jié)狗悔,醫(yī)生會參考治療指南做決策屉争。不同的藥品會進(jìn)行專家評級,依據(jù)已公開的數(shù)據(jù)進(jìn)行劃分削晦,綜合推薦級別太低的朴轰,醫(yī)生實際用藥時會慎重選擇或者不使用。
數(shù)據(jù)共享是國際新常態(tài)
臨床試驗數(shù)據(jù)公開的內(nèi)容包括注冊基本信息挥昵、結(jié)果摘要唆阿、臨床研究報告(CSR)和原始數(shù)據(jù)。它們的性質(zhì)和敏感性不同锈锤,因而數(shù)據(jù)公開需要循序漸進(jìn)驯鳖。參考國際經(jīng)驗,不斷探索和深化臨床試驗數(shù)據(jù)公開制度符合國際主流的實踐久免。
美國是世界上臨床試驗數(shù)據(jù)公開最早的國家浅辙。2007年,美國國會通過的《食品藥品管理修正案》(FDAAA)擴(kuò)展了臨床試驗數(shù)據(jù)公開的范圍阎姥。要求所有在美國開展的臨床試驗都要在Clinical Trials. gov進(jìn)行注冊记舆,須公開臨床試驗結(jié)果摘要,并制定了相應(yīng)的懲罰措施呼巴。
2016年9月泽腮,美國健康和福利部和NIH分別發(fā)布了臨床試驗注冊和結(jié)果信息提交終極規(guī)則和終極政策,對FDAAA的藥物臨床試驗數(shù)據(jù)公開的相關(guān)規(guī)定進(jìn)行了補(bǔ)充衣赶。
終極規(guī)則中規(guī)定诊赊,即便藥品未通過上市批準(zhǔn)的也要公開臨床試驗結(jié)果摘要,同時藥品不良反應(yīng)事件發(fā)生的時間表府瞄、搜集方法楚餐、全因死亡率、研究計劃蹂孽、統(tǒng)計分析方案等信息均要公開撇扯,且需每年更新。
終極政策進(jìn)一步將臨床試驗數(shù)據(jù)公開的范圍擴(kuò)展到包括1期臨床試驗數(shù)據(jù)酸穗,并且要求所有的研究項目在提交項目申請書時必須附加詳細(xì)的臨床試驗數(shù)據(jù)共享計劃窍蟹,或解釋為何這種數(shù)據(jù)不可共享。
歐盟于2014年通過了的(EU) No 536/2014號法規(guī)亭结,代替了此前的2001/20/EC號指令舟到,創(chuàng)建了單一的臨床試驗數(shù)據(jù)提交系統(tǒng),設(shè)置了統(tǒng)一的評估程序臀嘱、受試者保護(hù)和知情同意規(guī)則以及透明度要求章理,在整個歐盟/歐洲經(jīng)濟(jì)體境內(nèi)具有法律強(qiáng)制力所硅。
其中明確要求所有在歐盟境內(nèi)進(jìn)行的臨床試驗必須公開臨床試驗注冊信息,臨床試驗結(jié)果摘要和CSR信息杂蒙。CSR是藥品上市申請時提交給藥監(jiān)部門的文件的關(guān)鍵組成部分营稼,常被藥企視為商業(yè)機(jī)密。歐盟是全球唯一強(qiáng)制要求公開CSR信息的地區(qū)台腥。
(EU) No 536/2014號法規(guī)隨著EMA負(fù)責(zé)的臨床試驗信息系統(tǒng)(CTIS)搭建完成宏赘,于2022 年1月31日起正式開始施行。2023 年1月31日開始黎侈,CTIS 成為了提交歐盟法規(guī)要求的臨床試驗相關(guān)數(shù)據(jù)和信息的唯一入口察署。
除了歐美監(jiān)管機(jī)構(gòu)的要求,國際醫(yī)學(xué)期刊編輯委員會(ICMJE)曾提出峻汉,在其成員期刊發(fā)表臨床試驗報告需滿足一系列的考慮條件贴汪。其中包括,試驗注冊中須包含數(shù)據(jù)共享計劃休吠,相關(guān)試驗結(jié)果的稿件須包含數(shù)據(jù)共享聲明扳埂。
他們的一項提案反映了醫(yī)學(xué)界對臨床數(shù)據(jù)共享有更高的要求,包括探索如何合理的匿名分享單獨受試者的數(shù)據(jù)等瘤礁。
數(shù)據(jù)公開需配套保護(hù)制度
2020年7月阳懂,中國國家藥監(jiān)局發(fā)布了《藥物臨床試驗登記與信息公示管理規(guī)范(試行)》。從相關(guān)法規(guī)建立方面來看柜思,目前我國還停留在以公共機(jī)構(gòu)和政府部門推動為主的試驗注冊基本信息公開階段岩调。
對于如何繼續(xù)完善數(shù)據(jù)公開制度,楊悅認(rèn)為那辰,“數(shù)據(jù)公開非單一程序拳鹉,必須綜合制定政策玲侧“笕迹”最顯著的問題是數(shù)據(jù)公開涉及數(shù)據(jù)保密性,許多藥企將藥物臨床試驗數(shù)據(jù)視為高度機(jī)密符破,保存在公司的數(shù)據(jù)庫中出毁。
“數(shù)據(jù)公開可能意味著競爭對手的快速進(jìn)入,因此瞭阔,數(shù)據(jù)公開必須與數(shù)據(jù)保護(hù)制度相結(jié)合管剂。” 楊悅呼吁撵靴,國內(nèi)需要盡快公開正式文件崇槽,建立公開程序、公開內(nèi)容要求招砌,異議監(jiān)督機(jī)制以及違反規(guī)定的處理方式秆廉,并建立了數(shù)據(jù)保護(hù)制度策洒。
目前,美國和歐盟在制定數(shù)據(jù)公開制度的同時顽腾,已配套了相應(yīng)的數(shù)據(jù)保護(hù)制度近零,以解決藥企公開數(shù)據(jù)的后顧之憂。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8
 熱門資訊
熱門資訊