
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)曜
醫(yī)曜  2024-08-27
2024-08-27
 69
69
默沙東再次對中國創(chuàng)新藥資產(chǎn)出手车管,這一次瞄準(zhǔn)的不再是ADC藥物朋井,而是雙抗藥物囚灼。
8月9日淋渤,默沙東與同潤生物達成BD交易置蜀,以7億美元首付款的價格,拿下了CD3/CD19雙抗藥物CN201的全球權(quán)益胁住。這也是繼百利天恒之后筹吐,中國創(chuàng)新藥license-out第二高的首付款。
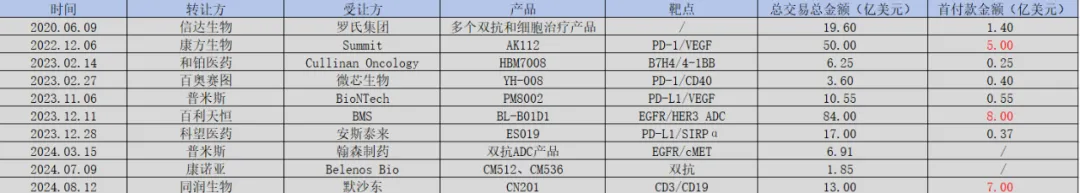
圖:中國雙抗管線BD一覽狮崩,來源:錦緞研究院
無論是之前百利天恒的BL-B01D1蛛勉,還是同潤生物的CN201,它們都是基于雙抗平臺的技術(shù)睦柴。算上2022年以5億美金首付款授權(quán)給Summit公司的AK112诽凌,雙抗平臺屢現(xiàn)大交易。
中國雙抗資產(chǎn)接連獲得MNC的青睞坦敌,這與前兩年MNC掃貨中國ADC如出一轍侣诵。中國雙抗管線,似乎開始接替ADC狱窘,成為全球大藥企最關(guān)注的前沿資產(chǎn)杜顺。
中國資產(chǎn)嶄露頭角
截至目前,全球共有15款雙抗藥物曾獲批上市愈饲,除首款雙抗產(chǎn)品Catumaxomab因市場表現(xiàn)不佳退市外卿才,其他14款產(chǎn)品均正常銷售。其中就包括康方生物獲批上市的兩款雙抗產(chǎn)品碴纺,中國創(chuàng)新藥公司已經(jīng)在全球雙抗賽道中占據(jù)一席之地本博。
2024年上半年,全球雙抗藥物市場銷售額超60億美元仇习,這還是在沒有考量很多2023年剛進入商業(yè)化階段潛力產(chǎn)品的情況下何大。也就是說,全球雙抗藥物市場規(guī)模將在2024年首次突破百億美元大關(guān)轰蜗。
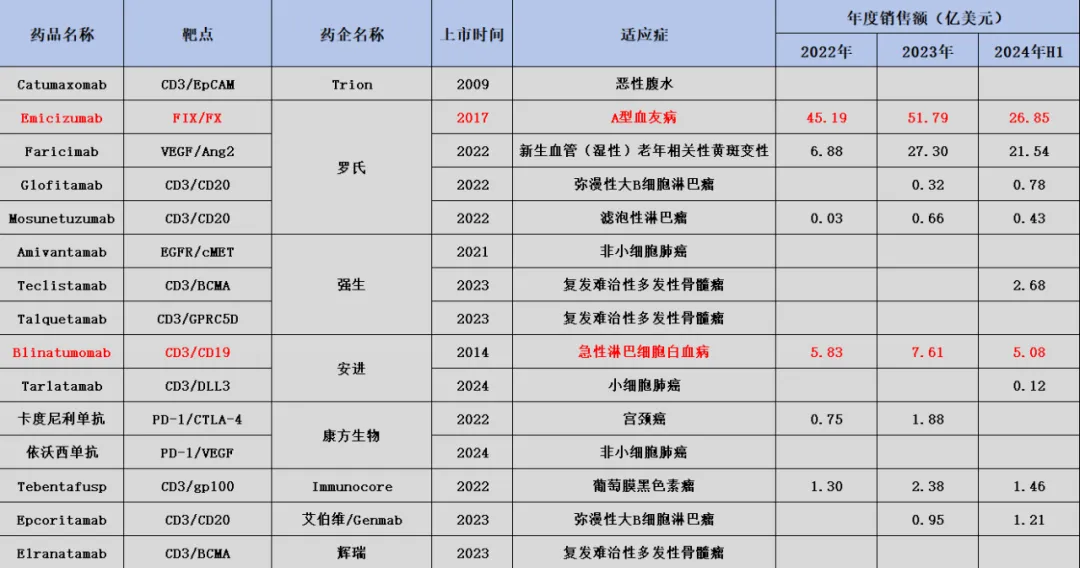
圖:全球已上市雙抗藥物一覽删摸,來源:錦緞研究院
復(fù)盤全球雙抗藥物發(fā)展之路,商業(yè)化進程并不平坦自葡。Catumaxomab作為全球首款上市的雙抗藥物攀誓,用于治療EpCAM陽性腫瘤引起的惡性腹水,率先在癌癥領(lǐng)域開啟了雙抗治療時代。然而坏榜,這款藥物售價高昂坯苹,副作用大,幾乎沒有市場摇天。2014年被停止銷售粹湃,最終在2017年6月正式退市。
受限于首款雙抗藥物孱弱的市場表現(xiàn)泉坐,動搖了藥企在雙抗賽道中的信心为鳄。至2020年之前,全球也僅有兩款雙抗藥物上市腕让,分別是2014年上市的Blinatumomab和2017年上市的Emicizumab孤钦。
不過這兩款上市的雙抗產(chǎn)品很快向市場證明,不是雙抗平臺不給力纯丸,而是Catumaxomab做得太差勁偏形。安進Blinatumomab營收一路增長,有望在今年突破10億美元大關(guān)觉鼻;羅氏Emicizumab營收更是突破50億美元俊扭,成為藥王級別的產(chǎn)品。
受這兩款雙抗產(chǎn)品帶動坠陈,藥企開始重新關(guān)注雙抗平臺贝泞,尤其是2022年更是成為雙抗藥物的爆發(fā)之年,僅當(dāng)年就有5款產(chǎn)品獲批上市二娄。此后肚浴,每年均有數(shù)款產(chǎn)品獲批,雙抗賽道真正進入了活躍期苇恤,就連早已退市的Catumaxomab淡碟,也在凌騰醫(yī)藥的臨床管線上又起死回,重啟了惡性腹水適應(yīng)癥研發(fā)供窝,還試圖向胃癌和膀胱癌適應(yīng)癥擴展一步。
值得一提的是,雙抗并非聚焦于癌癥技術(shù)平臺百涕,除了在癌癥領(lǐng)域表現(xiàn)出節(jié)節(jié)攀高的獲批數(shù)量外率满,在非癌領(lǐng)域市場顯得異常活躍斩角。2024年4月夷呐,Nature刊發(fā)了CD19/CD3雙抗Blinatumomab成功治療6名難治性類風(fēng)濕性關(guān)節(jié)炎患者的研究,為雙抗市場又打開了一扇大門伶丐。
默沙東巨額拿下CN201的原因悼做,除了看中CN201在惡性腫瘤患者中具有良好的治療前景外,更重要的是,早期臨床數(shù)據(jù)已有力證明CN201對于靶向并耗竭循環(huán)B細(xì)胞和組織B細(xì)胞具備潛力肛走,默沙東將研究其自免疾病新型可擴展療法的潛力漓雅。
雙抗藥物的路越走越寬,這也是為何MNC將被目光聚焦于中國雙抗資產(chǎn)的原因朽色。
康方生物:敢與藥王試比高
康方生物無疑是國內(nèi)雙抗龍頭邻吞,已獲批上市了卡度尼利和依沃西兩款雙抗藥物,且每款都有全球首發(fā)的頭銜葫男”Ю洌卡度尼利是全球首個腫瘤免疫治療雙抗新藥;依沃西是全球首個獲批上市的“腫瘤免疫+抗血管生成”機制的雙抗新藥腾誉。
基于雙抗藥物的放量徘层,康方生物業(yè)績也迎來了暴漲時代峻呕。2023年總收入為45.26億元利职,同比增長達440%,其中開坦尼(PD-1/CTLA-4)2023年銷售額為13.58億元瘦癌,占產(chǎn)品總銷售額83%撼盈,不僅抵消了其他產(chǎn)品51%的銷售額下滑,還為總銷售額帶來高達48%的正增長填丢。
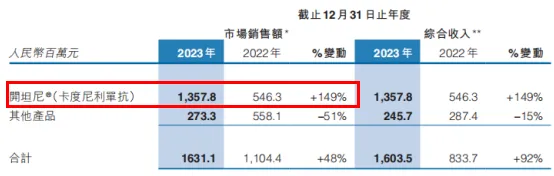
圖节讹,康方生物業(yè)績一覽,來源:康方生物
除商業(yè)化層面的成功外敞灸,康方生物亦是BD出海的大贏家之一漾肩。依沃西(PD-1/VEGF)還未上市,就在2022年底成功BD給了美股公司Summit区酷,僅首付款就高達5億美元掘鱼。也正是憑借依沃西的海外權(quán)益,Summit在美股中重新煥發(fā)活力丛幌,今年股價暴漲僅350%鸣拦。
今年5月底,康方生物發(fā)布依沃西Ⅲ期研究HARMONi-2臨床結(jié)果懒碍,再次將雙抗藥物推向高潮葱妒。數(shù)據(jù)顯示,依沃西單藥對比K藥單藥一線治療PD-L1表達陽性(PD-L1 TPS≥1%)的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)患者缝驳,達到無進展生存期(PFS)的主要研究終點连锯,獲決定性勝出陽性結(jié)果,成為全球首個且唯一在Ⅲ期單藥頭對頭臨床研究中證明療效顯著優(yōu)于K藥的藥物用狱。
隨即运怖,Summit在2024年6月與康方生物修訂許可協(xié)議,在原美國、加拿大驳规、歐洲及日本的許可地區(qū)基礎(chǔ)上肴敛,擴大至中美洲、南美洲吗购、中東及非洲地區(qū)医男。根據(jù)新修訂協(xié)議,康方生物可獲得7000萬美元首付款和里程碑款捻勉,以及銷售提成镀梭。
除兩款已經(jīng)上市的藥物外,康方生物還有多款潛在全球首創(chuàng)或同類最佳的雙抗藥物踱启,包括AK129(PD-1/LAG-3)报账、AK130(TIGIT/TGF-β)、AK131(PD-1/CD73)和AK132(Claudin18.2/CD47)庵恨。
百利天恒:玩出多抗新花樣
雙抗是腫瘤免疫的迭代產(chǎn)品迄帘,ADC是化療的迭代產(chǎn)品,而免疫治療+ADC是未來腫瘤聯(lián)合治療的核心方向之一诀烫。當(dāng)多數(shù)藥企還在嘗試開展雙抗與ADC聯(lián)合治療時榔况,百利天恒已在雙抗技術(shù)基礎(chǔ)上研發(fā)雙抗ADC,創(chuàng)下出海首付款之最的雙抗ADC藥物BL-B01D1勃拢,正是基于其自研的雙抗SI-B001研制而來钩榄。
2024年7月,BL-B01D1治療晚期實體瘤I期臨床研究結(jié)果在國際頂級雜志《柳葉刀腫瘤》發(fā)表后涛,在既往治療失敗的多種實體腫瘤患者中均表現(xiàn)出突破性療效武也,特別是在多藥耐藥后晚期肺癌和鼻咽癌上,客觀緩解率(ORR)是目前所有治療藥物中最高的口愁。
臨床數(shù)據(jù)顯示耿逐,在EGFR突變非小細(xì)胞肺癌患者中,BL-B01D1客觀緩解率(ORR)達52.5%爽咒,疾病控制率(DCR)達87.5%玩冷,而目前標(biāo)準(zhǔn)治療ORR為26.7%—48.1%;在EGFR野生型非小細(xì)胞肺癌患者中炼幔,BL-B01D1的ORR達30.6%秋茫,DCR達87.1%,而目前標(biāo)準(zhǔn)治療藥物有效率僅為16.6%乃秀;在鼻咽癌患者中肛著,BL-B01D1的ORR達37.8%,DCR達100%跺讯,而標(biāo)準(zhǔn)治療ORR為23.5%—37.6%枢贿。
據(jù)百利天恒官網(wǎng)顯示殉农,BL-B01D1針對非小細(xì)胞肺癌、小細(xì)胞肺癌局荚、鼻咽癌超凳、食管鱗癌、乳腺癌等多種癌癥開展了單藥及聯(lián)合用藥的11項臨床試驗耀态,其中轮傍,EGFR突變型非小細(xì)胞肺癌、EGFR野生型非小細(xì)胞肺癌首装、鼻咽癌抱典、食管鱗癌、三陰乳腺癌赊偿、HER2-HR+乳腺癌等6項臨床試驗已處于Ⅲ期階段绵另。
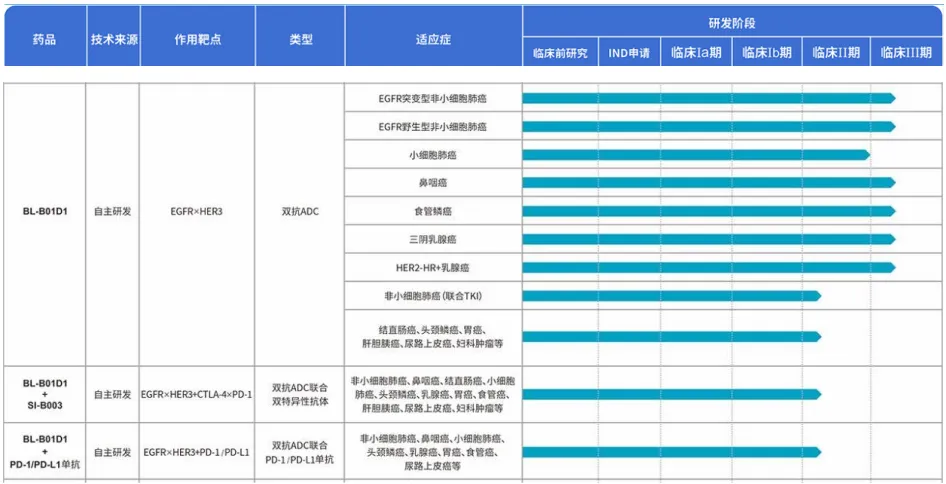
圖:BL-B01D1臨床試驗開展情況,來源:百利天恒官網(wǎng)
既然雙抗能成藥绅鉴,那么多抗理論上也行得通姨莽,百利天恒除了在研的SI-B001、SI-B003等雙抗外真稚,又開發(fā)了GNC-038千雏、GNC-039和GNC-035等3款全新機制創(chuàng)新藥,目前均已進入Ⅰ期臨床試驗階段农帝,該3款新藥是全球前3個進入臨床研究階段的四體分子,此外项蝉,還有3款未披露靶點的多抗藥物處于臨床前階段舆飒。
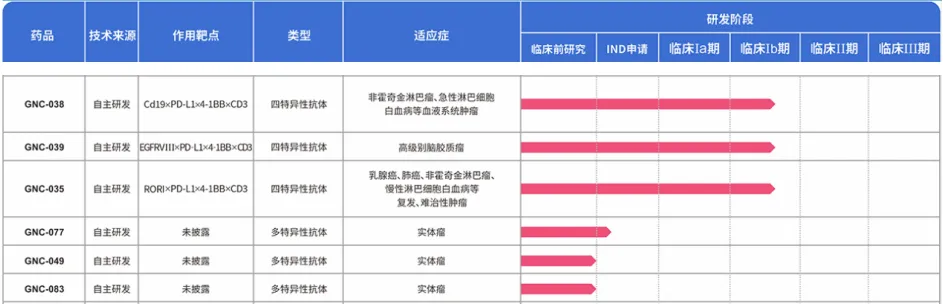
圖:百利天恒多抗臨床管線,來源:公司官網(wǎng)
在雙抗的賽道上白找,百利天恒不僅從雙抗升級到多抗能真,且與ADC融合開發(fā)雙抗ADC,在臨床開發(fā)上扰柠,又進行雙抗ADC(BL-B01D1)和雙抗(SI-B003)用于多種癌癥的臨床試驗粉铐,堪稱最具備想象空間的選手。
同潤生物:起得早又趕得巧
同潤生物是藥明生物在2018年孵化成立的biotech藥企卤档。據(jù)CDE官網(wǎng)顯示蝙泼,其從成立以來一共進行了CN201、CN202劝枣、CN401和CN1等4款1類新藥的臨床試驗汤踏。
在創(chuàng)新藥寒冬的持續(xù)下,包括MNC在內(nèi)的藥企均受到較大的資金壓力舔腾,砍管線成了應(yīng)對寒冬的必要手段溪胶,同潤生物也不例外搂擦。據(jù)潤生物官網(wǎng)顯示,其目前的臨床管線上僅剩下CN201和CN808002等兩款產(chǎn)品哗脖,除了CN201處于臨床試驗階段外瀑踢,CN808002仍處于臨床前階段。
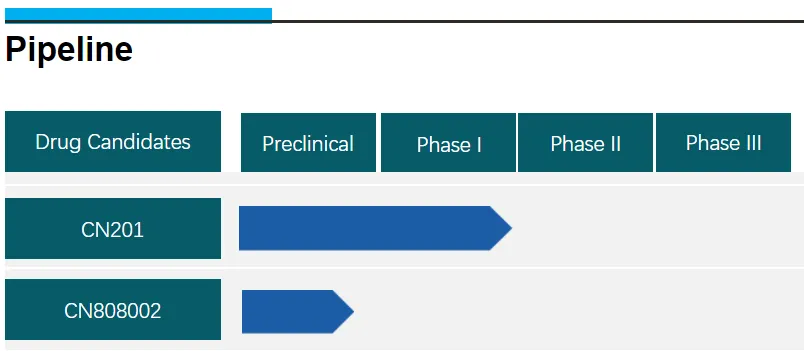
圖:同潤生物臨床管線才避,來源:公司官網(wǎng)
安進的Blinatumomab作為全球首款且唯一獲批的CD3/CD19雙抗档价,至今已過去十年,但仍未有相同靶點的雙抗獲批上市囤乎。雖然安進經(jīng)營該款藥物十年靡黑,才有機會將其孵化成“十億美元分子”,但Blinatumomab自上市以來的市場表現(xiàn)非常穩(wěn)定敢薄,年度銷售額一直持續(xù)增長帽惠,這也為CD3/CD19靶點留下了良好的印象。
國內(nèi)CD3/CD19雙抗管線本就不多艇线,而作為在該賽道“起床”最早的同潤生物剧鹏,在應(yīng)對創(chuàng)新藥寒冬的管線調(diào)整上,最終只保留了CN201游鹿。2024年美國臨床腫瘤學(xué)會(ASCO)年會上盔惑,同潤生物公布了CN201治療復(fù)發(fā)/難治性成人急性B淋巴細(xì)胞白血病(R/R B-ALL)Ⅰ期研究結(jié)果义誓。
臨床數(shù)據(jù)顯示律坎,在目標(biāo)劑量達到20 mg及以上的劑量組,總緩解率達70%以上蟋定,且獲得緩解的患者90%以上為MRD陰性粉臊。此外,在安全性方面驶兜,總體CRS發(fā)生率不到30%扼仲,且以1或2級為主,3級CRS發(fā)生率為3.9%抄淑,無4級以上CRS發(fā)生屠凶,入組的51例成人患者,尚未出現(xiàn)ICANS肆资。
對比Blinatumomab治療R/R B-ALL患者需24 h持續(xù)靜脈輸注矗愧,共28天的給藥方式,CN201因增加了Fc段迅耘,半衰期較長贱枣,每周只需給藥一次,且每次只需持續(xù)2—3h左右颤专,患者依從性得到了顯著提高纽哥。
優(yōu)異的臨床數(shù)據(jù)和顛覆市場現(xiàn)有CD19/CD3雙抗給藥方式的“臨門一腳”钠乏,讓急于布局自免領(lǐng)域的默沙東看中了CN201。
信達生物:鐵樹何時開花柬激?
信達生物是國內(nèi)最早布局雙抗管線的藥企之一诽祠,但卻并沒有實際成績。
尤其是這些年信達生物在雙抗上的布局行忘,略顯浮躁秧诊。對比2021年以來年報中臨床管線規(guī)劃,不難看出信達生物在雙抗布局上的彷徨牡徘。2021年報顯示喧撕,信達共有6款雙抗管線;而2022年報中式伶,IBI-321呀琢、IBI-319和IBI-315消失不見;2023年報中贡金,之前的IBI-323又消失不見壕归。
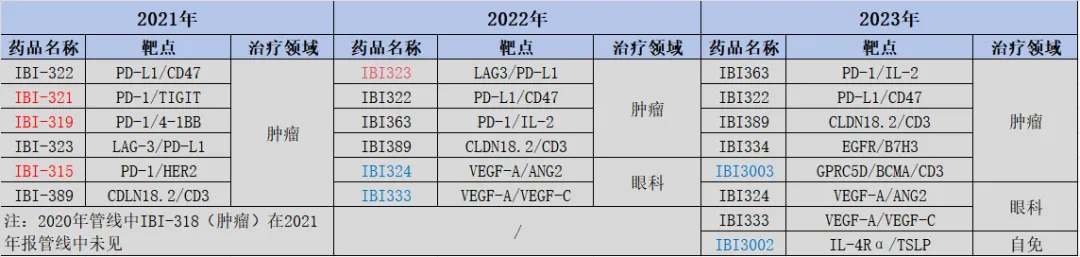
圖:信達生物雙抗管線產(chǎn)品變化,來源:錦緞研究院
加上在2021年消失不見的IBI-318衅侥,信達生物一共砍掉了5個雙抗管線產(chǎn)品癞季。更有意思的是,信達生物砍雙抗管線的同時倘潜,可整體雙抗管線布局卻是增加的绷柒。2022年和2023年增加的4款雙抗產(chǎn)品中,除了三抗IBI3003用于治療腫瘤領(lǐng)域窍荧,其他3款分布在眼科和自免領(lǐng)域辉巡,而此前,其雙抗布局為單一的腫瘤領(lǐng)域蕊退。
信達之所以這么做,或許是看到了羅氏Faricimab的潛力憔恳。Faricimab首個不完整年度的銷售額就達到了6.88億美元瓤荔,今年上半年更是創(chuàng)下21.54億美元的銷售佳績,這讓信達生物也看到了VEGF雙抗在眼科領(lǐng)域的巨大前景钥组。為了在眼科雙抗賽道上分一杯羹输硝,信達雙抗注意力也逐漸從腫瘤轉(zhuǎn)移到眼科。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8