
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥明康德
藥明康德  2024-08-28
2024-08-28
 88
88
今日福贞,再生元(Regeneron Pharmaceuticals)宣布笤昨,歐盟委員會(EC)已批準其雙特異性抗體Ordspono(odronextamab)用于治療已接受兩線或以上全身治療的復發(fā)或難治性(R/R)濾泡性淋巴瘤(FL)或R/R彌漫性大B細胞淋巴瘤(DLBCL)成年患者祖驱。根據(jù)新聞稿,這是odronextamab首次獲得全球監(jiān)管部門批準用于治療此類患者群體瞒窒。
FL和DLBCL是B細胞非霍奇金淋巴瘤(B-NHL)中最常見的兩種亞型。雖然FL是一種生長緩慢的亞型乡洼,但它是一種無法治愈的疾病崇裁,大多數(shù)患者在初始治療后會復發(fā)。DLBCL是一種侵襲性亞型扛焊,約有50%的高風險患者在一線治療后會出現(xiàn)疾病進展波耗。據(jù)估計,全球每年約有12萬例新確診的FL和16.3萬例DLBCL病例崎绽。
此次批準主要基于臨床1期試驗ELM-1和關鍵臨床2期試驗ELM-2的結果休敛,這些試驗結果證實odronextamab在R/R FL與R/R DLBCL成人患者中強勁、持久的緩解作用宅殿。ELM-1是一項進行中史糕、開放標簽、多中心的1期試驗诞书,旨在研究odronextamab在先前接受過CD20靶向抗體治療的CD20+ B細胞惡性腫瘤患者中的安全性和耐受性锤知,包括一組接受CAR-T療法后發(fā)生疾病進展的隊列。ELM-2則是一項進行中快檀、開放標簽贩纵、多中心2期試驗,旨在檢視odronextamab在五個獨立的疾病隊列中的效果都晶,包括DLBCL懒叛、FL、套細胞淋巴瘤耽梅、邊緣區(qū)淋巴瘤和其他B-NHL亞型薛窥。主要終點是由獨立審查委員會根據(jù)Lugano分類所評估的客觀緩解率,次要終點包括完全緩解率褐墅、無進展生存期拆檬、總生存期和緩解持續(xù)時間。
在ELM-2試驗中妥凳,接受odronextamab治療的FL患者(n=128)隊列的客觀緩解率高達80%竟贯,完全緩解率為73%答捕,中位緩解持續(xù)時間為23個月(95% CI:17-不可估計),中位完全緩解持續(xù)時間達24個月(95% CI:18-不可估計)屑那。
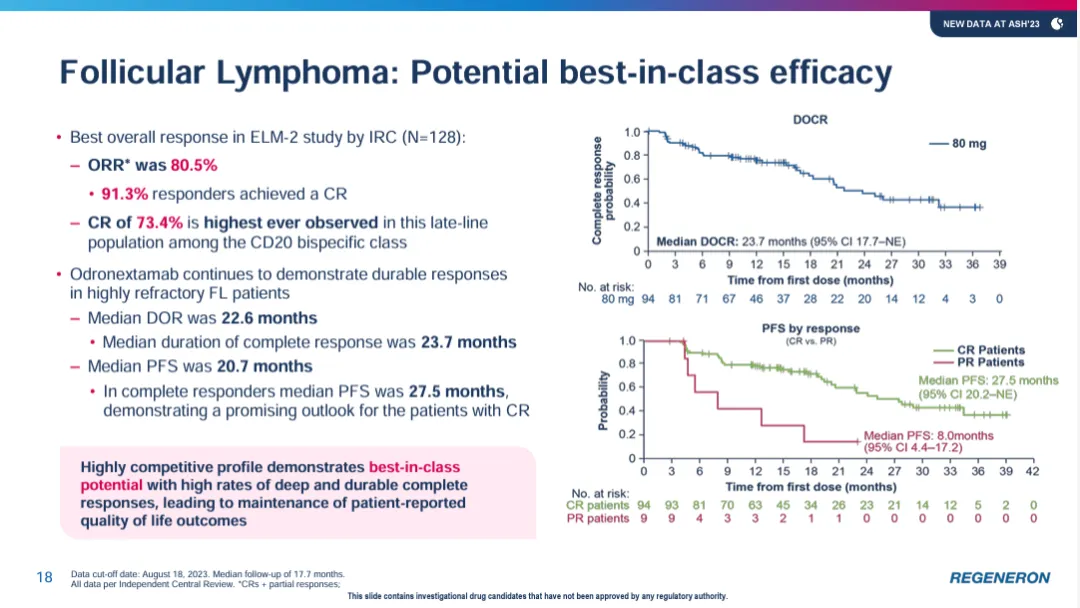
▲Odronextamab展現(xiàn)治療FL患者的積極療效(圖片來源:參考資料[2])
而在ELM-2試驗中拱镐,接受odronextamab治療的DLBCL患者(n=127)隊列的客觀緩解率則為52%,完全緩解率為31%持际,中位緩解持續(xù)時間為10個月(95% CI:5-18)沃琅,中位完全緩解持續(xù)時間為18個月(95% CI:10-不可估計)。
此外搂物,在對1期試驗擴展隊列患者的額外分析顯示蝠笔,其中可評估DLBCL患者(n=44)的客觀緩解率達48%,完全緩解率達30%囱蕴,值得一提的是床少,這些患者中有73%對CAR-T療法耐藥。
在匯總的安全性評估人群中朋堪,最常見的嚴重不良反應是細胞因子釋放綜合征(CRS)橘疚、肺炎、COVID-19和發(fā)熱盹扮。
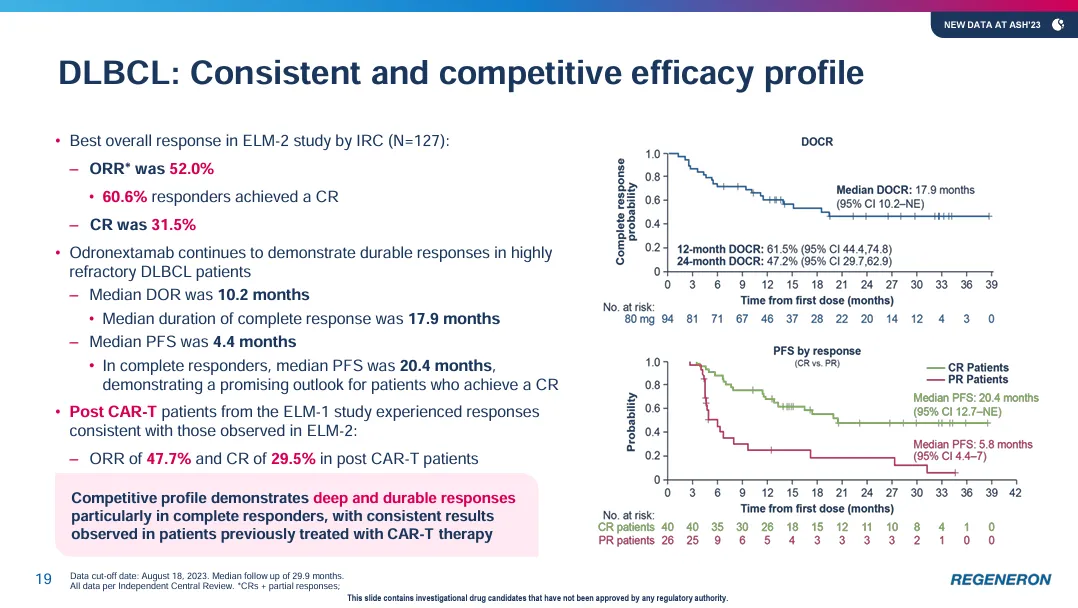
▲Odronextamab展現(xiàn)治療DLBCL患者的積極療效(圖片來源:參考資料[2])
Odronextamab是一款現(xiàn)貨型胶僵、CD20 x CD3靶向雙特異性抗體,旨在橋接癌細胞上的CD20和表達CD3的T細胞字拒,以促進局部T細胞激活和癌細胞殺傷隘勾。EMA此前已授予odronextamab治療FL和DLBCL的孤兒藥資格。
再生元將繼續(xù)評估odronextamab作為單藥和組合療法在更早治療線中的應用捧贺,特別是在難治性淋巴瘤中角葱。這包括注冊性ELM-1和ELM-2試驗、3期OLYMPIA開發(fā)計劃(這是評估odronextamab在更早治療線和其他B-NHL中的最大臨床項目之一)以及不包含化療的組合療法試驗座泳。此外惠昔,再生元還在ATHENA-1和CLIO-1研究當中,分別檢視odronextamab與共刺激雙特異性抗體REGN5837(靶向CD22與CD28)以及與該公司的PD-1抑制劑cemiplimab聯(lián)合挑势,在復發(fā)或難治性侵襲性B-NHL中的效果镇防。
近年來,雙特異性抗體逐漸成為癌癥治療的新趨勢潮饱。目前全球監(jiān)管單位已批準十余款雙特異性抗體用于癌癥治療来氧。目前臨床上也有多款療法處于2/3期試驗或以上階段。其中香拉,由Jazz Pharmaceuticals與Zymeworks共同開發(fā)的在研HER2靶向雙特異性抗體zanidatamab在用于治療HER2陽性啦扬、局部晚期不可切除或轉(zhuǎn)移性膽道癌(BTC)患者2b期試驗中,接受該療法治療患者的中位生存期(OS)達15.5個月,這些患者在之前曾接受過吉西他濱治療扑毡。過往數(shù)據(jù)顯示胃榕,一線治療后接受化療的類似患者群體OS為6個月至9個月。美國FDA已接受zanidatamab的生物制品許可申請(BLA)并授予優(yōu)先審評資格瞄摊,該申請的PDUFA目標日期為2024年11月29日勋又。阿斯利康(AstraZeneca)的PD-1和TIGIT靶向rilvegostomig,以及PD-1和CTLA-4靶向volrustomig目前也都處于臨床3期試驗階段颈缆,用于治療多種不同類型的癌癥葡料。
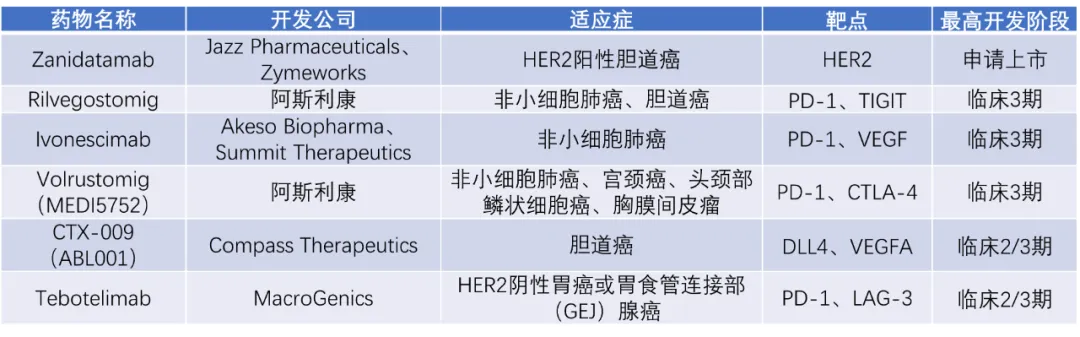
▲截至2024年8月26日,歐美地區(qū)處于臨床2/3期以上階段的雙特異性抗體癌癥療法盤點
注:本表由藥明康德內(nèi)容團隊根據(jù)公開資料梳理梧货,為不完全統(tǒng)計佃贞。如有遺漏,歡迎補充褂反。
參考資料:
[1] Ordspono? (odronextamab) Approved in the European Union for the Treatment of Relapsed/Refractory Follicular Lymphoma and Diffuse Large B-cell Lymphoma. Retrieved August 26, 2024 from https://www.globenewswire.com/news-release/2024/08/26/2935368/0/en/Ordspono-odronextamab-Approved-in-the-European-Union-for-the-Treatment-of-Relapsed-Refractory-Follicular-Lymphoma-and-Diffuse-Large-B-cell-Lymphoma.html
[2] American Society of Hematology 2023 I nvestor Event. Retrieved June 28, 2024 from https://investor.regeneron.com/static-files/cb093452-9e37-41b0-9d52-c53b9275e99e

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8