
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-08-28
2024-08-28
 77
77
以PD-(L)1免疫檢查點抑制劑甜殖、靶向療法為代表的抗腫瘤新藥開辟了腫瘤治療新天地蓝角,而抗體藥物偶聯(lián)藥(ADC)這種新型藥物形式的出現(xiàn)使腫瘤治療邁向了新的臺階。在制藥巨頭的帶動下哭懈,ADC新藥開發(fā)如火如荼灾馒,角逐異常激烈,同時帶來了很多突破遣总,包括在HER2之外有更多創(chuàng)新靶點以ADC形式成藥睬罗,為腫瘤臨床治療帶來變革。
安斯泰來開發(fā)的Padcev(注射用維恩妥尤單抗)就是一款first in class的靶向Nectin-4的ADC新藥旭斥,以突破性療法的身份最早在2019年12月18日獲得FDA加速批準(zhǔn)上市容达,從遞交上市申請到獲批僅用了2個月時間古涧。不僅獲批速度驚人,Padcev上市后的銷售成績也格外亮眼花盐,2023年全球銷售額已達(dá)11.18億美元羡滑,進(jìn)入“10億美元分子俱樂部”,也是目前為數(shù)不多年銷售額破10億美元的ADC藥物之一算芯。
2024年8月19日柒昏,注射用維恩妥尤單抗也獲得了國家藥品監(jiān)督管理局批準(zhǔn)上市, 用于既往接受過含鉑化療和PD-(L)1抑制劑治療的局部晚期或轉(zhuǎn)移性尿路上皮癌(la/mUC)成人患者。這款全球首創(chuàng)的Nectin-4 ADC新藥首次成功登陸中國属圃,意味著中國晚期尿路上皮癌患者也將能夠從這一全新的治療選擇中實現(xiàn)獲益轻调。
全球首創(chuàng)——中國晚期尿路上皮癌患者迎來全球最新療法
尿路上皮癌(UC)是最常見的膀胱癌類型。據(jù)報告叉砰,全球膀胱癌每年新發(fā)病例約57.3萬例皮匪,死亡21.2萬例,其中約90%患者為UC病例众抽,轉(zhuǎn)移性UC患者的5年生存率不足9%涮观。2022年國家癌癥中心發(fā)布報告顯示,在我國袋员,膀胱癌年發(fā)病率約為8.2/10萬悟惰,死亡率高達(dá)3.4/10萬刀雳,也就意味著中國每年有超過47600例膀胱癌患者死亡痘嫉。
在過去,化療一直是無法手術(shù)的la/mUC患者的標(biāo)準(zhǔn)療法粪世。2016年之后馆义, PD-(L)1抑制劑將膀胱癌治療推進(jìn)至免疫治療時代。不過對于既往接受過PD-(L)1抑制劑和含鉑化療后疾病進(jìn)展的患者胁塞,治療選擇仍十分有限咏尝。ADC在實體瘤的成功也讓科學(xué)家將目光瞄準(zhǔn)UC這一臨床需求遠(yuǎn)未滿足的領(lǐng)域。Nectin-4 ADC啸罢、HER2 ADC编检、TROP2 ADC等均在這一腫瘤細(xì)分賽道進(jìn)行了探索。最終扰才,安斯泰來開發(fā)的維恩妥尤單抗率先實現(xiàn)突圍允懂,成為了全球首款獲批治療晚期UC的ADC新藥。
“Nectin”來源于拉丁語necto衩匣,意為“連接”蕾总。Nectin-4(基因名為PVRL4,脊髓灰質(zhì)炎病毒受體4)是一種不依賴Ca2+的類免疫球蛋白琅捏,與其他Nectin蛋白(Nectin-1生百,-2和-3)一起主要參與細(xì)胞間的粘附递雀,對于實現(xiàn)細(xì)胞間通訊、遷移和其他重要細(xì)胞過程至關(guān)重要蚀浆。
相較于其他Nectin缀程,Nectin-4廣泛存在于實體瘤中,在尿路上皮癌箍伏,乳腺癌颜要,肺癌,頭頸癌哭夺,卵巢癌等腫瘤中均具有極高的表達(dá)量奸,而在正常組織中表達(dá)較低。研究發(fā)現(xiàn)卷撞,Nectin-4可通過激活P13K/Akt通路促進(jìn)腫瘤的增殖和遷移澄璃,是一種腫瘤相關(guān)誘導(dǎo)劑。這些特性使Nectin-4成為了一種理想的抗腫瘤藥物靶點盐文。
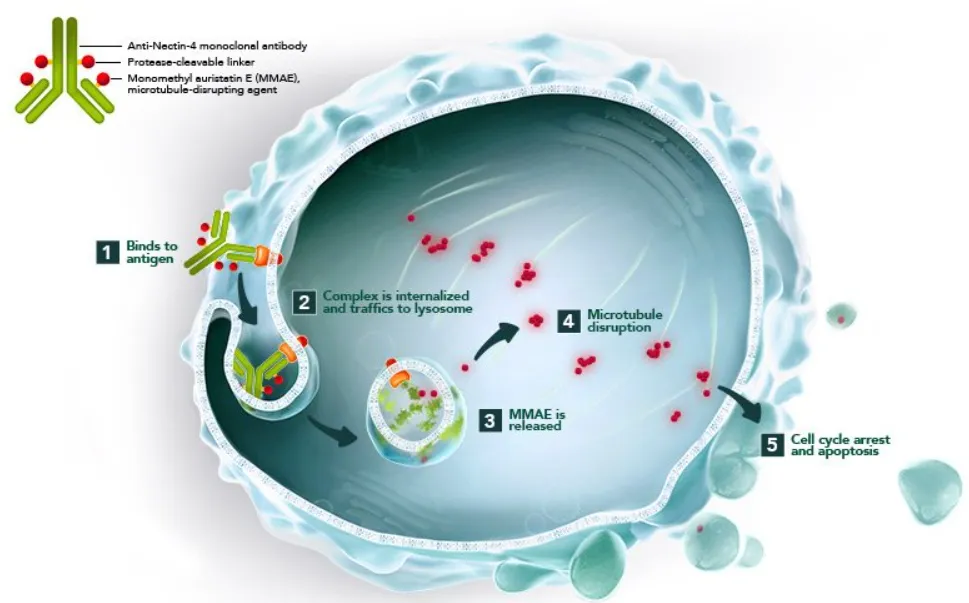
來源:Seagen官網(wǎng)
維恩妥尤單抗是由靶向Nectin-4的人IgG1單克隆抗體enfortumab與細(xì)胞毒制劑MMAE(單甲基奧瑞他汀E圣翅,一種微管破壞劑)偶聯(lián)而成。通過與表達(dá)Nectin-4蛋白的細(xì)胞結(jié)合咏摔,然后將MMAE內(nèi)化并釋放到細(xì)胞中握饼,導(dǎo)致細(xì)胞停止增殖(細(xì)胞周期阻滯)和程序性細(xì)胞死亡(凋亡)。
維恩妥尤單抗的抗癌效果在臨床研究中得到證實昙百。此次在中國獲批正是基于全球EV-301研究和中國EV-203研究積極結(jié)果诡泌,維恩妥尤單抗顯著改善了既往接受過含鉑化療和PD-(L)1抑制劑治療患者的總生存期(OS)和客觀緩解率(ORR)。
EV-301研究結(jié)果顯示啄枕,維恩妥尤單抗組的中位OS比化療組更長(12.88 vs 8.97個月婚陪;HR:0.70;95% CI:0.56-0.89频祝;p=0.001)泌参,PFS也長于化療組(5.55 vs 3.71個月;HR:0.62;95% CI:0.51-0.75;P<0.001)柒谈。 兩組治療相關(guān)的不良事件發(fā)生率相似(93.9% vs 91.8%)交某。3級及以上不良事件的發(fā)生率也相似(51.4% vs 49.8%)。
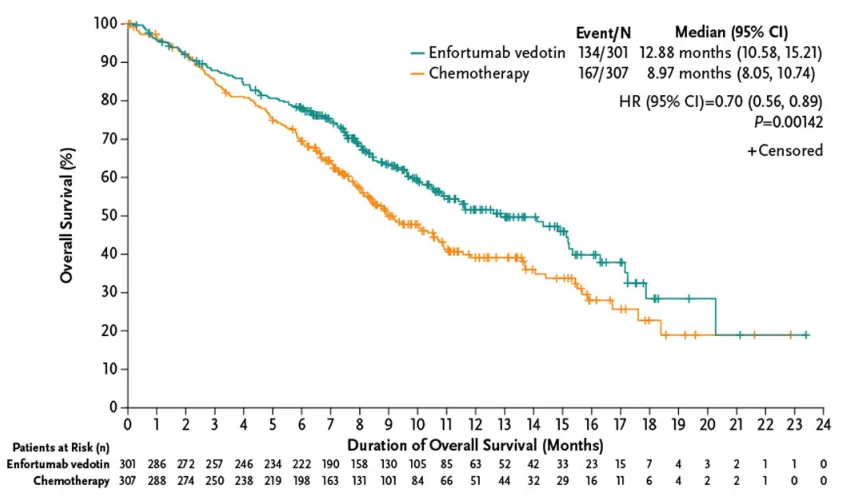
來源:N Engl J Med. 2021;384(12):1125-1135.
FDA曾基于單臂II期EV-201研究隊列1的數(shù)據(jù)加速批準(zhǔn)維恩妥尤單抗治療既往接受過PD-(L)1抑制劑和含鉑化療治療的la/mUC患者,125例受試者的ORR為44%,中位PFS為5.8個月,中位OS為11.7個月攘残;此后又基于III期EV-301研究和EV-201研究隊列2試驗結(jié)果,將這一批準(zhǔn)轉(zhuǎn)為常規(guī)批準(zhǔn)为狸,同時還批準(zhǔn)其用于治療不適合接受順鉑化療歼郭,且既往接受過一種或多種治療的la/mUC患者遗契。由此可見,維恩妥尤單抗二線治療晚期UC患者的療效經(jīng)住了多項研究的考驗盆扳,證實了其對這類患者的臨床獲益膊编。維恩妥尤單抗二線治療la/mUC患者療效數(shù)據(jù)
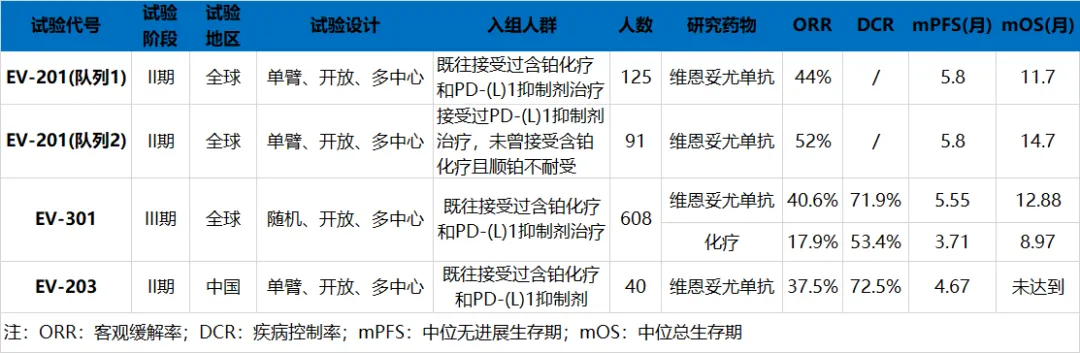
來源:醫(yī)藥魔方數(shù)據(jù)庫
事實上,繼維恩妥尤單抗之后俭整,靶向TROP 2的ADC藥物戈沙妥珠單抗也基于II期尸钢、單臂TROPHY研究獲FDA加速批準(zhǔn)用于治療既往接受過PD-(L)1抑制劑的局部晚期或轉(zhuǎn)移性mUC患者,遺憾的是妄由,該款藥物的確證性III期TROPiCS-04研究未達(dá)到OS主要終點熔厌,F(xiàn)DA是否會撤回該項適應(yīng)癥也未可知。此外像淋,維迪西妥單抗雖在中國附條件批準(zhǔn)用于治療既往接受過含鉑化療的局部晚期或轉(zhuǎn)移性尿路上皮癌患者誉煎,不過僅限于HER2過表達(dá)(HER2 免疫組織化學(xué)檢查結(jié)果為2+ 或3+)患者,這也意味著患者是否能接受該款藥物治療需要提前進(jìn)行靶點檢測语雇;開發(fā)進(jìn)度更晚一些的9MW2821正在中國開展治療la/mUC 的III期研究痛贬。由此可見,無論是在療效方面磨涵,還是在覆蓋人群驻债,臨床運用便利性,以及當(dāng)前患者可及性方面形葬,維恩妥尤單抗均有其獨特優(yōu)勢合呐,在全球以及中國尿路上皮癌這一細(xì)分領(lǐng)域的領(lǐng)先地位較為明顯。
ADC+IO聯(lián)合療法正成為腫瘤治療新范式荷并,維恩妥尤單抗+PD-1打頭陣
ADC單藥使用已被證明具有強大的抗腫瘤效果合砂,并在多種實體瘤和血液瘤中獲得了批準(zhǔn)。不過源织,更長時間的腫瘤緩解和臨床治愈需求促使研究人員探索更多元的臨床治療策略。ADC聯(lián)合化療微猖、靶向療法谈息、以及腫瘤免疫(IO)治療策略有望在現(xiàn)有療法基礎(chǔ)上進(jìn)一步提高患者生存率和生存時間,這些治療模式正在成為腫瘤臨床治療新的范式凛剥。
ADC+IO治療無疑是目前研發(fā)熱度最高的聯(lián)合治療方案侠仇,此前,多個癌種的臨床試驗數(shù)據(jù)顯示PD-(L)1等免疫療法聯(lián)用ADC展現(xiàn)出優(yōu)異的療效犁珠,而這一類方案也被眾多布局ADC的醫(yī)藥創(chuàng)新企業(yè)視為腫瘤免疫新一輪競爭“超車”的機會逻炊。根據(jù)醫(yī)藥魔方TrialCube數(shù)據(jù)庫,目前全球已經(jīng)開展/完成的用于治療實體瘤的ADC聯(lián)合IO治療的關(guān)鍵注冊性III期臨床研究多達(dá)24項雇牍。
其中包括第一三共的德曲妥珠單抗聯(lián)合TIGIT單抗rilvegostomig治療HER2+膽道癌的III期研究嗅呻;默沙東/科倫博泰藤习、第一三共的TROP2 ADC分別聯(lián)合PD-1抑制劑治療非小細(xì)胞肺癌、三陰性乳腺癌导劝;以及國內(nèi)企業(yè)恒瑞醫(yī)藥第粟、榮昌生物等各自的ADC新藥聯(lián)合PD-(L)1制劑治療多種實體瘤研究等。全球已開展/完成的ADC+IO治療實體瘤關(guān)鍵注冊性III期研究
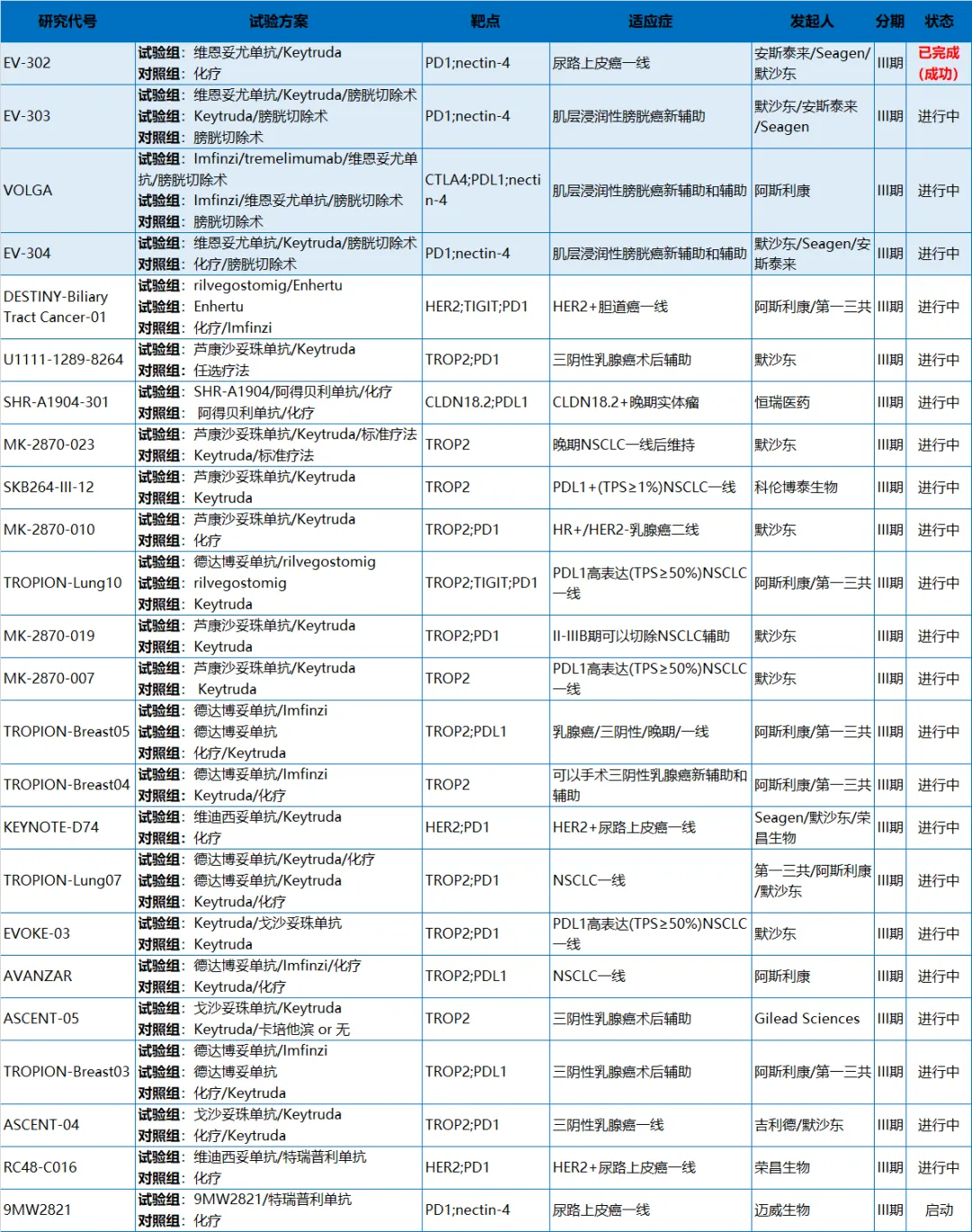
來源:醫(yī)藥魔方TrialCube數(shù)據(jù)庫
從上表我們也可以看到齐皂,除了EV-302研究外协颅,其他ADC+IO聯(lián)合治療的關(guān)鍵性III期研究均在進(jìn)行中。也就是說仅汰,維恩妥尤單抗聯(lián)合帕博利珠單抗(Keytruda)一線治療尿路上皮癌的III期EV-302研究是目前唯一一個試驗成功的注冊性III期研究簇娩,并成功獲得監(jiān)管機構(gòu)認(rèn)可、成功運用于臨床的治療方案蝉站。
2023年4月3日厦浦,基于Ib/II期EV-103研究列A和隊列K結(jié)果,維恩妥尤單抗聯(lián)合帕博利珠單抗獲FDA加速批準(zhǔn)奕枝,用于一線治療不適合接受以順鉑為基礎(chǔ)化療的la/mUC患者棺榔,開創(chuàng)了ADC+IO聯(lián)合治療的先河。EV-103研究中隘道,在劑量遞增/隊列A和隊列K(n=121)的合并療效分析中症歇,聯(lián)合療法的ORR為68%,CR和PR率分別達(dá)到12%和55%谭梗。2023年12月15日忘晤,基于EV-302研究積極結(jié)果,F(xiàn)DA將這一聯(lián)合治療方案轉(zhuǎn)為常規(guī)批準(zhǔn)激捏,用于一線治療la/mUC设塔,并且不再限制患者是否耐受含鉑化療。
FDA相較PDUFA預(yù)定日期提前了近5個月批準(zhǔn)該申請远舅。這是首個也是唯一一個獲批治療膀胱癌的PD-1+ADC組合療法闰蛔。EV-302研究中,共有886例既往未接受過治療的la/mUC且能耐受含鉑化療的患者被納入图柏,結(jié)果顯示序六,與含鉑化療方案相比,接受維恩妥尤單抗與帕博利珠單抗聯(lián)合療法患者的OS和PFS均出現(xiàn)統(tǒng)計學(xué)顯著性改善蚤吹。維恩妥尤單抗聯(lián)合療法組患者的中位OS為31.5個月(95% CI:25.4-未達(dá)到)拒吧,而化療組為16.1個月(95% CI:13.9-18.3),即與化療組相比泡募,聯(lián)合療法組患者的死亡風(fēng)險降低了53%(HR:0.47描蹦,95% CI:0.38-0.58,p<0.0001)。
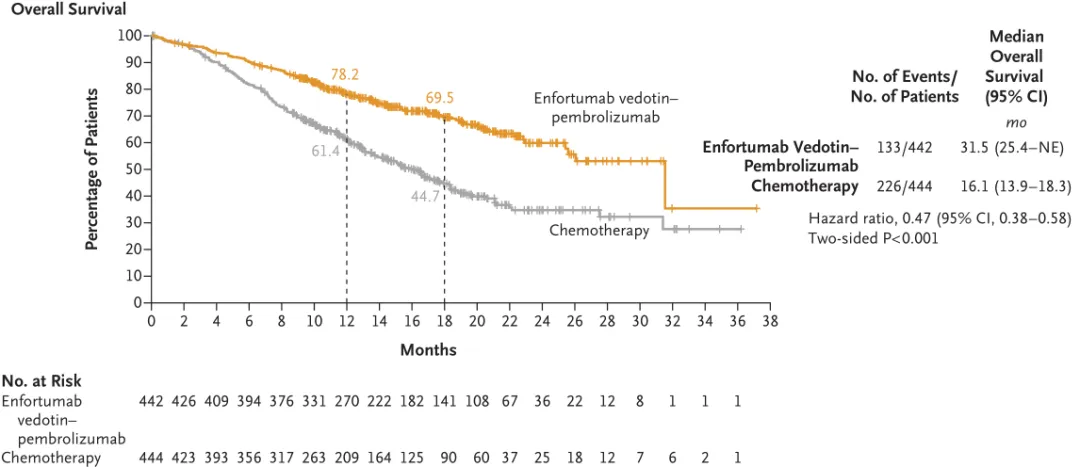
來源:N Engl J Med. 2024;390(10):875-888.
此外仆阶,接受維恩妥尤單抗聯(lián)合療法患者的中位PFS為12.5個月(95% CI:10.4-16.6)筝踢,而化療組為6.3個月(95% CI:6.2-6.5),即與化療相比菠山,聯(lián)合療法組患者疾病進(jìn)展或死亡風(fēng)險降低了55%(HR:0.45哮互,95% CI:0.38-0.54,p<0.0001)乙错。EV-302研究的試驗數(shù)據(jù)在2024年最新版的NCCN/ESMO/EAU指南都進(jìn)行了更新题晌,維恩妥尤單抗聯(lián)合帕博利珠單抗被推薦作為晚期一線la/mUC的治療首選。

來源:NCCN臨床指南:膀胱癌(Version 4.2024)
除此之外贾悬,維恩妥尤單抗聯(lián)合Imfinzi(度伐利尤單抗)儡皮、tremelimumab(CTLA4單抗)以及維恩妥尤單抗聯(lián)合帕博利珠單抗用于肌層浸潤性膀胱癌新輔助和輔助治療的III期注冊性研究(VOLGA和EV-304)正在進(jìn)行中,臨床結(jié)果值得期待哪自。治療前移意味著更廣泛的人群覆蓋丰包,廣闊的市場空間和商業(yè)前景。隨著多項臨床研究的啟動和更多療效數(shù)據(jù)的出爐壤巷,維恩妥尤單抗在早期膀胱癌患者中的治療潛質(zhì)將得到進(jìn)一步的印證邑彪,商業(yè)價值也將進(jìn)一步得到提升。
總結(jié)
維恩妥尤單抗作為全球首款成功獲批上市的Nectin-4 ADC新藥胧华,其單藥治療的療效不僅在多項臨床研究中得到了驗證寄症,為晚期尿路上皮癌患者二線以上治療帶來了全新的治療選擇。同時其也開創(chuàng)了ADC聯(lián)合腫瘤免疫治療的先河矩动,為癌癥患者開拓了一條全新的治療路徑有巧,也使更多的ADC新藥朝著聯(lián)合腫瘤免疫治療的方案邁進(jìn),進(jìn)而為患者爭取更優(yōu)的治療選擇悲没。此次維恩妥尤單抗在中國的獲批是其又一個里程碑篮迎,將會惠及更多的中國晚期尿路上皮癌患者。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-09-05
2024-09-05
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-09-05
2024-09-05
 8
8