
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 同寫(xiě)意
同寫(xiě)意  2024-09-19
2024-09-19
 166
166
作為生物制藥的一大前沿,細(xì)胞療法越來(lái)越受業(yè)界重視伍恼,也成為不少國(guó)家搶占的高地句携,日本就是這樣的代表栗衍。
2012年精拟,因發(fā)現(xiàn)誘導(dǎo)多能干細(xì)胞(iPSC)技術(shù)誓享,日本京都大學(xué)教授山中伸彌獲得諾貝爾獎(jiǎng)。此后,日本政府開(kāi)始積極在細(xì)胞治療領(lǐng)域布局徒仓。
通過(guò)建立《再生醫(yī)學(xué)促進(jìn)法》《再生醫(yī)學(xué)安全法》等特殊法規(guī)監(jiān)管途徑,十多年來(lái)誊垢,日本不遺余力地鼓勵(lì)細(xì)胞療法的開(kāi)發(fā)和商業(yè)化掉弛,批準(zhǔn)了許多產(chǎn)品。它們大部分是由日本公司推出的喂走,但也包括來(lái)自歐美MNC的CAR-T療法殃饿。
然而,由于某些產(chǎn)品的療效缺乏可預(yù)測(cè)性兵故,日本近期修改了該領(lǐng)域的法規(guī)帮色,謹(jǐn)慎地縮小附條件批準(zhǔn)范圍,降低價(jià)格補(bǔ)貼折甸。
商業(yè)探索喜憂參半瑟哺,一些細(xì)胞產(chǎn)品已退出日本市場(chǎng)。對(duì)于其他國(guó)家闷邑,能從日本的處境看到多少自己的影子弹梁?
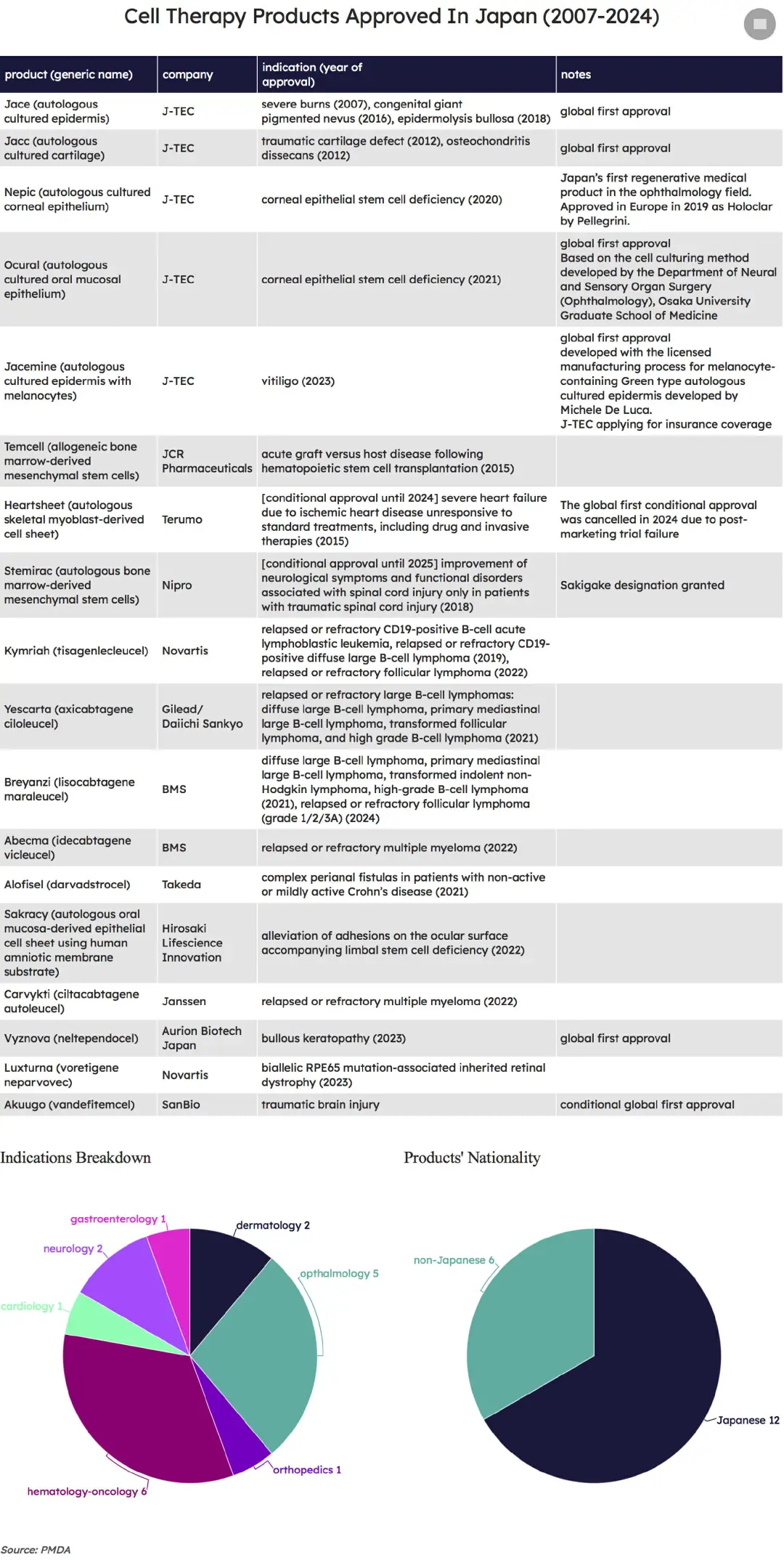
18種獲批細(xì)胞療法
到目前為止,日本已經(jīng)批準(zhǔn)了18種細(xì)胞療法峦拥,包括兩款基于附條件批準(zhǔn)框架的產(chǎn)品动院。
適應(yīng)癥分布上,用于治療血液瘤的產(chǎn)品最多歧坚,共計(jì)6種芽堪。在神經(jīng)、眼科嘱悄、骨科等其他疾病領(lǐng)域隅本,也都有療法覆蓋实愚。
從地域看兼呵,12種療法來(lái)自日本,占比近七成腊敲。其中击喂,光是J-TEC就推出5種。2015年之前碰辅,J-TEC的Jace(自體培養(yǎng)表皮)和Jacc(自體培養(yǎng)軟骨)是日本僅有的兩款獲批細(xì)胞產(chǎn)品懂昂。
改變?nèi)毡炯?xì)胞療法產(chǎn)業(yè)環(huán)境的關(guān)鍵之年是2012年,山中伸彌因相關(guān)研究獲得諾貝爾獎(jiǎng)没宾。此后凌彬,被視為具有廣闊前景的iPSC領(lǐng)域,也開(kāi)始受到日本政府層面的支持循衰。
很多適應(yīng)癥都是在那之后獲得批準(zhǔn)的铲敛。最近一款上市產(chǎn)品褐澎,是由日本公司SanBio開(kāi)發(fā)的同種異體間充質(zhì)干細(xì)胞療法Akuugo,用于改善與創(chuàng)傷性腦損傷相關(guān)的慢性運(yùn)動(dòng)性麻痹伐蒋。7月底工三,Akuugo首次獲得附條件批準(zhǔn)。
安倍“十年戰(zhàn)略”
2013年曲苛,時(shí)任日本首相安倍晉三在其經(jīng)濟(jì)政策中指出舍娜,政府應(yīng)牽頭推動(dòng)創(chuàng)新醫(yī)療研發(fā)的全國(guó)性舉措,并承諾到2022年這10年間岖习,投資1100億日元(約合7.53億美元)支持再生醫(yī)學(xué)發(fā)展谨敏。
到2014年,安倍政府通過(guò)內(nèi)閣府推動(dòng)《健康醫(yī)療戰(zhàn)略推進(jìn)法》出臺(tái)创撼,并于2015年成立了專門(mén)負(fù)責(zé)協(xié)調(diào)和支持國(guó)內(nèi)藥物研發(fā)項(xiàng)目(不僅僅是細(xì)胞療法)的日本醫(yī)學(xué)研究開(kāi)發(fā)機(jī)構(gòu)(AMED)烫王。
AMED旨在通過(guò)橫跨厚生勞動(dòng)省(MHLW)崇审、經(jīng)濟(jì)產(chǎn)業(yè)士垦弧(METI)以及文部科學(xué)省(MEXT)三個(gè)部門(mén)任汪,架起政府苔巍、公司和學(xué)術(shù)機(jī)構(gòu)的橋梁。
從2015年到2020年枷窿,AMED每年提供約140億到160億日元(約合0.97億到1.11億美元)用于支持國(guó)內(nèi)藥物研發(fā)避归,其中近一半(65億日元)用于iPSC領(lǐng)域。
附條件批準(zhǔn)框架
大約在安倍政府提供資金支持的同一時(shí)間管呵,日本頒布了《再生醫(yī)學(xué)促進(jìn)法》梳毙,對(duì)《藥品和醫(yī)療器械法案》進(jìn)行修訂,引入細(xì)胞和基因療法等再生醫(yī)學(xué)產(chǎn)品的附條件批準(zhǔn)框架捐下。
改革前账锹,小分子藥物等療法必須經(jīng)過(guò)昂貴且繁瑣的三個(gè)階段臨床試驗(yàn),才能獲得日本藥品和醫(yī)療器械管理局(PMDA)的批準(zhǔn)坷襟。
為了縮短上市時(shí)間奸柬,該方案允許在若干條件下,提前批準(zhǔn)已證實(shí)安全性和具備“潛在”療效的療法婴程。之后廓奕,這些產(chǎn)品需要開(kāi)展上市后的試驗(yàn)以確認(rèn)療效,并在附條件批準(zhǔn)期內(nèi)提交申請(qǐng)以獲得全面批準(zhǔn)档叔。
Nature刊登的一篇文章介紹桌粉,基于這個(gè)框架,再生醫(yī)學(xué)療法開(kāi)發(fā)商將不必按照階段推進(jìn)臨床,而是在一項(xiàng)試驗(yàn)研究中證明療效铃肯。如果變化足夠顯著悄函,則一次試驗(yàn)中至少要有10名患者;如果改善幅度較小磅芬,則要有幾百名患者山顶。
2014年11月,PMDA在一份解釋性文件中表示着癞,對(duì)iPSC相關(guān)產(chǎn)品的高期望和解決潛在安全風(fēng)險(xiǎn)的監(jiān)管方法是該方案的關(guān)鍵好员。
從2017年開(kāi)始,附條件批準(zhǔn)框架擴(kuò)大到包括非再生創(chuàng)新藥物役霍。
分化的商業(yè)市場(chǎng)
得益于這些轉(zhuǎn)變略尘,監(jiān)管部門(mén)自2015年以來(lái)越來(lái)越頻繁地對(duì)細(xì)胞和基因療法產(chǎn)品點(diǎn)頭。然而磷尊,日本也不得不的面臨隨之而來(lái)的問(wèn)題怯漾,例如,產(chǎn)品附條件批準(zhǔn)后的療效不及預(yù)期豹女,日本國(guó)民健康保險(xiǎn)(NHI)計(jì)劃中的成本與效益平衡壓力摹削。
2015年,JCR Pharmaceuticals申報(bào)的同種異體骨髓源間充質(zhì)干細(xì)胞(MSC)產(chǎn)品Temcell拷肌、Terumo申報(bào)的自體成骨肌源性細(xì)胞片產(chǎn)品HeartSheet到旦,分別獲得附條件批準(zhǔn)。
Temcell基于2003年由Osiris Therapeutics授權(quán)的MSC技術(shù)開(kāi)發(fā)巨缘,被批準(zhǔn)用于移植物抗宿主病添忘,這是一種發(fā)生在同種異體骨髓移植患者中的嚴(yán)重并發(fā)癥。Temcell每次治療價(jià)格約為1400萬(wàn)日元若锁,并成為日本最成功的細(xì)胞療法之一搁骑,在2023年創(chuàng)造32億日元(2210萬(wàn)美元)的收入。
不過(guò)又固,HeartSheet就沒(méi)那么幸運(yùn)了仲器。最初,HeartSheet獲得治療嚴(yán)重心力衰竭的5年有條件批準(zhǔn)口予,但由于其適應(yīng)癥小等諸多限制娄周,后來(lái)在上市后試驗(yàn)中招募患者時(shí)遇到困難。
附條件批準(zhǔn)期延長(zhǎng)至8年后沪停,Terumo在2023年申請(qǐng)全面批準(zhǔn),但未能證明其有效性裳涛。最終盒止,Terumo決定在今年將HeartSheet撤出市場(chǎng)。
另一個(gè)與之相似的案例念焙,是日本公司Nipro開(kāi)發(fā)的自體骨髓來(lái)源MSC產(chǎn)品Stemirac扑跌,附條件批準(zhǔn)期間從2018年到2025年扇殃,用于改善與創(chuàng)傷性脊髓損傷相關(guān)的神經(jīng)癥狀和功能障礙。
自COVID-19以來(lái)创皿,Nipro在Stemirac商業(yè)化方面受阻投戴。最近該公司表示,它的目標(biāo)是在2025年申請(qǐng)全面批準(zhǔn)爸蝠,并擴(kuò)大與醫(yī)療機(jī)構(gòu)的合作梢跳,以獲得收入。
5月十旗,Nipro披露的最新財(cái)務(wù)報(bào)告說(shuō):“COVID-19的兩年中仲峡,由于優(yōu)先考慮重癥患者,對(duì)Stemirac的管理一直很困難溯内,其收入未能達(dá)到最初的預(yù)測(cè)酵逾。”
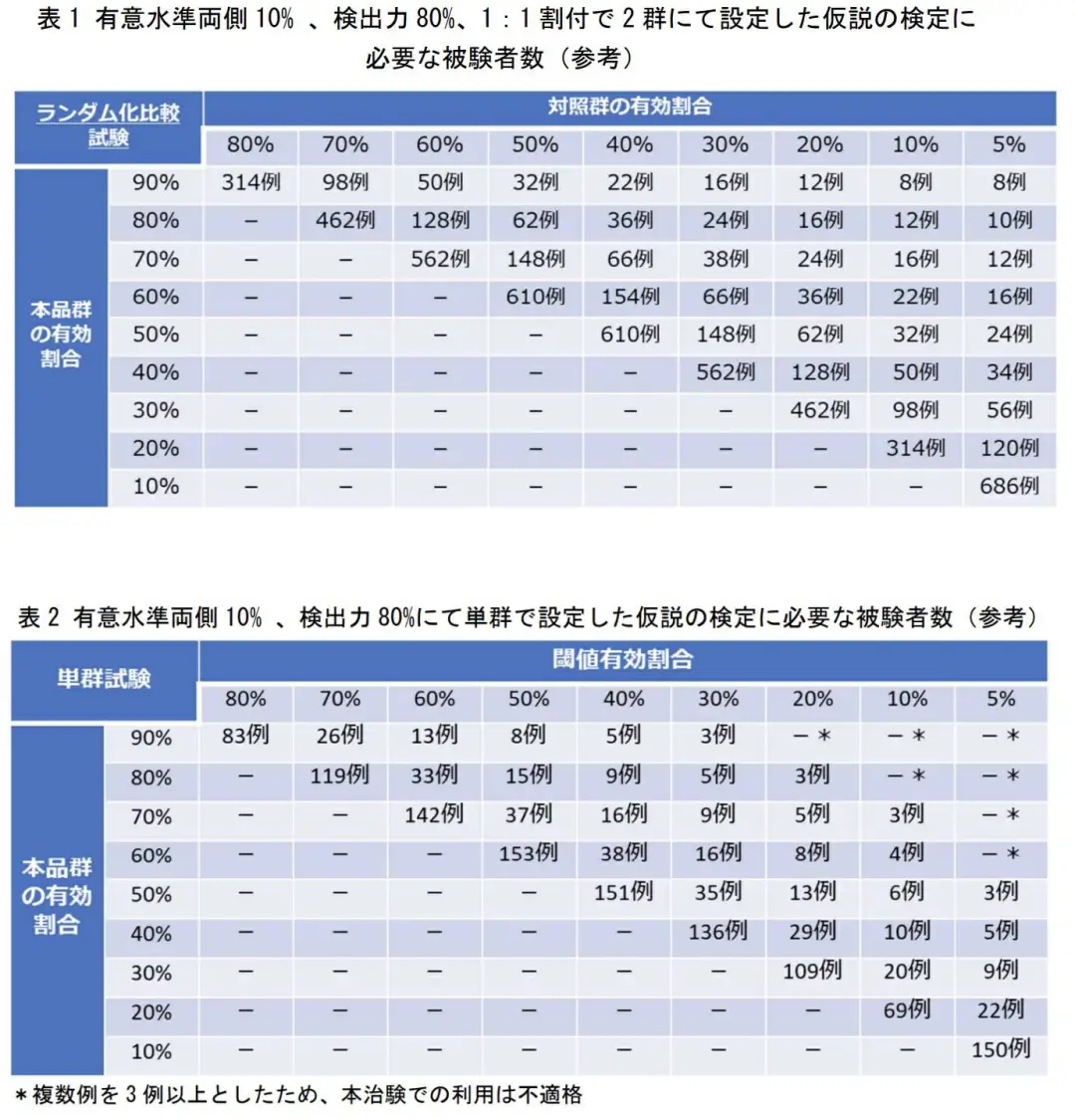
收窄加速通道
附條件批準(zhǔn)框架施行十年后闷畸,今年3月尝盼,MHLW發(fā)布一項(xiàng)新指南,以說(shuō)明如何通過(guò)上市后的研究計(jì)劃來(lái)認(rèn)定細(xì)胞療法的有效性佑菩。
指南提到东涡,藥企和監(jiān)管機(jī)構(gòu)應(yīng)事先明確附條件批準(zhǔn)后所開(kāi)展試驗(yàn)的適當(dāng)性,應(yīng)涉及病例數(shù)倘待、開(kāi)展試驗(yàn)的地點(diǎn)數(shù)疮跑、參數(shù)的客觀性、病例的隨機(jī)化凸舵、評(píng)價(jià)的盲法祖娘、對(duì)照組的建立等方面。為此啊奄,指南還提出了統(tǒng)計(jì)學(xué)上可推測(cè)有效性的參考基準(zhǔn)渐苏。
MHLW此舉的背景是,2020年到2023年菇夸,日本政府根據(jù)此前“十年戰(zhàn)略”的框架琼富,對(duì)未來(lái)的創(chuàng)新藥品政策進(jìn)行一系列討論。
6月泻漏,因?yàn)楦綏l件批準(zhǔn)期限屆滿翎噩,AnGes撤回了日本首款基因療法Collategene的制造和營(yíng)銷批準(zhǔn)申請(qǐng)。隨著Collategene哆念、HeartSheet等幾款產(chǎn)品證明其療效的失敗治弯,MHLW認(rèn)為,通過(guò)哪種類型的數(shù)據(jù),并以怎樣的準(zhǔn)確性“推測(cè)”療效凡盔,成為日本的關(guān)鍵挑戰(zhàn)之一孙悦。
“重要的是要有某種指導(dǎo)方針來(lái)推定有條件批準(zhǔn)的效力》穑”去年疤巩,MHLW在就這一問(wèn)題撰寫(xiě)的最終報(bào)告里寫(xiě)道。
截至2024年蒙便,沒(méi)有任何附條件批準(zhǔn)的細(xì)胞治療產(chǎn)品在日本成功獲得全面批準(zhǔn)狮屏。
國(guó)家醫(yī)保“砍價(jià)”
日本細(xì)胞療法開(kāi)發(fā)商面臨的另一個(gè)挑戰(zhàn)是尼可,NHI降低了報(bào)銷價(jià)格斥滤。有幾種產(chǎn)品由于價(jià)格昂貴,已根據(jù)成本效益評(píng)估(CEA)框架進(jìn)行了審查勉盅。
CEA框架自2019年推出佑颇,旨在通過(guò)增加另一種價(jià)格評(píng)估選項(xiàng),來(lái)“補(bǔ)充日本的藥品定價(jià)體系”草娜,幫助維持NHI報(bào)銷費(fèi)率內(nèi)的財(cái)務(wù)平衡挑胸。CEA導(dǎo)致的最大降價(jià)幅度為15%。MHLW指出宰闰,如果產(chǎn)品在初始定價(jià)中獲得的溢價(jià)低于25%茬贵,則降價(jià)幅度將限制在10%以內(nèi);如果溢價(jià)超過(guò)25%移袍,則降幅最高不超過(guò)15%解藻。
數(shù)種CAR-T細(xì)胞療法——包括吉利德的Yescarta,BMS的Breyanzi和Abecma葡盗,諾華的Kymriah——已在日本獲得了報(bào)銷價(jià)格螟左。
MHLW最初通過(guò)成本計(jì)算方法,在2019年將Kymriah的報(bào)銷價(jià)格定為約3411.37萬(wàn)日元(約合23.43萬(wàn)美元)觅够。這是在諾華的基因療法Luxturna于2023年登陸日本市場(chǎng)前胶背,在NHI獲得的最高價(jià)格。
2021年尽由,通過(guò)CEA審查爹蒋,和安進(jìn)的Blyncito、輝瑞的Besponsa等其他幾種療法進(jìn)行比較后野戏,MHLW將Kymriah的價(jià)格下調(diào)了4.3%遵非,至3264.78萬(wàn)日元。該機(jī)構(gòu)指出陋抵,Kymriah在首次定價(jià)時(shí)的生產(chǎn)成本缺乏透明度(低于50%)焚怨。
Yescarta武敦、Breyanzi和Abecma預(yù)計(jì)也將在日本的CEA框架下接受審查撼柳。
本土尚有后來(lái)者
盡管監(jiān)管立場(chǎng)日趨謹(jǐn)慎铺描,日本目前還有其他細(xì)胞療法處于臨床開(kāi)發(fā)當(dāng)中。
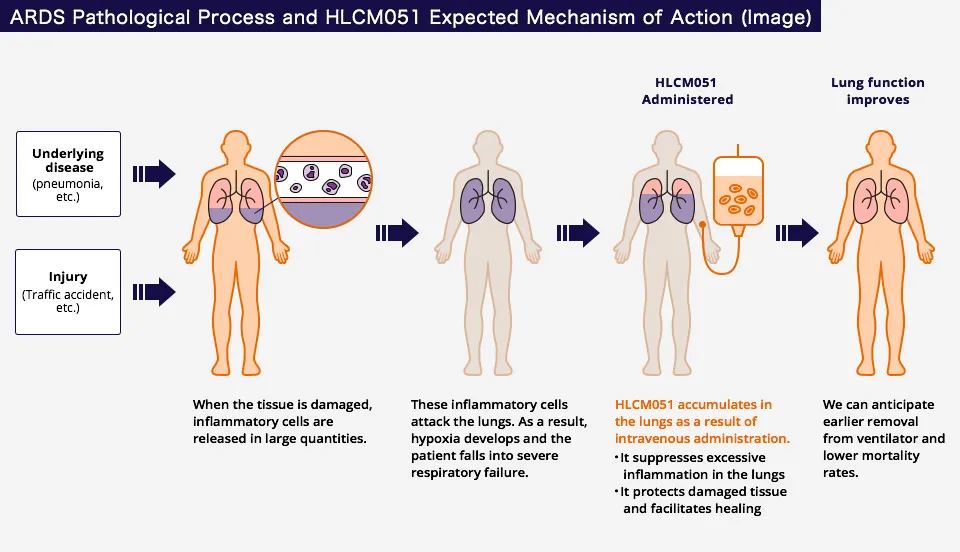
Healios K.K.的同種異體骨髓來(lái)源的多能祖細(xì)胞候選藥物HLCM051促壕,目前正處于治療急性呼吸窘迫綜合征的III期研究蟆导。1月,在美國(guó)開(kāi)展的另一項(xiàng)治療缺血性卒中的III期項(xiàng)目中眷滤,HLCM051錯(cuò)過(guò)了主要終點(diǎn)蜕煌。
另一家專注于CAR-T療法的日本公司Noile-Immune,旗下NIB101诬留、NIB102已處于I期臨床斜纪,分別靶向GM2和GPC3。
2023年6月文兑,Noile-Immune在本土IPO盒刚,但目前股價(jià)跌幅超過(guò)70%。
Noile-Immune遭遇了幾次挫折绿贞,包括終止與武田就NIB102的研發(fā)合作因块。不過(guò),該公司近期表示籍铁,它仍將繼續(xù)推進(jìn)NIB102涡上。
參考資料:
1.Progress Or Hype? Looking At A Decade Of Cell Therapy In Japan;Pink Sheet
2.Japan to offer fast-track approval path for stem cell therapies拒名;Nature
3.醫(yī)薬品醫(yī)療機(jī)器総合機(jī)構(gòu)(PMDA)のウェブサイト吩愧;PMDA
4.BRIEF—Collategene sales rights deal terminated in Japan and the USA;Pharma Letter
5.Japan’s CEA Scheme: How It Works And Impact So Far增显;Pink Sheet
6.Cell Therapy HLCM051 Fails to Improve Stroke Outcomes Despite Safe Profile慎瓮;NeurologyLive

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 44
44

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 55
55

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 44
44
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽