
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生物藥大時代
生物藥大時代  2024-09-20
2024-09-20
 273
273
近期寄菲,在美國召開的全球肺癌大會(WCLC)上舌狗,全球3000多名肺癌頂級專家與會账阳,一款中國研發(fā)的治腫瘤新藥依沃西注射液(AK112)技健,會上獲得潮水般的熱烈掌聲层漠。
依沃西的“頭對頭”三期臨床實驗效果掘鄙,擊敗當下全球“藥王”——美國K藥(默沙東的帕博利珠單抗)胸囱。K藥2023年全球銷售額高達250億美元掌栅,其在免疫治療領域有神一般的地位秩仆,美國食品藥品監(jiān)督管理局(FDA)批準了約40個適應癥上市码泛,幾乎只要涉及免疫治療,標準療法就有K藥澄耍。
迄今噪珊,依沃西單抗是全球首個且唯一在III期單藥"頭對頭"臨床研究中證明療效顯著優(yōu)于K藥的藥物。這意味著依沃西有望挑戰(zhàn)K藥單藥在治療PD-L1 高表達NSCLC 患者的一線地位齐莲,成為下一代免疫治療基石藥物痢站,進一步拓展"去化療"方案適用人群,具有劃時代意義鳖直。
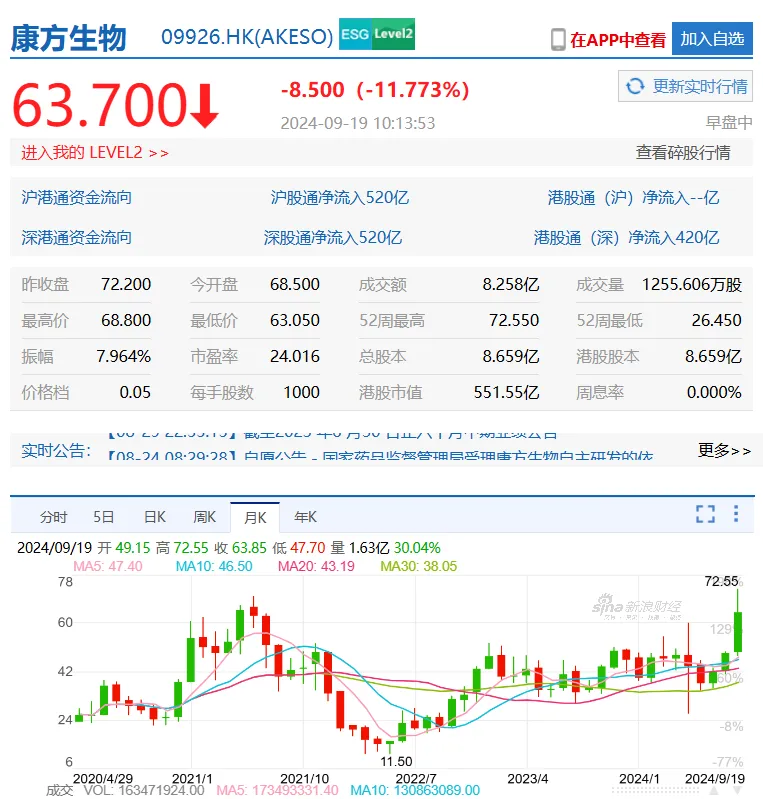
同時悯女,依沃西的原研廠商康方生物及合作伙伴Summit Therapeutics受此消息影響,股價大漲姥咖。
從年內(nèi)低點算起犀震,康方生物股價三個月漲幅超過了270%,市值暴漲396 億港元碟灾;如果從歷史最低位算起禀坝,該公司兩年股價漲幅超過了600%,超越了2021年的高點箭堆。
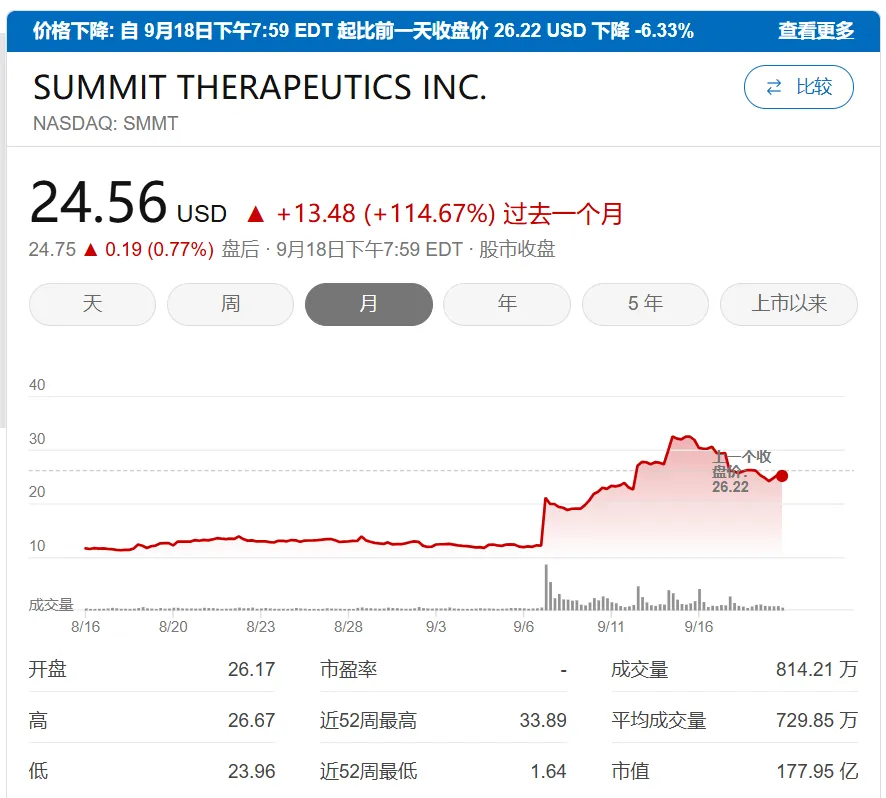
海外合作方Summit Therapeutics Inc.(SMMT 納斯達克)4個月內(nèi)股價上漲12倍几研,市值達231億美元(約1800億港元)。
不過猿异,一些分析人士敦促謹慎行事蚓夺,因為這些數(shù)據(jù)僅來自中國的試驗。
BMO Capital Markets分析師Evan Seigerman表示兢涡,除了最初評估的以中國為重點的患者群體外赛喊,其結(jié)果可能會推廣,也可能不會推廣局待。因為基于FDA的考慮可能需要美國的數(shù)據(jù)斑响。
Mark癌癥研究基金會的CEO Ryan Schoenfeld表示,現(xiàn)在就對依沃西NSCLC的數(shù)據(jù)感到興奮還為時過早钳榨。盡管檢查點抑制劑改變了肺癌患者的曲線舰罚,但仍有很多患者的需求得不到滿足,并且薛耻,有理由認為依沃西可能與K藥聯(lián)合化療相比具有競爭力营罢,有可能使患者免于化療,而化療會帶來疲勞饼齿、惡心和血細胞計數(shù)低等一系列副作用饲漾。
MD安德森癌癥中心專門從事NSCLC研究的Heymach實驗室負責人John Heymach表示同意,無論以何種標準衡量缕溉,這些數(shù)據(jù)都令人印象深刻考传。
有待證明:總體生存率
MPM BioImpact的聯(lián)合管理合伙人Christiana Bardon表示吃型,Summit的數(shù)據(jù)是權(quán)威的,但他們?nèi)狈υ囼灲Y(jié)果總生存期(OS)僚楞。Summit在其新聞稿中表示勤晚,OS數(shù)據(jù)尚不成熟,將在未來進行評估闽芳。
Heymach表示爵路,雖然無進展生存期(PFS)的改善有時不能轉(zhuǎn)化為OS的改善,但鑒于PFS獲益的幅度讹唧,如果這一結(jié)局指標沒有反映出來你浸,那將是令人驚訝的。
Summit可能還需要證明治療指數(shù)的改善剃坦,這可以通過將抗VEGF和抗PD -1作為單獨的治療藥物聯(lián)合使用來實現(xiàn)节暇。根據(jù)Summit的說法,依沃西不僅僅是將兩種療法結(jié)合在一起绝电。雙特異性抗體具有獨特的協(xié)同結(jié)合忿奈,在PD-1和VEGF存在時具有更高的親和力。
需要多樣化的數(shù)據(jù)
鑒于目前的結(jié)果僅來自于中國的試驗默在,F(xiàn)DA 需要看到來自不同人群的更多數(shù)據(jù)才能考慮批準饰址。僅使用中國的數(shù)據(jù)可能會因遺傳學差異、患者隨訪較少以及報告副作用的文化差異等因素而產(chǎn)生偏差跺诈。
Bardon 強調(diào)产舞,在審查僅限中國的數(shù)據(jù)時,安全性以及副作用可能是 FDA考慮 的一個問題菠剩。例如易猫,在 HARMONI-2 中,3 級不良事件很少具壮。與我們在西方人群中看到的情況相比准颓,不良事件可能被低估了。
如果這些數(shù)據(jù)確實在更廣泛的人群中站得住腳棺妓,Summit 可以分得 K藥總年250 億美元銷售額的一部分攘已。雖然康方生物已經(jīng)在其持有權(quán)利的中國獲得了依沃西單抗的批準,但 Summit 的許可能延伸到美國怜跑、加拿大样勃、歐洲、日本妆艘、中美洲彤灶、南美洲和少數(shù)其他市場看幼。
總結(jié)
康方生物/Summit 并不是唯一一家最近宣布了積極結(jié)果的雙特異性開發(fā)者批旺。BioNTech在ESMO 2024上報告稱鹿连,其自身的雙特異性靶向PD-L1和VEGF-A的BNT327在64名中國egfr突變型NSCLC患者的II期試驗中獲得了57.8%的證實客觀緩解。與此同時猪玛,insil Bio及其在中國的合作伙伴ImmuneOnco biopharmacmac?正準備開始一項針對非小細胞肺癌和三陰性乳腺癌的雙特異性抗體SYN-2510/IMM2510的II期試驗磷拧。
雙特異性抗體治療時代已經(jīng)到來。
參考資料:
www.biospace.com

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 44
44

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 55
55

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 44
44