
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥渡
藥渡  2024-09-25
2024-09-25
 525
525
2024年第四季度熏迷,多款備受矚目的創(chuàng)新療法將迎來FDA的審批節(jié)點,可能為多個難治疾病帶來突破性的治療選擇圆乡。這些療法涵蓋了從罕見遺傳病到腫瘤和內(nèi)分泌疾病的廣泛領(lǐng)域掰腌,每一種都有望為患者提供顯著的健康改善。
這些藥物的批準炸渡,不僅對相關(guān)疾病的治療方法可能帶來深遠影響娜亿,也體現(xiàn)了現(xiàn)代藥物研發(fā)在精準醫(yī)學丽已、基因治療和靶向療法等領(lǐng)域的進步。
隨著這些創(chuàng)新藥物的上市決定進入最后審批階段买决,患者沛婴、醫(yī)療從業(yè)者以及整個行業(yè)都對未來幾個月的進展充滿期待。每一項決定都代表著一個新的里程碑督赤,預(yù)示著醫(yī)學的未來可能更加個性化和精準化嘁灯。這些即將做出的審批決定,也將為行業(yè)提供關(guān)鍵的催化劑躲舌,推動未來更多創(chuàng)新療法的研發(fā)和應(yīng)用丑婿。
Upstaza
研發(fā)企業(yè):PTC Therapeutics
模態(tài):基因療法
適應(yīng)癥:AADC缺乏癥
PDUFA日期:2024年11月13日
獲批意義:首款FDA批準的AADC缺乏癥藥物
Eladocagene exuparvovec(Upstaza,艾哌依卡基)是一種基于腺相關(guān)病毒2型(AAV2)的基因治療藥物没卸,能夠表達人體芳香族L-氨基酸脫羧酶(AADC羹奉,aromatic L-amino acid decarboxylase),用于治療AADC缺乏癥约计。
AADC缺乏癥是一種致命且罕見的遺傳性疾病诀拭,導(dǎo)致兒童患者出現(xiàn)嚴重的功能障礙。AADC缺乏癥通常會在嬰兒出生后的頭幾個月導(dǎo)致嚴重的殘疾和痛苦善簸,影響生活的各個方面传撰,包括身體、精神和行為畔香±嗦瘢患有AADC缺乏癥的兒童可能誘發(fā)癲癇樣眼球旋轉(zhuǎn)危象發(fā)作,導(dǎo)致眼睛在頭部向上翻滾猪褐、頻繁嘔吐鼓辈、行為問題和睡眠困難。受影響兒童的生命受到嚴重影響及縮短和蛀。
AADC缺乏癥患者的多巴脫羧酶(DDC)基因發(fā)生突變失跷,導(dǎo)致AADC酶的缺乏。DDC基因編碼AADC酶搂棱,AADC酶負責將L-3,4-二羥基苯丙氨酸(L-DOPA)轉(zhuǎn)化為多巴胺(圖1)叔梆,并將5-羥色氨酸轉(zhuǎn)化為血清素。然而偏控,AADC缺乏癥患者體內(nèi)的突變會導(dǎo)致AADC酶活性的減少或缺失筑凫,導(dǎo)致神經(jīng)遞質(zhì)水平的下降,并導(dǎo)致無法達到發(fā)育里程碑并村。
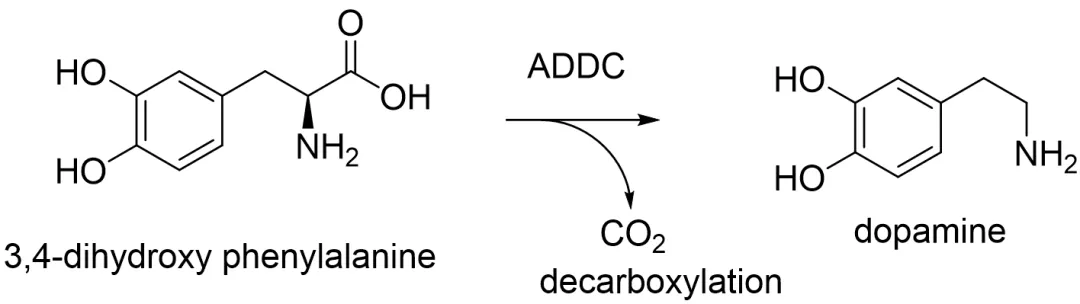
圖1. ADDC催化的3,4-二羥基苯丙氨酸脫羧產(chǎn)生多巴胺的化學過程
Eladocagene exuparvovec通過直接腦部輸注至AADC缺乏癥患者的大腦(殼核)中巍实,促進AADC酶的生成并增加多巴胺水平。使用eladocagene exuparvovec可以改善AADC缺乏癥患者的運動功能發(fā)育。
在臨床試驗中棚潦,接受Upstaza治療的AADC患兒表現(xiàn)出此前未見的運動功能和認知技能進展令漂,如抬頭、坐立或站立以及交流能力丸边,這些改善可持續(xù)長達十年叠必。在三項臨床試驗中,所有患兒的運動發(fā)育在治療后早至三個月內(nèi)均有改善妹窖。Eladocagene exuparvovec于2022年7月獲得了EMA的批準纬朝。在此基因療法獲批之前,AADC缺乏癥患者的治療選擇非常有限嘱吗,主要是通過增加單胺類神經(jīng)遞質(zhì)的產(chǎn)生玄组,抑制單胺氧化酶(MAO)以減少神經(jīng)遞質(zhì)的分解代謝,以及緩解癥狀谒麦。
FDA尚未批準任何AADC缺乏癥的治療方案杏住,Upstaza有望成為美國首個該病癥的治療方法。作為一次性治療援愁,Upstaza有潛力提供持久的療效贫拭,減少持續(xù)性癥狀治療和干預(yù)的需求。FDA已對其BLA授予優(yōu)先審查資格径揭,并指定2024年11月13日為PDUFA日期耍叮。
Zanidatamab
研發(fā)企業(yè):Jazz Pharmaceuticals
模態(tài):單抗
適應(yīng)癥:膽道癌
PDUFA日期:2024年11月29日
獲批意義:首款專門針對膽道癌的HER2靶向療法
Jazz Pharmaceuticals正尋求zanidatamab在美國的批準,用于治療既往接受過治療的雌夕、不可切除的滋评、局部晚期或轉(zhuǎn)移性HER2陽性膽道癌(BTC)。BTC包括膽囊癌和肝內(nèi)膽管癌派憨,占全球成人癌癥的不到1%购廊,且預(yù)后通常較差。人類表皮生長因子受體2(HER2)是其他癌癥抗腫瘤治療的成熟靶點笔碌。在美國刃镶、歐洲和日本,每年約有 12000人被診斷出患有HER2+BTC甚脉。
Zanidatamab是一種雙特異性HER2靶向雙特異性抗體丸升,靶向HER2蛋白的兩個不同表位(雙表位靶向),該蛋白在某些癌細胞表面過度表達牺氨。這種獨特的設(shè)計和增強的結(jié)合可產(chǎn)生多種作用機制狡耻,包括雙重HER2信號阻斷、從細胞表面去除HER2蛋白以及免疫介導(dǎo)的細胞毒性猴凹,從而促進患者的抗腫瘤活性酝豪。
在關(guān)鍵的IIb期HERIZON-BTC-01試驗中涛碑,zanidatamab取得了令人印象深刻的成果精堕,達到了主要臨床終點孵淘,其客觀緩解率為41.3%。Zanidatamab治療的中位總生存期為15.5個月歹篓。歷史數(shù)據(jù)顯示瘫证,標準化療在二線晚期膽道癌患者中的總生存期為6至9個月,因此急需能夠改善生存期的靶向療法庄撮。
雖然背捌,目前已有針對FGFR2基因或IDH1基因突變的膽道癌二線患者的靶向療法獲批,但尚無針對HER2過表達患者的靶向療法湘乐。如果獲批蝌飘,zanidatamab將成為首個專門針對膽道癌的HER2靶向療法。
Zanidatamab由Jazz和百濟神州根據(jù)Zymeworks的許可協(xié)議開發(fā)扇胀,Zymeworks是zanidatamab的首家開發(fā)者跑既。FDA已授予zanidatamab突破性療法認定,并授予 zanidatamab兩項快速通道認定:一項作為難治性BTC的單一藥物忌党,另一項與標準治療化療聯(lián)合用于1L胃食管腺癌 (GEA)轿白。
此外,zanidatamab還獲得FDA授予的治療BTC和GEA的孤兒藥認定铺举,以及EMA授予的治療BTC和胃癌的孤兒藥認定罢摧。Zanidatamab還獲得了國家藥品監(jiān)督管理局藥品審評中心(CDE)授予的突破性療法認定。FDA已授予zanidatamab的BLA優(yōu)先審查資格劫伊,PDUFA日期為2024年11月29日拆聋。
Crinecerfont
研發(fā)企業(yè):Neurocrine Biosciences
模態(tài):小分子
適應(yīng)癥:先天性腎上腺皮質(zhì)增生癥(CAH)
PDUFA日期:2024年12月29/30日
獲批意義:首款CAH的非糖皮質(zhì)激素療法
Crinecerfont是一種口服選擇性促腎上腺皮質(zhì)激素釋放因子1型受體(CRF1受體)拮抗劑,由Neurocrine Biosciences公司開發(fā)姊呐,用于治療經(jīng)典的21-羥化酶缺乏導(dǎo)致的先天性腎上腺皮質(zhì)增生癥(CAH)懒披。
先天性腎上腺皮質(zhì)增生癥是一種罕見的遺傳疾病,會導(dǎo)致酶缺乏翻默,從而改變腎上腺激素的產(chǎn)生缸沃,而腎上腺激素是生命所必需的。大約95%的CAH病例是由突變引起的修械,該突變導(dǎo)致21-羥化酶 (21-OHD) 缺乏趾牧。這種酶的嚴重缺乏會導(dǎo)致腎上腺無法產(chǎn)生皮質(zhì)醇,大約75%的病例無法產(chǎn)生醛固酮肯污。如果不及時治療翘单,CAH會導(dǎo)致鹽流失、脫水甚至死亡蹦渣。
Crinecerfont是一種口服選擇性促腎上腺皮質(zhì)激素釋放因子1型受體 (CRF1) 拮抗劑哄芜,通過不依賴糖皮質(zhì)激素的機制減少和控制過量的促腎上腺皮質(zhì)激素 (ACTH) 和腎上腺雄激素,用于治療因21-羥化酶缺乏引起的CAH。
成人III期數(shù)據(jù)表明认臊,crinecerfont治療在第24周時顯著減少糖皮質(zhì)激素劑量圃庭,同時維持雄烯二酮水平控制。在2至17歲兒童中失晴,crinecerfont治療在第4周時顯著降低雄烯二酮水平剧腻。
Neurocrine Biosciences已提交了crinecerfont膠囊劑型和口服劑型的NDA申請,用于治療兒童滑信、青少年和成人的CAH占找。FDA已對兩項NDA授予優(yōu)先審查資格,PDUFA日期分別為2024年12月29日和2024年12月30日煞恭。目前络务,F(xiàn)DA尚未批準任何用于CAH的非糖皮質(zhì)激素治療方法。如果獲批井翅,crinecerfont將成為70年來首個治療CAH的新藥怠鲜。
參考文獻:
1.PTC Therapeutics Announces FDA Acceptance and Priority Review of the BLA for Upstaza?. PTC Therapeutics Press Release. 14. 05. 2024.
2.Zanidatamab Granted Priority Review for HER2-Positive Metastatic Biliary Tract Cancer. Jazz Pharmaceuticals Press Release. 29. 05. 2024.
3.Neurocrine Biosciences Announces U.S. FDA Accepts New Drug Applications and Grants Priority Review for Crinecerfont for Pediatric and Adult Patients with CAH. PR Newswire. 01. 07. 2024.

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 38
38

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 48
48

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 38
38