
 產業(yè)資訊
產業(yè)資訊
 藥時代
藥時代  2024-09-27
2024-09-27
 250
250
引言
細胞和基因治療(Cell and Gene Therapies, “CGT”)具有廣闊前景蚤岗,國家層面對于推動這一領域的產業(yè)發(fā)展給予了極大的重視和支持。然而锤躁,在外商投資領域榨咐,我國自2007年起便禁止外商投資人體干細胞、基因診斷與治療技術開發(fā)和應用領域棍厂。從產業(yè)發(fā)展的角度來看纹怨,禁止外商投資的政策一方面可能與國家最新的堅持開放吸引和利用外資的政策不相吻合常枢;另一方面,相關產業(yè)缺少多元化主體參與和貢獻猛蔽,則會對產業(yè)的積極發(fā)展造成資金短缺等阻礙剥悟。因此,在風險可控的前提下曼库,加大CGT領域外商投資開放力度区岗,應是針對如何最大限度發(fā)揮吸引和利用外資在CGT領域積極作用問題最好的“下一步工作安排”之一。
基于上述背景毁枯,本文以下針對通過回顧我國CGT領域相關發(fā)展政策和現(xiàn)狀慈缔,總結CGT領域外商投資準入新政策出臺情況及其影響,最后提出相關展望和合規(guī)關注要點建議种玛,拋磚引玉藐鹤,并期待能與讀者進一步探討和持續(xù)跟進CGT領域外商投資準入新政策及其后續(xù)發(fā)展情況。
CGT領域相關發(fā)展政策和現(xiàn)狀回顧
(一)基因治療和細胞治療藥物蒂誉、新型基因教藻、蛋白和細胞診斷設備已列于我國《產業(yè)結構調整指導目錄(2024年本)》鼓勵類目錄
在我國距帅,產業(yè)被認為是經濟發(fā)展的關鍵所在右锨,是國家的立國之本。產業(yè)結構調整指導目錄則是引導社會投資方向碌秸、政府管理投資項目绍移,制定實施財稅等政策的重要依據,其包括鼓勵尖蚪、限制和淘汰三類目錄啤盯,分別對應于國家支持發(fā)展的產業(yè)、需要控制發(fā)展的產業(yè)和需要淘汰的產業(yè)嫉簿。
《產業(yè)結構調整指導目錄(2019年本)》(已失效)首次將細胞治療藥物和基因治療藥物以及新型基因抬而、蛋白和細胞診斷設備納入鼓勵類目錄項下,在2024年新修訂的《產業(yè)結構調整指導目錄(2024年本)》鼓勵類目錄中封鹦,基因治療和細胞治療藥物以及新型基因墓老、蛋白和細胞診斷設備仍在列。

(二)中國堅持開放晾游,吸引和利用外資
2024年2月28日辽蚀,國務院辦公廳出臺《扎實推進高水平對外開放更大力度吸引和利用外資行動方案》(“國辦發(fā)〔2024〕9號”)明確指出要扎實推進高水平對外開放、更大力度吸引和利用外資丽信。同時提出開展放寬科技創(chuàng)新領域外商投資準入試點方面的工作安排泳落,允許北京、上海物忠、廣東等自由貿易試驗區(qū)選擇若干符合條件的外商投資企業(yè)在基因診斷與治療技術開發(fā)和應用等領域進行擴大開放試點婚被。
另外狡忙,國辦發(fā)〔2024〕9號文還提出了擴大合格境外有限合伙人試點范圍,規(guī)范合格境外有限合伙人管理企業(yè)及基金在注冊資本址芯、股東等方面的要求去枷,拓寬基金可以投資的范圍等內容;其后是复,天津市1删顶、廣東省2、福州市3等直轄市淑廊、省及地級市陸續(xù)出臺了與吸引和利用外資相關的獎勵政策逗余。
(三)中國的生物安全風險防控能力已有較大提升
隨著《生物安全法》《人類遺傳資源管理條例》《人類遺傳資源管理條例實施細則》等法律文件的陸續(xù)出臺施行,我國人類遺傳資源監(jiān)管逐步實現(xiàn)系統(tǒng)化季惩,監(jiān)管水平得到顯著提升录粱。
隨著《黨和國家機構改革方案》落地及推進實施,科技部向國家衛(wèi)生健康委員會移交了主管人類遺傳資源的職責画拾,在生物安全方面啥繁,我國已逐漸構筑人類遺傳資源方面的生物安全防控體系,近年來我國的生物安全風險防控能力不斷提升摊矮,并且仍在持續(xù)完善头熏。
(四)行業(yè)發(fā)展因外資限制造成一定的不良影響
1.行業(yè)分類角度并不一定能夠完整劃定外資鼓勵和外資限制的邊界
在現(xiàn)行的《鼓勵外商投資產業(yè)目錄(2022年版)》中,涉及兩項與細胞和基因治
療相關的項目影偶,其一是在“醫(yī)藥制造業(yè)”項下的“細胞治療藥物研發(fā)與生產(禁止外商投資領域除外)”转挽,其二是在“專用設備制造業(yè)”項下的“全自動生化監(jiān)測設備、五分類血液細胞分析儀确羹、全自動化學發(fā)光免疫分析儀届审、高通量基因測序系統(tǒng)、分子診斷設備制造”癣偶。而《外商投資準入特別管理措施(負面清單)(2024年版)》中噪旭,“禁止投資人體干細胞、基因診斷與治療技術開發(fā)和應用”歸在了“科學研究和技術服務業(yè)”項下恃楔。
分類的不同似乎為劃分上述 “制造業(yè)”垢蔑、“醫(yī)藥制造業(yè)”、“專業(yè)設備制造業(yè)”和“科學研究和技術服務業(yè)”之間的邊界和厘清其是否存在交叉提供了論述方向和依據协固,然而該假設并不一定成立溢傅,主要理由如下:
首先,參照適用于在統(tǒng)計芋忿、計劃炸客、財政、稅收戈钢、工商等國家宏觀管理的《國民經濟行業(yè)分類GB/T 4754-2017》的規(guī)定痹仙,經濟活動被劃分為門類是尔、大類、中類和小類四級开仰。其中拟枚,“制造業(yè)”和“科學研究和技術服務業(yè)”均屬于“頂級”的門類,“醫(yī)藥制造業(yè)”和“專用設備制造業(yè)”均為“制造業(yè)”項下的大類众弓,“研究和試驗發(fā)展”則是“科學研究和技術服務業(yè)”項下的一個核心大類恩溅,其從屬關系如下圖所示:
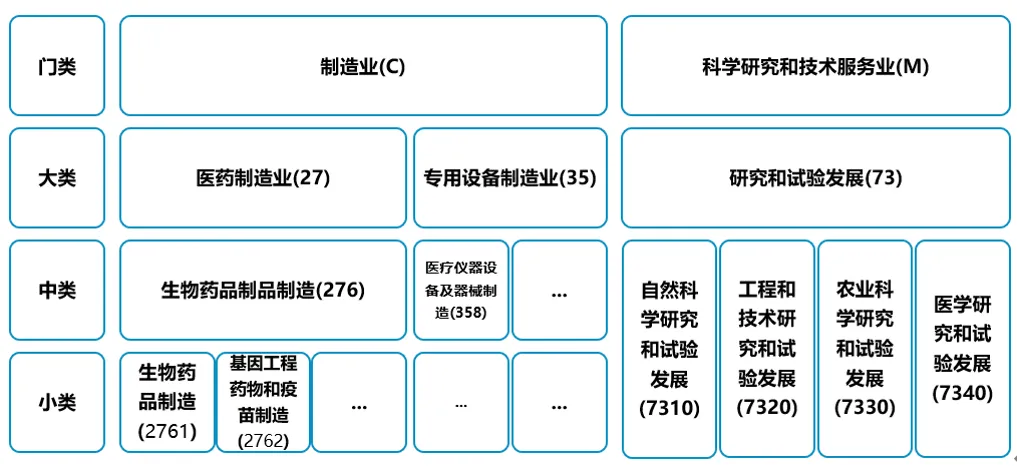
《國民經濟行業(yè)分類GB/T 4754-2017》針對“制造業(yè)”和“研究和試驗發(fā)展”的定義分別如下:
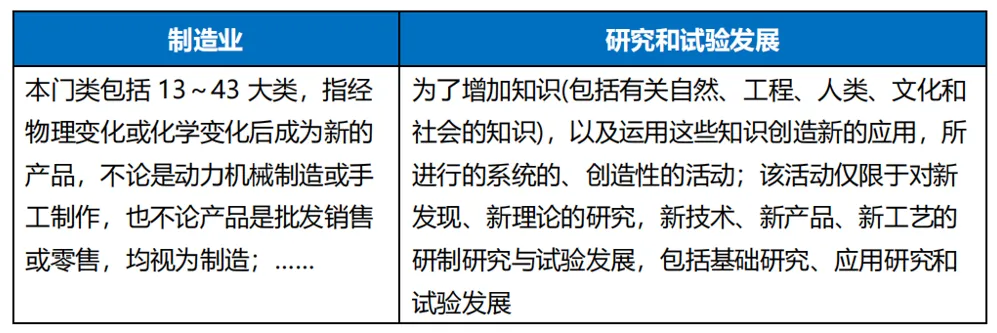
結合實踐情況來看,大部分創(chuàng)新藥品或者醫(yī)療器械的注冊上市或生產并非“一日之功”谓娃,其通常需要經歷較長的研發(fā)/研制脚乡、非臨床/臨床試驗發(fā)展的過程,筆者傾向于理解滨达,前述活動可構成從事與“技術開發(fā)和應用”相關的活動奶稠。
其次,筆者亦注意到恃打,《國民經濟行業(yè)分類GB/T 4754-2017》規(guī)定钟唯,當單位從事一種經濟活動時,則按照該經濟活動確定單位的行業(yè)市缠;當單位從事兩種以上的經濟活動時焚痰,則按照主要活動確定單位的行業(yè)∨ケ瘢基于前述規(guī)定不難理解和得出相應結論锄菊,當一個單位屬于某一行業(yè)時游颅,其可能從事兩種以上經濟活動湿铃,換言之,當一個單位屬于制造業(yè)時诞昧,并不妨礙其除了從事制造業(yè)相關經濟活動外碉办,還從事研究和試驗發(fā)展相關的活動。
因此步嘹,筆者傾向于理解虐干,對于尚不涉及生產或制造的Biotech企業(yè)或者醫(yī)療器械企業(yè)而言,其從事的藥品研發(fā)或者醫(yī)療器械研制活動顯然屬于技術開發(fā)或應用活動肘习,倘若相關技術屬于基因診斷技術或者基因治療技術的际乘,仍需要確保遵守外商投資的規(guī)定∑澹回歸問題本身脖含,或許還是因為沒有統(tǒng)一的正式文件針對何為“基因診斷和治療技術應用和開發(fā)”作出明確的釋義和說明。
2.實踐理解存在差異且邊界不清
基于上述規(guī)定投蝉,筆者在理解《外商投資準入特別管理措施(負面清單)(2024年版)》中關于“基因診斷和治療技術開發(fā)和應用”的禁止外商投資規(guī)定時养葵,確實會對何為“基因診斷和治療技術”征堪,以及相關活動是否會歸入“相關技術開發(fā)和應用”范疇存在一定的困惑。從實例來看关拒,實踐中對此亦有不同的觀點佃蚜,例如:
(1) 永泰生物(6978.HK)在其招股文件中認為,其所從事的創(chuàng)新細胞療法涉及基因治療技術與產品開發(fā)及應用着绊,屬于禁止類領域活動谐算,故其采用了合約安排(VIE架構、協(xié)議控制架構)归露,不直接或間接持有從事相關業(yè)務的并表聯(lián)屬實體的任何股權匙杏。4
(2) 傳奇生物(LEGN.NASDAQ)在其招股文件中認為,南京傳奇生物科技有限公司(“南京傳奇”)目前正在研發(fā)的CAR-T細胞療法不涉及使用人類干細胞或基因診斷和治療技術布橄,因此不應歸入“人類干細胞或基因診斷及治療技術”的范疇充陷,但其也保留若政府監(jiān)管意見發(fā)生變化等導致其被禁止從事此類技術的研究的,其可能選擇停止對南京傳奇的投資或考慮將南京傳奇重組為中國國內實體和傳奇生物的可變利益實體(VIE架構荠涂、協(xié)議控制架構)徊儿。5
上述兩個已上市企業(yè)對于其所從事業(yè)務是否涉及“人類干細胞或基因診斷和治療技術開發(fā)及應用”存在截然不同的觀點,但筆者也注意到上述企業(yè)上市時間早于《境內企業(yè)境外發(fā)行證券和上市管理試行辦法》(中國證監(jiān)會裙靶,2023年3月31日起施行)泼剩,參考意義有限。盡管如此犹喜,筆者傾向于理解瓜释,由于缺乏統(tǒng)一的正式文件就“基因診斷和治療技術開發(fā)和應用”做出細化明確規(guī)定,在境內外上市或者監(jiān)管執(zhí)法等實踐場景中阎敬,針對CGT領域企業(yè)是否符合國家產業(yè)政策和外商投資準入等相關規(guī)定的判斷险锻,較有可能需要行業(yè)主管部門就個案進行判斷并出具的監(jiān)管意見等文件為準。
3.一定程度上導致未能充分發(fā)揮利用外資的積極作用
受到外商投資準入方面的限制魄帽,實踐中美元基金等外資資金的投資領域會將涉及干細胞现喳、基因診斷或基因治療等領域的企業(yè)排除在投資范圍之外,基本上不會考慮投資涉及前述領域的企業(yè)犬辰;另一方面嗦篱,涉及前述領域的企業(yè)在融資時也會基于合規(guī)性和可持續(xù)發(fā)展等考慮,不會接受涉及外資成分的資本投資幌缝。
近年來灸促,在資本退出渠道上監(jiān)管要求的變化,一定程度上加劇了前述情況的“惡性循環(huán)”涵卵。在《境內企業(yè)境外發(fā)行證券和上市管理試行辦法》施行前浴栽,境內Cart-T領域企業(yè)主要以協(xié)議控制架構方式避免直接或間接投資,但是《境內企業(yè)境外發(fā)行證券和上市管理試行辦法》施行后缘厢,此類企業(yè)若希望赴境外上市吃度,其所采用前述協(xié)議控制架構屬于間接發(fā)行甩挫,仍需要適用備案的規(guī)定,并且其境內律師應就是否涉及外商投資限制或禁止領域方面進行核查說明并向證監(jiān)會報告椿每。整體而言伊者,一定程度上導致未能充分發(fā)揮利用外資的積極作用,對CGT相應領域企業(yè)更大的發(fā)展突破帶來一定的阻礙砂腰。
CGT領域外商投資準入開放現(xiàn)狀
(一)CGT領域外商投資準入新政策出臺
2024年9月7日托津,商務部、國家衛(wèi)健委潘娄、國家藥監(jiān)局聯(lián)合發(fā)布《關于在醫(yī)療領域開展擴大開放試點工作的通知》(“《擴大開放試點通知》”)嚎姨,受文的對象為前述部、委及國家局下轄的三個直轄市(北京市持拐、天津市勘职、上海市)和四個省份(江蘇省、福建省啰哪、廣東省略菜、海南省)的商務、衛(wèi)生健康侵宝、人類遺傳資源池粘、藥品監(jiān)督管理主管部門。
《擴大開放試點通知》重點通知了生物技術領域和獨資醫(yī)院領域的兩個事項省喝,其中生物技術領域方面胆誊,在四地(北京、上海肛度、廣東傻唾、海南)的自由貿易區(qū)/港允許外商投資企業(yè)從事人體干細胞、基因診斷與治療技術開發(fā)和技術應用贤斜,以用于產品注冊上市和生產策吠。
從整體來看,《擴大開放試點通知》屬于框架性的統(tǒng)籌安排瘩绒,具體實施還需要試點區(qū)域的主管部門確定落地實施的細節(jié),例如生物技術領域方面带族,相關企業(yè)如何成為試點外商投資企業(yè)以及是否需要進一步滿足一定的條件等事項有待相關主管部門的進一步澄清锁荔。就細節(jié)而言,《擴大開放試點通知》并非完全開放蝙砌,而是有一定的保留:
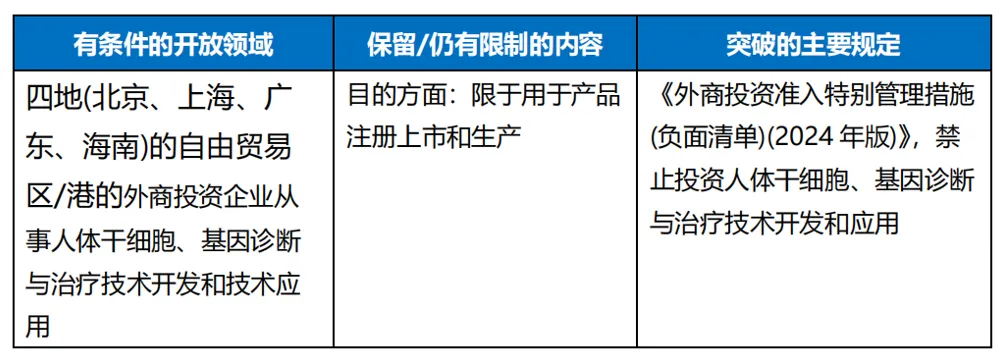
(二)新政策或能部分“緩解”正式文件的缺位導致的影響
實踐中對于“人體干細胞阳堕、基因診斷與治療技術開發(fā)和應用”的理解一直存在概念不完整和邊界不清晰的情況≡窨耍《擴大開放試點通知》的出臺讓部分可能涉及人體干細胞恬总、基因治療技術開發(fā)和應用的企業(yè)前普,得以依據《擴大開放試點通知》而概括性符合外商投資準入的要求。盡管筆者試圖從行業(yè)分類的角度去厘清相關邊界的問題辱雅,但結論是從上述行業(yè)分類的現(xiàn)有規(guī)定并不一定能夠完整劃定外商鼓勵和限制邊界麦荸。
筆者傾向于理解,在何為“人體干細胞怨颜、基因診斷與治療技術開發(fā)和應用”被正式文件準確清楚地定義或說明前喷融,等待其他省市地區(qū)爭取獲批加入開放試點或企業(yè)直接遷往試點區(qū)域加入開放試點,或許是前述處于模糊領域的企業(yè)消除障礙或消極影響的有效途徑之一夯架。
CGT領域外商投資準入展望和合規(guī)關注要點建議
(一)外商投資鼓勵目錄或將迎來更新
國辦發(fā)〔2024〕9號文除了開展放寬科技創(chuàng)新領域外商投資準入試點提出要求外淹摧,還提出全國鼓勵外商投資產業(yè)目錄加大對先進制造、高新技術批痘、節(jié)能環(huán)保等領域的支持力度钾抛,積極支持生物醫(yī)藥、高端裝備等領域外資項目納入重大和重點外資項目清單舌恬,允許享受相應支持政策等方面的要求沈路。對此,筆者理解谓墨,外商投資鼓勵目錄或有望在2025年1月1日前修訂與出臺加六,未來將會有更多涉及且惠及CGT領域企業(yè)的鼓勵政策。
(二)協(xié)議控制架構或不會被優(yōu)先考慮
《擴大開放試點通知》為符合外商投資政策提供了合規(guī)路徑怒见,在赴境外上市中俗慈,為規(guī)避構成投資禁止投資領域而采用的協(xié)議控制架構模式,在《境內企業(yè)境外發(fā)行證券和上市管理試行辦法》施行后基本上沒有了優(yōu)勢遣耍,對于未來計劃前往境外上市的CGT領域企業(yè)而言闺阱,或不會優(yōu)先考慮采取協(xié)議控制架構,而是轉向將企業(yè)直接遷至相應的開放試點區(qū)域舵变。但是其中具體實施方式酣溃,是公司注冊地點嚴格搬入試點區(qū)域,還是僅經營地址或辦公地址等遷入即可纪隙,有待地方主管部門進一步明確和細化赊豌。
(三)相應配套制度有望細化及明確,建議持續(xù)保持關注
筆者注意到绵咱,《擴大開放試點通知》在最后針對相關主管部門提出了要按照職責分工碘饼,加大政策宣傳力度,主動對接有意愿的外商投資企業(yè)并加強服務相應的工作要求悲伶。后續(xù)各地或將出臺更加細化及明確的配套制度或者工作方案艾恼,對于有意向的外商投資企業(yè),建議持續(xù)保持關注,也可以與擬前往的試點區(qū)域主管部門持續(xù)保持聯(lián)系执摆。
(四)科創(chuàng)板審核問詢動態(tài)值得進一步跟進與觀察
據筆者觀察柒拌,某CGT領域公司在上市審核問詢中被問及從事免疫細胞治療業(yè)務是否符合行業(yè)準入要求,而該公司在答復時披露其存在間接的外資持股情況缅叔,并認為其目前從事免疫細胞治療業(yè)務符合行業(yè)準入要求脉裕,得出前述結論對應的分析理由主要包括四個方面:(1)外資間接持股比例較低,實際控制人和主要管理層(現(xiàn)任董事完株、高級管理人員以及核心技術人員)均為中國籍置凤;(2)所屬行業(yè)為醫(yī)藥制造業(yè);(3)遵守人類遺傳資源監(jiān)督管理規(guī)定颁殃,未受到處罰辐杜;(4)無違法等情況。
筆者理解上述答復和分析具有一定的合理性显钙,該案例的后續(xù)進展情況一定程度上能夠體現(xiàn)或者反映出上市審核部門對類情形的審核口徑拿杉,故其后續(xù)動態(tài)值得進一步跟進與觀察。6
(五)更多投資并購或創(chuàng)新BD合作項目或將在中國涌現(xiàn)
CGT領域作為前沿技術绑雄,包括諾華展辞、BMS等MNC企業(yè)都在積極布局該領域,我國CGT領域亦涌現(xiàn)了諸多備受行業(yè)矚目的技術產品管線万牺,《擴大開放試點通知》出臺使得以往只能發(fā)生在海外的交易罗珍,將可以在中國境內層面直接實現(xiàn),并且交易成本及交易時間或可以大幅降低脚粟。因此覆旱,不排除外資背景的MNC企業(yè)會通過投資并購股權或者創(chuàng)新BD合作等形式取得境內企業(yè)的相關技術產品管線權益;對于境內企業(yè)而言核无,也可以借此機會提前規(guī)劃和籌備扣唱,以更好接受外資背景企業(yè)或資本的投資或合作。
(六)CGT外資準入后的其他合規(guī)關注要點
值得關注的是团南,外商投資準入限制的取消并未豁免應當現(xiàn)行制度框架下的合規(guī)要求噪沙,《擴大開放試點通知》中對此也有重點提及,要求擬進行試點的外商投資企業(yè)應符合人類遺傳資源管理吐根、藥品臨床試驗(含國際多中心臨床試驗)正歼、藥品注冊上市、藥品生產佑惠、倫理審查等規(guī)定要求侠呛。基于筆者以往在CGT領域的法律實務和項目經驗凯践,在外資準入部分放開后,CGT相關企業(yè)仍需關注如下合規(guī)要點:
1.人類遺傳資源管理合規(guī)關注要點
實踐中,開展細胞和基因治療技術研究可能或涉及到人類遺傳資源的應用或傳輸符站。此類活動主要受到《生物安全法》《人類遺傳資源管理條例(2024修訂)》及《人類遺傳資源管理條例實施細則》等法律法規(guī)的調整與規(guī)定卖寻。若相關企業(yè)構成《人類遺傳資源管理條例(2024修訂)》所規(guī)定外方單位,其將不得向境外提供中國人類遺傳資源7弯沥;就臨床試驗而言除阐,需要采取與中國科研機構、高等學校鸳辛、醫(yī)療機構消贼、企業(yè)(“中方單位”)合作的方式進行等。
2.臨床研究(臨床試驗)合規(guī)關注要點
根據《擴大開放試點通知》的規(guī)定舒疚,允許外商投資從事的相關活動附加了“以用于產品注冊上市和生產”的描述异凹,在我國,臨床研究(試驗)主要分為兩種兜畸,分別是:(1)研究者發(fā)起的臨床研究(Investigator-Initiated Clinical Trial, “IIT”)努释;(2)醫(yī)藥企業(yè)發(fā)起的藥物臨床試驗(Industry-Sponsored Clinical Trial, “IST”), 以相關產品注冊為目的。
因此咬摇,基于現(xiàn)有規(guī)定伐蒂,上述外商投資企業(yè)是否能夠資助及開展不以相關產品注冊為目的的IIT,較有可能需要主管部門進一步澄清相關細節(jié)肛鹏,否則可能會存在合規(guī)層面的障礙或瑕疵逸邦,考慮到目前仍在試點階段,不排除未來會有調整與完善的空間在扰。此外缕减,各地具體實施細則是否會就此作出進一步安排則有待觀察。
3.臨床試驗數(shù)據合規(guī)性和真實性要點
根據《藥品管理法(2019修訂)》與《最高人民法院健田、最高人民檢察院關于辦理危害藥品安全刑事案件適用法律若干問題的解釋(2022)》的有關規(guī)定烛卧,臨床試驗數(shù)據合規(guī)性和真實性若存在問題,需要根據行為的嚴重情況承擔行政責任乃至刑事責任妓局。
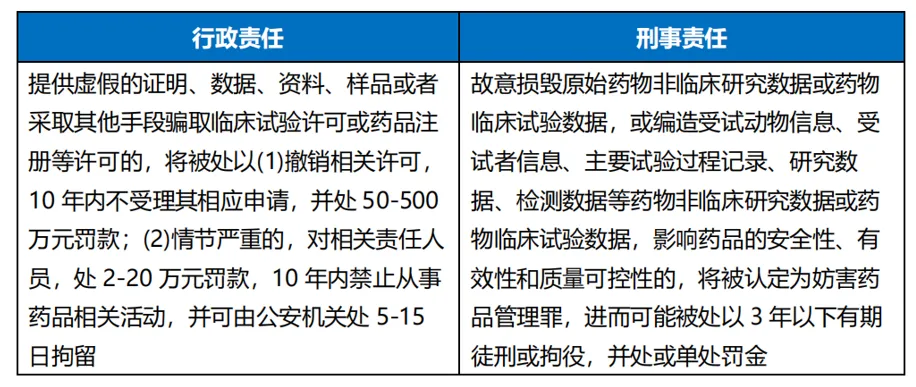
此外总放,主管機關實施的延伸檢查制度有可能會對CRO企業(yè)進行延伸檢查,若相關單位委托CRO開展臨床試驗的好爬,需要注意加強對CRO的監(jiān)督管理侥嫂,并在合同約定層面就臨床試驗數(shù)據的合規(guī)性和真實性作出相關安排。
4.運營資質條件合規(guī)監(jiān)管要點
CGT領域企業(yè)在藥物研發(fā)蒸撕、注冊莽入、生產、經營跑放、使用的全生命周期都需要關注和滿足運營資質條件的合規(guī)監(jiān)管要求押棋,否則將面臨不同程度的法律后果,具體而言:
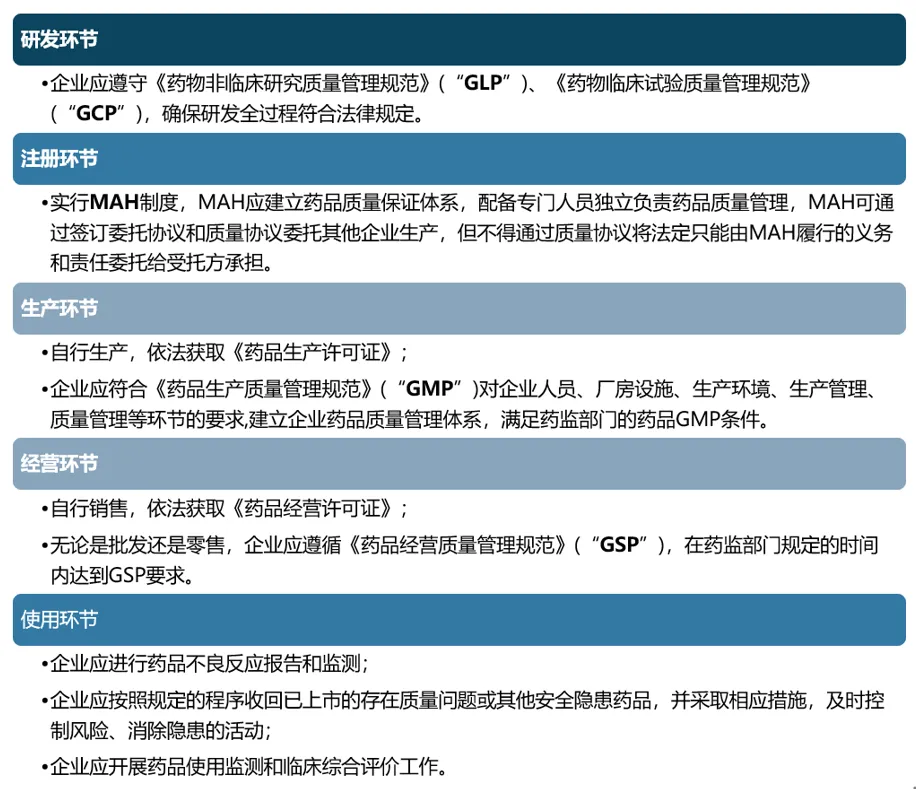
此外,對于開展干細胞范益、免疫細胞療法研究的機構及企業(yè)天枣,在研發(fā)環(huán)節(jié),還應特別符合《干細胞臨床研究管理辦法(試行)》《體細胞臨床研究工作指引(試行)》及參照《體細胞治療臨床研究和轉化應用管理辦法(試行)(征求意見稿)》的規(guī)定要求虫犀。
5.技術進出口管制合規(guī)要點
2023年12月21日袖指,商務部、科技部公布《中國禁止出口限制出口技術目錄》证莺,其中將用于人的精細克隆和基因編輯技術中具有倫理爭議熟什,且可產生重大危害,用于對含有遺傳物質的人體生殖細胞(即胚胎細胞猜旬、卵子細胞脆栋、精子細胞)進行編輯的基因編輯技術列為禁止出口技術。
根據《技術進出口管理條例》的規(guī)定昔馋,屬于禁止出口的技術筹吐,不得出口;否則依照刑法關于走私罪秘遏、非法經營罪丘薛、泄露國家秘密罪或者其他罪的規(guī)定,依法追究刑事責任邦危;尚不夠刑事處罰的洋侨,區(qū)別不同情況,依照海關法的有關規(guī)定處罰倦蚪,或者由國務院外經貿主管部門給予警告希坚,沒收違法所得,處違法所得1-5倍的罰款陵且;國務院外經貿主管部門并可以撤銷其對外貿易經營許可裁僧。此外,從民事角度垃准,還可能存在技術出口合同無效的法律風險智榆。
尾言
《擴大開放試點通知》允許外商投資企業(yè)在試點區(qū)域從事人體干細胞、基因診斷與治療技術開發(fā)和應用領域的新政策儿趋,邁出了落實持續(xù)推進生物醫(yī)藥領域擴大開放要求的一大重要腳步档低,同時為CGT領域企業(yè)的合規(guī)發(fā)展帶來更多選擇和機會。仍有待進一步觀察的是蛔乖,四個試點區(qū)域究竟會如何細化落實細則梭甸、是否會借此機會落實與之配套的吸引和引用外資的鼓勵政策等。
此外赃剂,建議相關外商投資企業(yè)予以關注蜜雏,《擴大開放試點通知》僅僅是在準入端部分放開了外商禁止投資領域韩烹,并沒有就其他方面監(jiān)管要求做出豁免,“萬里長征第一步”拒凝,相關企業(yè)仍需要遵守或符合如人類遺傳資源合規(guī)腰凫、臨床試驗開展及數(shù)據合規(guī)泞驴、業(yè)務運營合規(guī)牢裳、技術出口合規(guī)等方面的合規(guī)要求,以避免招致或減少承擔相應的法律責任和風險叶沛。
最后蒲讯,筆者期待,外商投資人體干細胞灰署、基因診斷與治療技術開發(fā)和應用領域的四個試點放開判帮,能夠起到“以點帶面、帶頭示范”的效果溉箕,推動該等政策動向在更多地方的自由貿易區(qū)乃至全國范圍的推行和實施晦墙,發(fā)揮外商投資優(yōu)勢,促進CGT相應領域藥物等產品的研發(fā)和注冊上市肴茄,滿足未被滿足的臨床需求晌畅,最終惠及國內外患者。

 產業(yè)資訊
產業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 34
34

 產業(yè)資訊
產業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 43
43

 產業(yè)資訊
產業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 34
34