
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥通社
藥通社  2024-09-27
2024-09-27
 209
209
9月25日麸奇,CDE承辦了磷酸蘆可替尼乳膏進(jìn)口上市申請,受理號JXHS2400073岭笔,持有人Incyte Biosciences,從康哲藥業(yè)公告看出此次申報的是白癜風(fēng)適應(yīng)癥辖狞。


補充一下钻国,康哲藥業(yè)是2022年底從Incyte引進(jìn)磷酸蘆可替尼乳膏中國權(quán)益,算是根據(jù)企業(yè)(康哲美麗)自身優(yōu)勢和戰(zhàn)略發(fā)展License in的典型案例之一孩置。

因為是全球進(jìn)展最快的白癜風(fēng)藥物燎称,筆者跟蹤過這個藥物已有七八年,發(fā)表的三期臨床文章顯示其安全且有效罚栏,是目前歐美國家唯一批準(zhǔn)的外用白癜風(fēng)復(fù)色藥物贩溉。

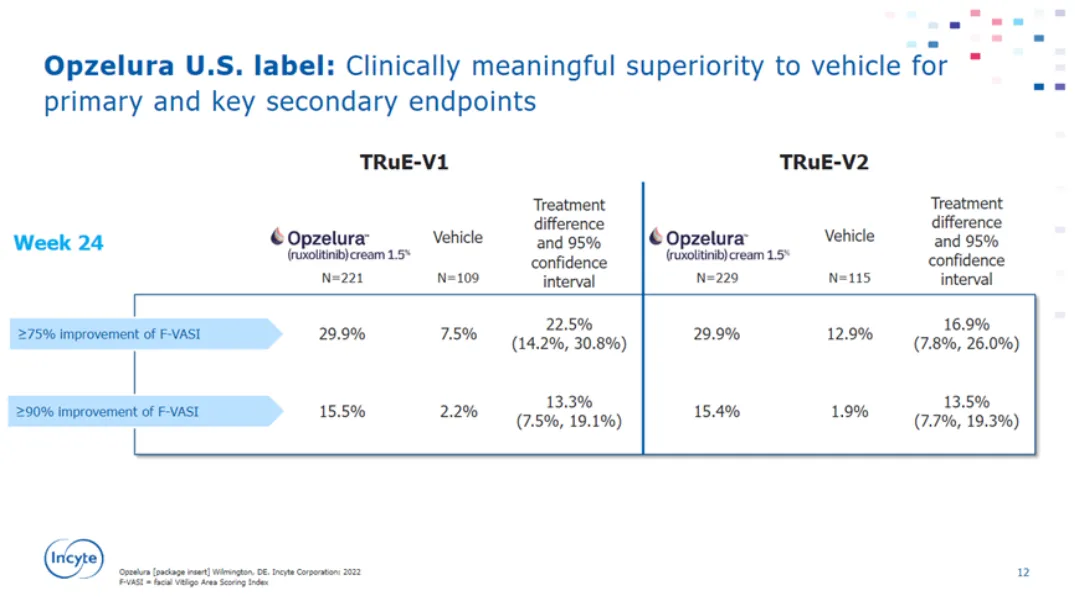
根據(jù)康哲藥業(yè)公告:“蘆可替尼乳膏在中國真實世界研究中取得了積極結(jié)果。治療組主要療效指標(biāo)第24周達(dá)到F-VASI 75的患者比例為49.5%(有效性絕對百分?jǐn)?shù)高于海外增捻,預(yù)計是用藥人群基線皮損面積低于海外)膨桂,顯著高于目標(biāo)值14.1%(P<0.0001)(參考《藥物真實世界研究設(shè)計與方案框架指導(dǎo)原則(試行)》中目標(biāo)值對照的定義),研究達(dá)到了主要終點锥惋,證明產(chǎn)品能夠有效治療非節(jié)段型白癜風(fēng)患者昌腰,縮小皮損面積,恢復(fù)膚色净刮。
所有的次要療效指標(biāo)均顯示出與主要療效指標(biāo)一致的獲益趨勢剥哑,且治療時間越長,患者的白癜風(fēng)治療效果持續(xù)改善淹父。不良反應(yīng)的嚴(yán)重程度大部分均為1級或2級株婴,未發(fā)生導(dǎo)致停藥或退出的不良事件(AE),未發(fā)生研究藥物相關(guān)的嚴(yán)重不良事件(SAE)暑认±Ы椋”根據(jù)康哲半年報:“已超過3200例患者使用了蘆可替尼乳膏進(jìn)行治療”。預(yù)計是原研基于白癜風(fēng)治療真實世界研究蘸际,干預(yù)性研究實用臨床試驗(Pragmatic Clinical Trial座哩,PCT)單臂設(shè)計,獲得藥物的有效性和安全性信息粮彤,為新藥注冊上市提供支持性證據(jù)根穷。受益于國家賦予海南自由貿(mào)易港、博鰲樂成國際醫(yī)療旅游先行區(qū)(先行先試)特許政策外蓝漏,同時看到Incyte和康哲美麗在CDE登記了白癜風(fēng)和特應(yīng)性皮炎兩個適應(yīng)癥的注冊性三期臨床研究(CTR20241697诽怨、CTR20240457)。
1)真實世界研
究國家藥監(jiān)局藥品審評中心自2018年開始啟動真實世界研究相關(guān)工作吭匀,近幾年在制定技術(shù)指導(dǎo)原則食云、開展應(yīng)用試點以及建立工作機制等方面取得積極成效,如:《真實世界證據(jù)支持藥物注冊申請的溝通交流指導(dǎo)原則(試行)》螺城、《藥物真實世界研究設(shè)計與方案框架指導(dǎo)原則(試行)》痒池、《用于產(chǎn)生真實世界證據(jù)的真實世界數(shù)據(jù)指導(dǎo)原則(試行)》、《真實世界研究支持兒童藥物研發(fā)與審評的技術(shù)指導(dǎo)原則(試行)》躬伐、《真實世界證據(jù)支持藥物研發(fā)與審評的指導(dǎo)原則(試行)》凉陌;已批準(zhǔn)多個完全基于真實世界研究申報上市的新藥,如:氟輕松玻璃體植入劑吵墅、普拉替尼等益柳。
2)仿制扎堆
就憑中國有約1400萬白癜風(fēng)患者,約2300萬輕中度特應(yīng)性皮炎患者枫演,兼有醫(yī)美概念捕谢,市場潛力巨大,企業(yè)扎堆是必然的酵熙。磷酸蘆可替尼乳膏算是近兩年企業(yè)立項布局的重點品種轧简,無論是傳統(tǒng)外用企業(yè),如重慶華邦制藥有限公司匾二、江蘇知原藥業(yè)股份有限公司哮独,還是高效率產(chǎn)出的CXO,如蘇州高邁察藐、杭州領(lǐng)業(yè)皮璧、長沙晶易舟扎、南京樟益等,筆者猜測都應(yīng)該在做了吧悴务!該品種除了Q1睹限、Q2、Q3研究難度外讯檐,臨床開發(fā)路徑也是很多仿制企業(yè)一直很關(guān)心的問題羡疗。
3)臨床怎么做
目前原研正在申請進(jìn)口中,仿制分為3類和4類别洪。臨床試驗設(shè)計與前兩年的熱門品種克立硼羅做過健康人的BE是不一樣的叨恨。重慶華邦制藥有限公司搶先一步已按3類境內(nèi)申請人仿制境外上市但境內(nèi)未上市原研藥品的藥品申請臨床,由于蘆可替尼乳膏在健康人皮膚給藥預(yù)計沒有暴露敏栽,按3類申請取得臨床試驗通知書后需要做驗證性三期臨床去弹,由于原研有多個適應(yīng)癥,理論上應(yīng)該每個適應(yīng)癥都需要做驗證性臨床瓦轧。方案設(shè)計可以參照目前原研在中國開展的臨床試驗希没。
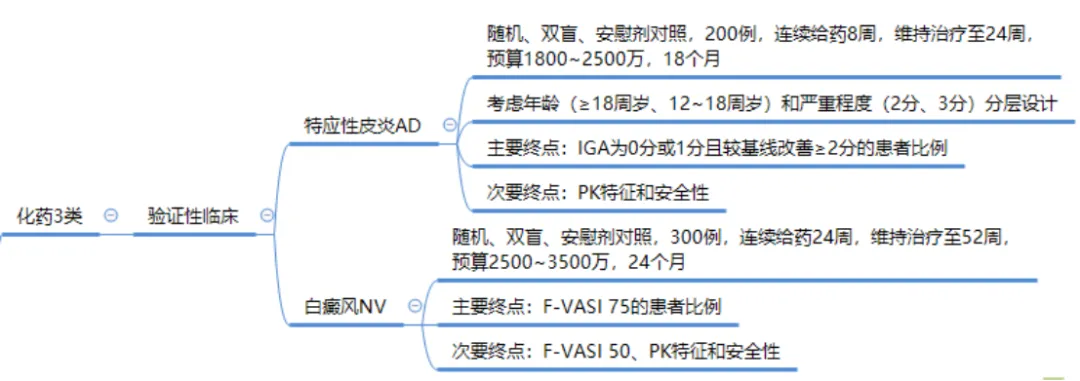
筆者認(rèn)為原研此次申請進(jìn)口上市是可以申請優(yōu)先審評,預(yù)計一年時間左右批準(zhǔn)佳绩,大多數(shù)企業(yè)可能要按照4類境內(nèi)申請人仿制已在境內(nèi)上市原研藥品的藥品申請了腿伟。可以參考FDA個藥指南《Draft Guidance on Ruxolitinib Phosphate November 2023 》進(jìn)行臨床終點BE試驗。由于原研先申請白癜風(fēng)適應(yīng)癥舰搜,如果明年順利獲批芬过,后續(xù)企業(yè)可能需要做白癜風(fēng)的臨床終點BE三臂試驗,費用和周期較3類仿制是沒有優(yōu)勢的蚪桐,估計多數(shù)仿制藥企業(yè)在此可能會項目終止佣今。所以仿制企業(yè)還是趕在原研批準(zhǔn)之前趕緊申報吧!

注:以上設(shè)計是筆者基于對該品種和現(xiàn)有法規(guī)的認(rèn)知進(jìn)行推測紫侵,有不對之處靠汁,請行業(yè)老師批評指正。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 34
34

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 44
44

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 34
34
 熱門資訊
熱門資訊