
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥筆記
醫(yī)藥筆記  2024-10-09
2024-10-09
 130
130
2024年10月8日馅酪,宜聯(lián)生物與安進達成全球臨床研究和藥品供應合作協(xié)議俐巴。雙方將評估YL201(B7-H3 ADC)和Imdelltra(DLL3/CD3雙抗)在SCLC(小細胞肺癌)的聯(lián)合治療潛力撩荣。
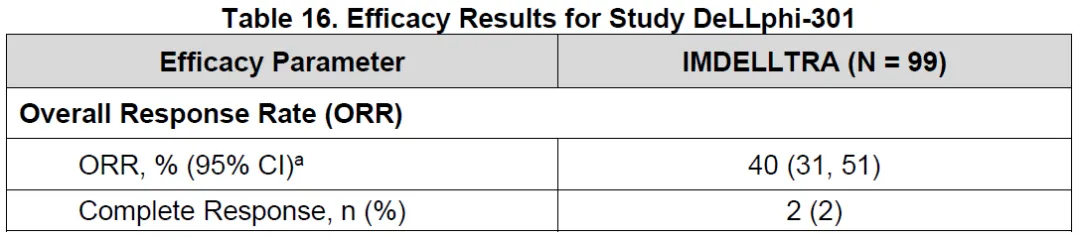
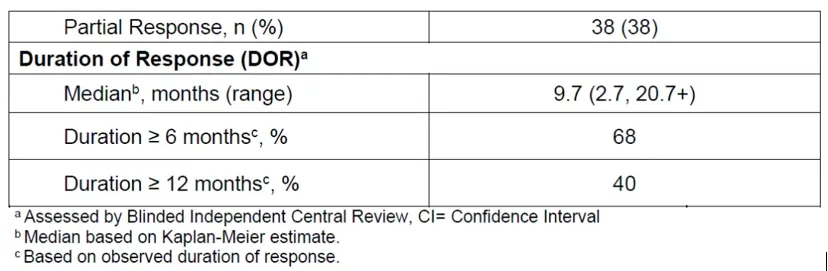
兩款藥物都已取得充分臨床數(shù)據(jù)驗證,并在同類藥物競爭中處于領先身位哪审。安進的Imdelltra在今年5月獲FDA批準上市,成為首款獲批的DLL3/CD3雙抗虑瀑。在其DeLLphi-301臨床中湿滓,99例患者ORR為40%,mDoR為9.7個月舌狗。
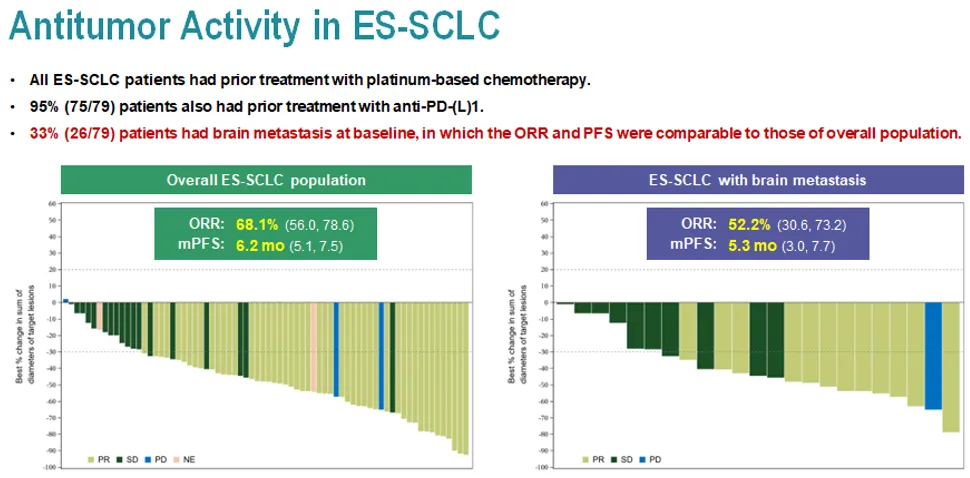
宜聯(lián)生物的YL201在今年ESMO會議上公布了臨床爬坡和擴展數(shù)據(jù)叽奥。在72例SCLC患者中的ORR為68.1%,mPFS為6.2個月痛侍,單藥臨床III期即將啟動塘袍。
ADC聯(lián)用IO(包括PD-1/L1、CD3雙抗)已成為實體瘤治療的下一個重要趨勢葱山。兩類藥物的殺傷機制和安全性表現(xiàn)互補協(xié)同绑接,有望組合進入前線,以探索進一步更廣闊的空間。在SCLC領域柑汇,B7-H3 ADC和DLL3雙抗成為最明確的聯(lián)用組合没撒。今年8月,第一三共與MSD共同開發(fā)DLL3/CD3雙抗MK-6070豫狸,雙方在全球范圍內共享研發(fā)和商業(yè)化費用以及利潤胆叁,MSD保留在日本的獨家權利,第一三共向MSD支付1.7億美金的預付款赂裁。此次宜聯(lián)和安進達成合作轻迹,是短期內全球范圍內又一項關于B7-H3 ADC和DLL3雙抗之間的合作。
值得注意的是烛许,YL201的全球權益目前仍完全在宜聯(lián)生物手中祭昏,此次與安進合作也并未涉及權益出讓,為未來的進一步產(chǎn)品開發(fā)提供靈活可能性再菊。安進方面爪喘,Imdelltra已獲批,相比“novel-novel combo”則帶來更多的臨床開發(fā)便利纠拔。期待宜聯(lián)和安進此次合作的后續(xù)表現(xiàn)秉剑。
總結
以ADC為代表的國產(chǎn)Biotech已站上國際舞臺。宜聯(lián)生物基于TMALIN技術平臺打造了豐富的ADC管線稠诲,并實現(xiàn)了包括與BioNTech侦鹏、Roche、再鼎臀叙、復宏漢霖略水、和鉑(海外授權Pfizer)等多起合作。此次YL201與安進達成聯(lián)用合作劝萤,標志著其全球化過程的又一個新的探索嘗試渊涝。目前YL201的全球權益仍由宜聯(lián)生物持有,期待其后續(xù)臨床床嫌、合作等各方面的進展跨释。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 27
27

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 33
33

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 28
28