
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 氨基觀察
氨基觀察  2024-10-09
2024-10-09
 81
81
藥企出海是大趨勢(shì)刻坊,背后的時(shí)代命題同樣在與時(shí)俱進(jìn)。
新變革下酒旷,如何重新審視美國(guó)、歐洲椅砸、東南亞等出海淘金地送县?不同國(guó)家和地區(qū)有著不同市場(chǎng)規(guī)模和政策法規(guī),如何審視市場(chǎng)利弊嫡服,制定更契合的出海戰(zhàn)略打法桌偎?一切亟需產(chǎn)業(yè)界回答。
眼下伴竹,越來(lái)越多的跡象表明徊岂,藥企不再像過(guò)往只盯著美國(guó)市場(chǎng)這一塊“肥肉”,歐洲等國(guó)家地區(qū)正在愈發(fā)受到重視报叁。
在屢受FDA打擊后田漓,越來(lái)越多PD-1轉(zhuǎn)戰(zhàn)歐洲并獲批上市。今年以來(lái)付找,包括復(fù)宏漢霖歧胃、齊魯制藥、基石藥業(yè)艰争、億帆醫(yī)藥控股子公司億一生物坏瞄、科興制藥、君實(shí)生物等國(guó)內(nèi)藥企甩卓,都有產(chǎn)品在歐盟獲批上市鸠匀。
顯然,歐洲對(duì)國(guó)產(chǎn)創(chuàng)新藥大門敞開逾柿。作為僅次于美國(guó)的全球第二大創(chuàng)新藥市場(chǎng)缀棍,歐洲的藥品審評(píng)審批還是相對(duì)FDA要寬松些。
從近期的審批結(jié)果來(lái)看机错,小適應(yīng)癥可以通過(guò)中國(guó)的臨床數(shù)據(jù)申報(bào)上市爬范;包括肺癌等大適應(yīng)癥父腕,在臨床對(duì)照組為非標(biāo)準(zhǔn)療法的情況下,也有獲批的可能性青瀑。關(guān)于后者侣诵,在美國(guó),幾乎毫無(wú)可能狱窘。
這也為藥企帶來(lái)新的淘金機(jī)會(huì)。無(wú)論如何财搁,歐洲是世界上第二大的創(chuàng)新藥市場(chǎng)愈饲,國(guó)內(nèi)企業(yè)不能錯(cuò)過(guò)這一機(jī)會(huì)。
更寬松的審批環(huán)境
歐盟市場(chǎng)作為一個(gè)整體蝉丧,也是全球創(chuàng)新藥物市場(chǎng)的主要參與者碴纺,不僅市場(chǎng)非常成熟,擁有如拜耳就留、羅氏仇习、阿斯利康等一眾知名跨國(guó)大藥企,且對(duì)新型生物技術(shù)的接受程度相對(duì)較高拭奖。
德勤數(shù)據(jù)顯示梆载,自2015年至2020年,biotech推出的新產(chǎn)品在歐洲藥品管理局(EMA)一直占據(jù)主導(dǎo)地位萧状,平均每年占EMA批準(zhǔn)藥物總數(shù)的33%撵刷。
換言之,歐洲是biotech推出新藥的重要市場(chǎng)捣兄,即使是美國(guó)的biotech褐袒、biopharma,也都將尋求在歐洲市場(chǎng)的擴(kuò)張作為它們的重要任務(wù)稍浆。而在已擴(kuò)張至歐洲的Biotech中载碌,約52%來(lái)自美國(guó),其次是日本或加拿大衅枫。
中國(guó)藥企嫁艇,正在快速加入這一陣營(yíng),尤其是在國(guó)產(chǎn)PD-1在美上市遇阻之后为鳄。因?yàn)樯哑停绕鹈绹?guó)FDA愈發(fā)嚴(yán)格的審核趨勢(shì),歐洲展現(xiàn)出不同的態(tài)度孤钦。
9月24日歧斟,君實(shí)生物宣布,PD-1單抗特瑞普利近日獲得了歐盟委員會(huì)批準(zhǔn)的兩項(xiàng)鼻咽癌適應(yīng)癥偏形。
特瑞普利單抗并不是第一個(gè)在歐盟獲批上市的國(guó)產(chǎn)PD-1静袖。在它之前觉鼻,百濟(jì)神州的替雷利珠單抗和基石藥業(yè)的舒格利單抗均已獲得批準(zhǔn)。
同時(shí)队橙,特瑞普利也不會(huì)是最后一個(gè)在歐盟獲批的國(guó)產(chǎn)PD-1單抗坠陈。9月20日,復(fù)宏漢霖宣布淮辕,EMA人用藥品委員會(huì)(CHMP)已發(fā)布推薦斯魯利單抗獲得上市許可的積極意見蘸错,建議批準(zhǔn)其用于一線治療廣泛期小細(xì)胞肺癌(ES-SCLC)適應(yīng)癥。
看起來(lái)俯炮,歐洲相比美國(guó)要寬松不少冬溯。一方面,像特瑞普利單抗這樣申報(bào)的鼻咽癌小適應(yīng)癥敦浅,可以通過(guò)中國(guó)的臨床數(shù)據(jù)申報(bào)上市录教;另一方面,包括肺癌等大適應(yīng)癥赛琢,在臨床對(duì)照組為非標(biāo)準(zhǔn)療法的情況下字瘫,也有獲批的可能性。
斯魯利單抗申報(bào)小細(xì)胞肺癌適應(yīng)癥的支持性研究是Astrum-005悴碳,其對(duì)照組是化療借街,最終,斯魯利單抗在總生存率上擊敗了單獨(dú)化療(中位數(shù)15.4對(duì)10.9個(gè)月灾囊,HR=0.63伶丐,p<0.001)。
不過(guò)疯特,歐洲目前一線SCLC的標(biāo)準(zhǔn)治療方案是Imfinzi加化療或Tecentriq加化療哗魂。目前,CHMP給出積極意見漓雅,斯魯利單抗獲批在即录别,意味著EMA并沒有要求斯魯利重新開展頭對(duì)頭臨床試驗(yàn)。
這也表明歐盟監(jiān)管機(jī)構(gòu)的態(tài)度邻吞,比美國(guó)FDA更開放组题。按照FDA的嚴(yán)苛要求,如果之前已經(jīng)有一個(gè)藥物獲批上市抱冷,之后再上市的同類新藥崔列,沒有頭對(duì)頭的數(shù)據(jù),別說(shuō)是跟其他產(chǎn)品競(jìng)爭(zhēng)了旺遮,連獲批上市的可能性都微乎其微赵讯。
對(duì)于出海企業(yè)來(lái)說(shuō),這是一個(gè)值得關(guān)注的信號(hào)耿眉,畢竟在海外開展頭對(duì)頭臨床試驗(yàn)边翼,不僅費(fèi)時(shí)費(fèi)錢淳某,風(fēng)險(xiǎn)也很高。
當(dāng)然徽七,監(jiān)管相對(duì)寬松并不足以驅(qū)動(dòng)藥企踏上這場(chǎng)出海的探索之旅馍上。更重要的還在于,歐洲市場(chǎng)足夠?qū)拸V蛹柔。
全球第二大市場(chǎng)
市場(chǎng)流傳這樣一個(gè)說(shuō)法哑暮,整個(gè)醫(yī)藥創(chuàng)新藥行業(yè),只有3個(gè)世界电尖,美國(guó)掘鱼、歐洲和其他。
這足以表明丛幌,歐洲的醫(yī)藥市場(chǎng)規(guī)模不容小覷。
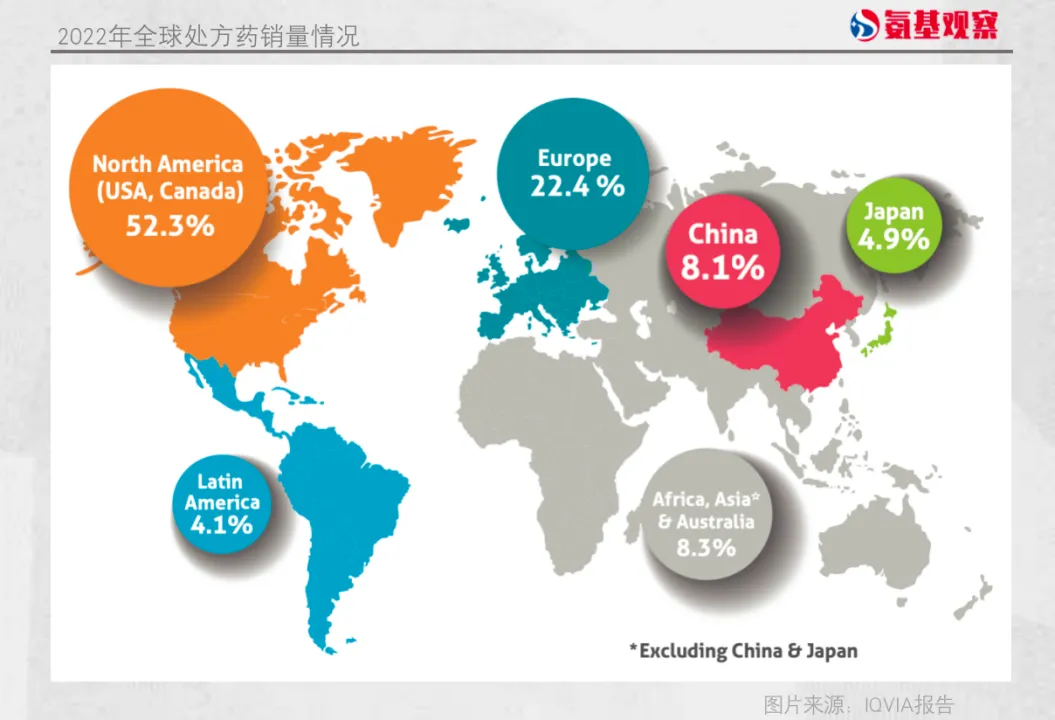
根據(jù)IQVIA數(shù)據(jù)抢纹,2022年懒碍,世界藥品(處方藥)市場(chǎng)按出廠價(jià)估計(jì)價(jià)值1222.921億歐元(1287.736億美元)。北美市場(chǎng)(美國(guó)和加拿大)是世界上最大的市場(chǎng)谚剿,份額為52.3%缝驳,遠(yuǎn)遠(yuǎn)領(lǐng)先于歐洲、中國(guó)和日本归苍。
而歐洲則是僅次于美國(guó)的第二大市場(chǎng)用狱,占比達(dá)到22.4%。
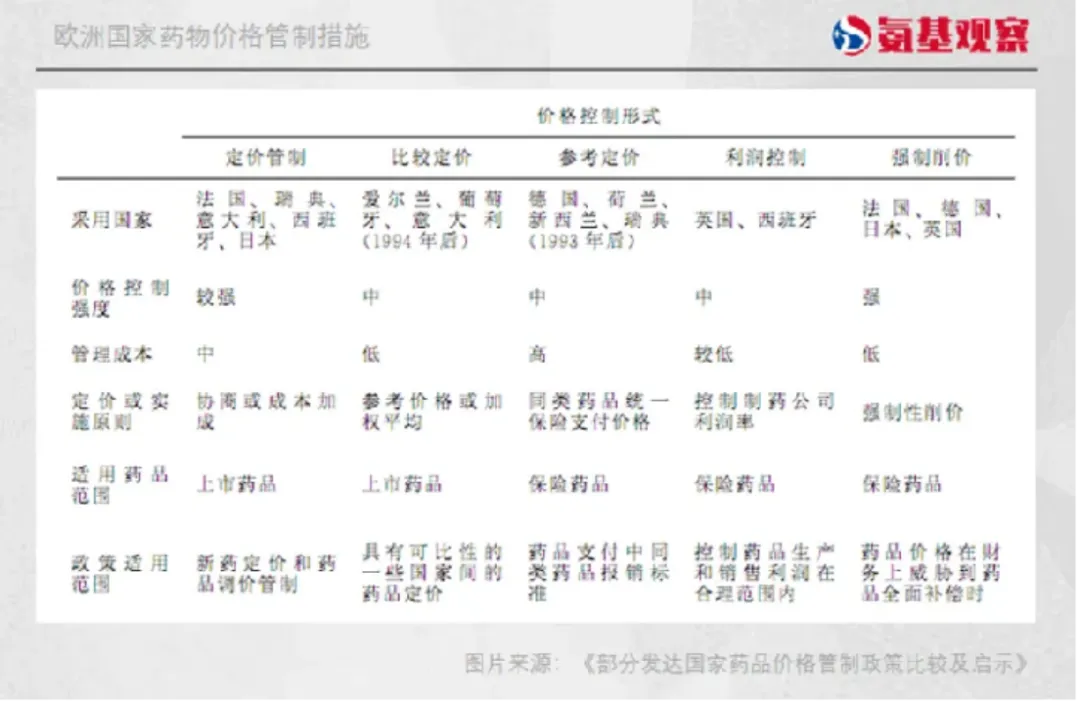
盡管歐洲各國(guó)拼弃,以把控藥價(jià)而聞名夏伊。不同于美國(guó)的自由定價(jià),自90年代以來(lái)吻氧,歐洲各國(guó)一直是通過(guò)各種手段溺忧、政策,控制藥物定價(jià)盯孙。比如德國(guó)鲁森,是最早采取藥物參考定價(jià)的國(guó)家,并通過(guò)多種機(jī)制控制藥價(jià)振惰、降低藥價(jià)歌溉。
德國(guó)之后,歐洲各國(guó)政府開始效仿骑晶,制定一系列政策來(lái)控制藥價(jià)痛垛,比如價(jià)格凍結(jié)、固定定價(jià)梁促、利潤(rùn)控制和參考定價(jià)修扁。
最近幾年诀烫,由于俄烏沖突、通貨膨脹峡逆、新冠疫情對(duì)各國(guó)醫(yī)保的大量消耗勃拢,歐洲對(duì)于創(chuàng)新藥定價(jià)控制還在逐漸趨嚴(yán)。此前念弧,不少企業(yè)也在歐洲擴(kuò)張的嘗試中后涛,由于藥物定價(jià)壓力接連敗北。典型如藍(lán)鳥生物依播,在與德國(guó)等國(guó)家就在歐洲推出其首個(gè)基因治療藥物Zynteglo的談判失敗后口愁,公司決定將業(yè)務(wù)重點(diǎn)放在美國(guó)。
嚴(yán)格的控價(jià)娱必,傷害了歐洲制藥業(yè)的發(fā)展鸿挠。但這其實(shí)并不影響國(guó)內(nèi)藥企淘金,畢竟姻蚓,這是一個(gè)僅次于美國(guó)的創(chuàng)新藥大市場(chǎng)宋梧。
僅從藥價(jià)層面出發(fā),你也無(wú)法在找到一個(gè)可媲美美國(guó)的市場(chǎng)狰挡。據(jù)BCG分析捂龄,以目前全球最暢銷的25個(gè)藥品為例,如果以美國(guó)藥價(jià)為100%的話加叁,歐洲13國(guó)的藥價(jià)在20%上下倦沧,其中藥價(jià)最貴的德國(guó)也只有美國(guó)的26%。除了阿聯(lián)酋(為美國(guó)的26%)和日本(為美國(guó)的22%)它匕,其他國(guó)家的藥價(jià)都低于美國(guó)的1/5展融。
我國(guó)的藥價(jià)更低,只相當(dāng)于美國(guó)的1/10豫柬、歐洲13國(guó)的40%~66%愈污。對(duì)比下來(lái),歐洲仍是一個(gè)不錯(cuò)的選擇轮傍。
好藥暂雹,就應(yīng)該到更廣闊的天地去。
與此同時(shí)抱典,歐洲市場(chǎng)也在做出改變衔耕。對(duì)于高臨床價(jià)值創(chuàng)新藥,探索符合其國(guó)情的價(jià)格保護(hù)政策绵另。
比如悬鲜,最為嚴(yán)格控制藥價(jià)的法國(guó),為了推動(dòng)創(chuàng)新、促進(jìn)投資和出口厉源,幾年前也對(duì)部分藥價(jià)管控條款進(jìn)行了大幅修改既蛙。比如,在滿足公共健康需求的同時(shí)豆蝠,推動(dòng)某些改良型藥品(ASMR 4級(jí))接軌歐盟價(jià)格蓖社;由于生產(chǎn)費(fèi)用可能會(huì)造成一定的供應(yīng)問題,允許某個(gè)治療領(lǐng)域整體或部分藥品可以維持較高價(jià)格赛羡;在ASMR5級(jí)藥品上市的前三年中衍止,固定其價(jià)格等等。
商業(yè)化挑戰(zhàn)
無(wú)論是對(duì)于創(chuàng)新藥的監(jiān)管環(huán)境词祝,還是全球第二大市場(chǎng)及正在逐步改善的創(chuàng)新藥定價(jià)環(huán)境园担,都表明,歐洲是一個(gè)值得淘金的市場(chǎng)枯夜。
“試水者”也變得越來(lái)越多弯汰,不過(guò),這并非一路坦途湖雹。
簡(jiǎn)單來(lái)說(shuō)咏闪,盡管更加包容,但歐洲各國(guó)對(duì)藥品監(jiān)管的法律劝枣、法規(guī)與國(guó)內(nèi)存在差異,國(guó)內(nèi)藥企出海需要經(jīng)歷適應(yīng)的過(guò)程织鲸。
歐洲各國(guó)單一市場(chǎng)并不大舔腾,既復(fù)雜又分散,涵蓋了英國(guó)和瑞士在內(nèi)的31個(gè)細(xì)分市場(chǎng)搂擦,生物制藥產(chǎn)品上市需要獲得EMA和英國(guó)藥品和保健品監(jiān)管機(jī)構(gòu)(MHRA)的監(jiān)管批準(zhǔn)稳诚,一些國(guó)家(如意大利)需要得到本國(guó)地方或地區(qū)監(jiān)管當(dāng)局的批準(zhǔn)。換句話說(shuō)瀑踢,藥企不能像在美國(guó)市場(chǎng)一樣扳还,通過(guò)復(fù)制統(tǒng)一模式就實(shí)現(xiàn)藥品在歐盟上市與全域覆蓋。
即使藥企獲得EMA的批準(zhǔn)上市咱茂,還要面臨各國(guó)藥品定價(jià)掰废、市場(chǎng)開拓等復(fù)雜關(guān)卡。
每個(gè)市場(chǎng)都有不同的醫(yī)療系統(tǒng)缴碉、獨(dú)立的醫(yī)療技術(shù)評(píng)估和報(bào)銷流程敢添。比如英國(guó)政府對(duì)藥品的利潤(rùn)率水平有嚴(yán)格的控制,瑞士除了正常的社保叁乍,還有追加醫(yī)療保險(xiǎn)季训,在這個(gè)追加醫(yī)療保險(xiǎn)上,有的藥物是可以支付的则沃。
從歐盟各成員國(guó)來(lái)看肝庸,每個(gè)國(guó)家的醫(yī)保支付政策都是不一樣的锡跺,零售和批發(fā)的市場(chǎng)也是完全不同的。這意味著吓死,藥企出海歐盟的真正難點(diǎn)渴甜,還在于商業(yè)化挑戰(zhàn)。當(dāng)然统岭,對(duì)大部分創(chuàng)新藥企來(lái)說(shuō)蟋定,很難如百濟(jì)神州一般在歐美自建商業(yè)化團(tuán)隊(duì),因此草添,找到合適的商業(yè)化模式驶兜,也是必備的技能。
這種情況下远寸,借船出海成了大多數(shù)人的選擇抄淑,借助合作伙伴海外臨床、注冊(cè)或商業(yè)化能力驰后,做得更好肆资。前提則是,自身的技術(shù)和產(chǎn)品質(zhì)量必須過(guò)硬灶芝。
總的來(lái)說(shuō)郑原,盡管歐洲市場(chǎng)復(fù)雜而充滿挑戰(zhàn),但這個(gè)市場(chǎng)提供了一個(gè)抓住巨大商業(yè)潛力的機(jī)會(huì)夜涕,同時(shí)也為創(chuàng)新藥企提供了一個(gè)平臺(tái)犯犁,通過(guò)提供新療法來(lái)改善患者的療效。
對(duì)于中國(guó)創(chuàng)新藥來(lái)說(shuō)女器,每一個(gè)志在全球市場(chǎng)的企業(yè)口迟,都在探索更好、更適合的方式途徑巨脚。有驚喜亦有風(fēng)險(xiǎn)保蒲,重點(diǎn)在于始終在路上。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 27
27

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 33
33

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 27
27
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽