
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥渡
藥渡  2024-10-11
2024-10-11
 128
128
近日禁妓,禮來宣布其治療阿爾茨海默病的藥物donanemab(多奈單抗)已在日本獲批焦辅,日本是donanemab獲得批準的第二個主要市場岗命,此前已在美國以Kisunla的品牌名稱上市命爬,禮來的阿爾茲海默病藥物版圖全球化進程加速笔宿。
阿爾茨海默猜梢獭(AD)是全球醫(yī)藥界面臨的一大挑戰(zhàn)米苹,也是最常見的癡呆癥類型限寞。其病因極為復雜忍啸,涉及衰老、遺傳和環(huán)境等多種因素的共同作用〖拼疲科學界提出了多種病理機制假說悄晃,包括膽堿能功能失調(diào)、淀粉樣蛋白積累凿滤、tau蛋白異常妈橄、炎癥反應、氧化應激翁脆、金屬離子失衡眷蚓、谷氨酸興奮毒性、微生物-腸-腦軸紊亂以及異常自噬等反番。然而沙热,這些病理因素之間的相互作用仍未完全解明,導致AD的主要誘因依然是個謎罢缸。
盡管過去幾十年里科學家們進行了大量藥物開發(fā)的嘗試篙贸,但由于療效不足或副作用較多,大多數(shù)藥物都未能成功譬椰。以往獲批的治療藥物大多只能暫時緩解癥狀踏蚓,且常伴隨副作用。最近FDA批準了三種新藥——aducanumab姚不、lecanemab和donanemab惫投,它們顯示出清除Aβ斑塊并減緩認知衰退的潛力,但其長期療效和安全性仍需進一步驗證光丢。
隨著研究的深入旋蝎,尤其是在免疫治療領域的突破,AD治療正從傳統(tǒng)的單一靶點策略逐漸向小分子治療模式轉(zhuǎn)變镰掐。新一代AD小分子藥物通過多種機制孕序,如選擇性靶向、雙靶點炸诚、變構(gòu)調(diào)節(jié)递市、共價結(jié)合、PROTACs技術(shù)以及蛋白-蛋白相互作用(PPI)調(diào)控碗屏,來優(yōu)化藥物特性唁情、安全性和療效。這種多維度的創(chuàng)新正在加速AD藥物的開發(fā)進程甫匹,并減少相關挑戰(zhàn)甸鸟,為患者帶來新的希望。
PART.01
AD的發(fā)病機制
可謂是錯綜復雜的謎團
阿爾茨海默脖浮(AD)的發(fā)病機制至今仍未完全明確抢韭,是一個復雜且充滿謎團的領域薪贫。
Aβ的積累是AD的一個標志性病理特征,它源于淀粉樣前體蛋白(APP)的逐步裂解刻恭,而APP的加工受到許多因素的調(diào)控瞧省。同時,Aβ的積累與載脂蛋白E(APOE)密切相關鳍贾,特別是APOEε4等位基因鞍匾,它是AD最強的遺傳風險因素之一。
此外骑科,tau蛋白作為神經(jīng)原纖維纏結(jié)(NFTs)的主要成分橡淑,與AD的臨床癥狀密切相關。
除了關鍵的β淀粉樣蛋白(Aβ)和tau蛋白外键腹,乙酰膽堿缺乏呕摹、神經(jīng)炎癥、氧化應激溪客、金屬離子失衡二搀、谷氨酸失調(diào)、胰島素抵抗肢箕、腸道微生物群異常诸恤、膽固醇穩(wěn)態(tài)破壞、線粒體功能障礙和自噬異常等多種因素也可能在其中扮演重要角色(圖1)牲支。
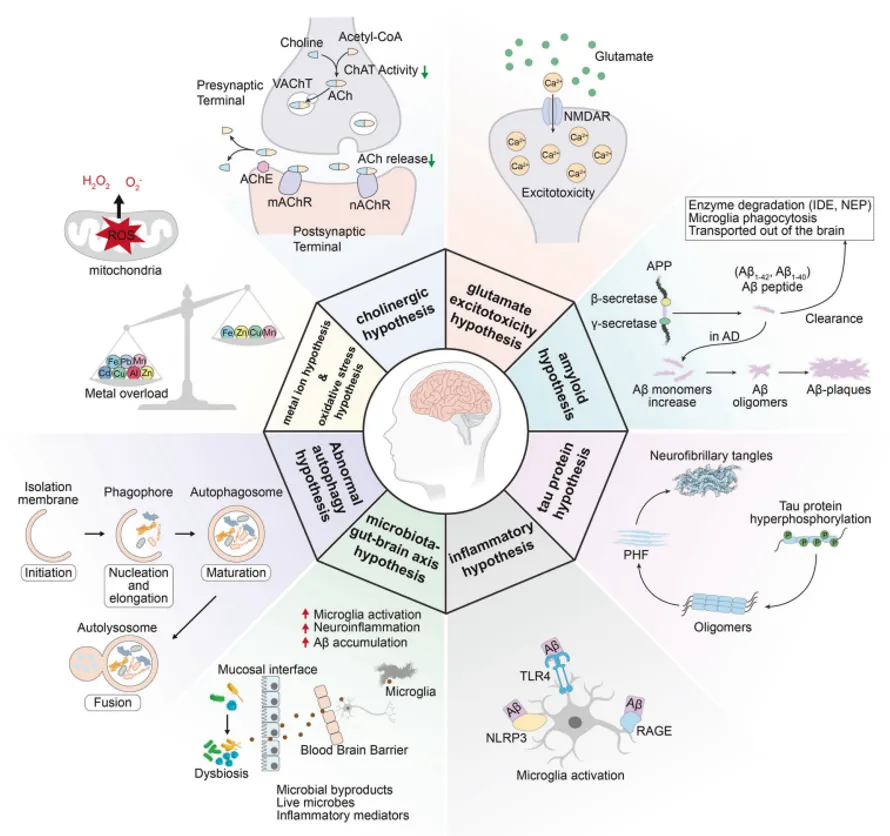
圖1. AD發(fā)病機制示意圖
這些病理機制并非獨立存在微惦,而是彼此交互,構(gòu)成了AD發(fā)展的復雜網(wǎng)絡窥血。理解這些復雜的相互作用婶耕,不僅有助于揭示AD的根本原因,也為開發(fā)更有效的治療方法提供了重要線索牢辣。
PART.02
信號通路與AD發(fā)病機制的關聯(lián)
神經(jīng)炎癥信號通路
AD中的多種病理因素赖厅,如Aβ、促炎細胞因子和氧化應激晾咪,可激活小膠質(zhì)細胞收擦,啟動下游信號通路,如MAPK谍倦、NF-κB和PI3K/Akt塞赂。這些通路的激活進一步促進小膠質(zhì)細胞的活化和炎癥介質(zhì)的產(chǎn)生,加劇神經(jīng)毒性昼蛀。
溶酶體功能障礙
溶酶體在維持細胞內(nèi)環(huán)境穩(wěn)定中起著關鍵作用宴猾,其功能障礙與AD的發(fā)展密切相關。AD中溶酶體酸化缺陷可能削弱Aβ的清除叼旋,導致細胞外Aβ斑塊的積累鳍置。
膽固醇代謝異常
膽固醇在AD中也扮演著重要角色辽剧。膽固醇的合成送淆、運輸税产、代謝和清除失衡可能通過介導Aβ、tau偷崩、炎癥等病理變化促進AD的進展辟拷。
線粒體功能障礙
線粒體是細胞能量的主要來源,其功能障礙在AD中表現(xiàn)為能量代謝缺陷欣挠、氧化應激增加卒亩、鈣離子失衡和線粒體動力學異常等,可導致神經(jīng)元功能障礙甚至凋亡怕枣。
鈣信號通路
鈣信號在AD中也受到干擾划万。細胞內(nèi)鈣濃度的升高和鈣信號通路的異常可影響內(nèi)質(zhì)網(wǎng)庸既、線粒體和溶酶體等細胞器的功能招蠕,導致神經(jīng)退行性疾病的發(fā)生。
胰島素信號通路
胰島素信號通路與AD密切相關技熊。在AD大腦中倾莽,胰島素信號通路受損,導致糖原合成酶激酶-3(GSK-3)活性增加望吧,tau蛋白磷酸化和Aβ產(chǎn)生增加板刑。
神經(jīng)營養(yǎng)信號通路失調(diào)
神經(jīng)營養(yǎng)因子在AD中減少,導致神經(jīng)元的生存俊炒、生長和分化受到影響邑键,突觸可塑性和神經(jīng)元信號功能減弱。
血腦屏障功能障礙
血腦屏障的破壞與AD的發(fā)展密切相關休玩。血腦屏障的完整性受損著淆、運輸功能改變、腦血流量減少和神經(jīng)炎癥等都可能導致AD的病理變化哥捕。
PART.03
AD的診斷標志物:
尋找疾病的線索
影像學標志物
磁共振成像(MRI)和正電子發(fā)射斷層掃描(PET)等分子成像技術(shù)可用于檢測AD 患者的腦部結(jié)構(gòu)和功能變化牧抽。
結(jié)構(gòu)MRI可評估海馬和內(nèi)嗅皮層萎縮;18FDG-PET可檢測后扣帶回和顳頂葉的葡萄糖代謝降低遥赚;PET成像可顯示Aβ和tau沉積扬舒。
然而,這些方法在診斷AD時存在局限性凫佛,不能準確區(qū)分AD與其他具有相似病理的神經(jīng)退行性疾病讲坎。
腦脊液標志物
腦脊液中的Aβ42、磷酸化tau(P-tau)和總tau(T-tau)等是AD的重要標志物愧薛。P- tau181濃度是區(qū)分AD與非AD癡呆的最準確指標晨炕。
雖然amyloid和tau PET以及腦脊液標志物可特異性指示AD相關病理衫画,但它們之間并不完全等同。研究表明瓮栗,amyloid PET與腦脊液結(jié)果高度負相關树季,而腦脊液P-tau 與tau PET結(jié)果不一致。
血液標志物
血液標志物為AD的診斷提供了一種經(jīng)濟番链、方便令叉、微創(chuàng)且高度可及的選擇。許多腦脊液標志物(如Aβ蝉齐、P-tau溜帐、NfL、GFAP)在血液中也有應用多梅,隨著高靈敏度分析平臺和檢測技術(shù)的進步勃核,血液標志物的診斷精度和可靠性不斷提高。
PART.04
傳統(tǒng)AD藥物的探索之路
傳統(tǒng)的阿爾茨海默菜蛰铩(AD)治療藥物主要包括乙酰膽堿酯酶抑制劑(AChEIs)和N-甲基-D-天冬氨酸(NMDA)受體拮抗劑(圖2)俩孽。
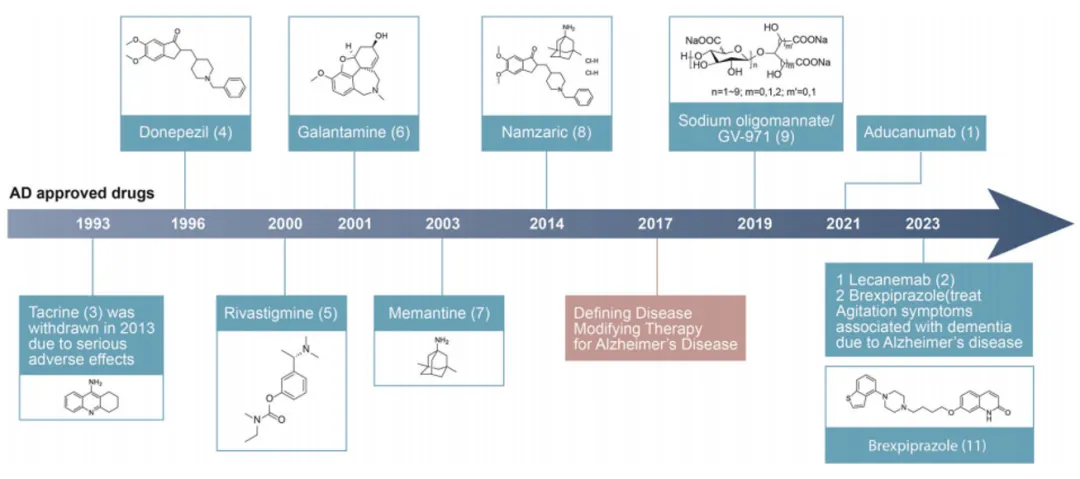
圖2. FDA/中國批準的AD治療藥物
AChEIs家族中,最早被批準用于AD治療的藥物是他克林销泽。該藥物通過抑制乙酰膽堿酯酶的活性氧胳,增加乙酰膽堿的濃度和作用時間,進而提升患者的認知和行為能力辰令。然而伴鳖,由于他克林的肝毒性問題,它雖在1993年獲批徙硅,但最終在2013年被市場撤回榜聂。盡管如此,他克林在多靶點配體研究中仍具備潛力嗓蘑。
在AChEIs中须肆,后續(xù)開發(fā)的多奈哌齊、利凡斯的明和加蘭他敏被稱為第二代藥物桩皿。這些藥物不僅在選擇性方面更為優(yōu)越豌汇,副作用更少,且藥代動力學特性更好泄隔,因而成為AD治療的一線藥物拒贱。
美金剛是NMDA受體拮抗劑中唯一被FDA批準用于中度至重度AD治療的藥物。美金剛通過調(diào)節(jié)谷氨酸傳遞和多巴胺受體的活性佛嬉,在一定程度上改善了患者的認知功能逻澳、日常生活能力和行為表現(xiàn)。此外暖呕,美金剛與多奈哌齊的固定劑量組合藥物Namzaric士敬,為中度至重度AD患者提供了另一種治療選擇侧碍。盡管這些藥物在調(diào)節(jié)神經(jīng)遞質(zhì)方面表現(xiàn)出色,但它們無法改變疾病的進程彻芒,這為新藥的設計提供了重要參考赴仪。
近年來,研究者們提出了“疾病修飾治療”的概念剪妥,旨在通過干預AD的基本生物機制波寓,阻止疾病進展,并為患者提供持久的治療益處蝇居。2019年,中國有條件批準了一種從海藻中提取的寡糖鹽GV-971作為AD的治療藥物烦草。GV-971的作用機制被認為是通過抑制腸道菌群失調(diào)引發(fā)的神經(jīng)炎癥刮锹,并破壞Aβ纖維的形成來抵抗AD。研究顯示幽摔,GV-971能夠依賴性別改變腸道微生物群的組成和豐度惯狠,調(diào)節(jié)微生物代謝和外周炎癥,從而減少神經(jīng)炎癥和淀粉樣病變刮便。目前空猜,GV-971的兩個四期臨床試驗正在進行中,預計將持續(xù)到2025年恨旱。
在AD治療領域辈毯,單克隆抗體如Aducanumab、Lecanemab和Donanemab也取得了一定進展搜贤。這些抗體主要針對Aβ蛋白谆沃,顯示出不同的療效和副作用。Aducanumab在2021年獲得FDA加速批準仪芒,雖然備受爭議唁影,但其清除Aβ斑塊和減緩認知衰退的能力不容忽視。隨后掂名,Lecanemab在2023年獲得批準据沈,Donanemab也于2024年獲批。然而饺蔑,這些藥物的使用也伴隨著顯著的影像學異常風險和高昂的治療費用锌介。
此外,新興藥物Brexpiprazole也顯示出對AD癥狀的緩解效果膀钠。Brexpiprazole原本用于治療抑郁癥和精神分裂癥秫废,通過作用于5-羥色胺、多巴胺和去甲腎上腺素受體俺媳,能夠有效減輕AD患者的焦慮癥狀情丛。隨著研究的深入肉棕,這些新藥為AD的治療提供了多樣化的靶點選擇,并為阻止或逆轉(zhuǎn)AD的進展帶來了新的希望暂铭。
PART.05
突破傳統(tǒng):
下一代AD治療的潛在藥物
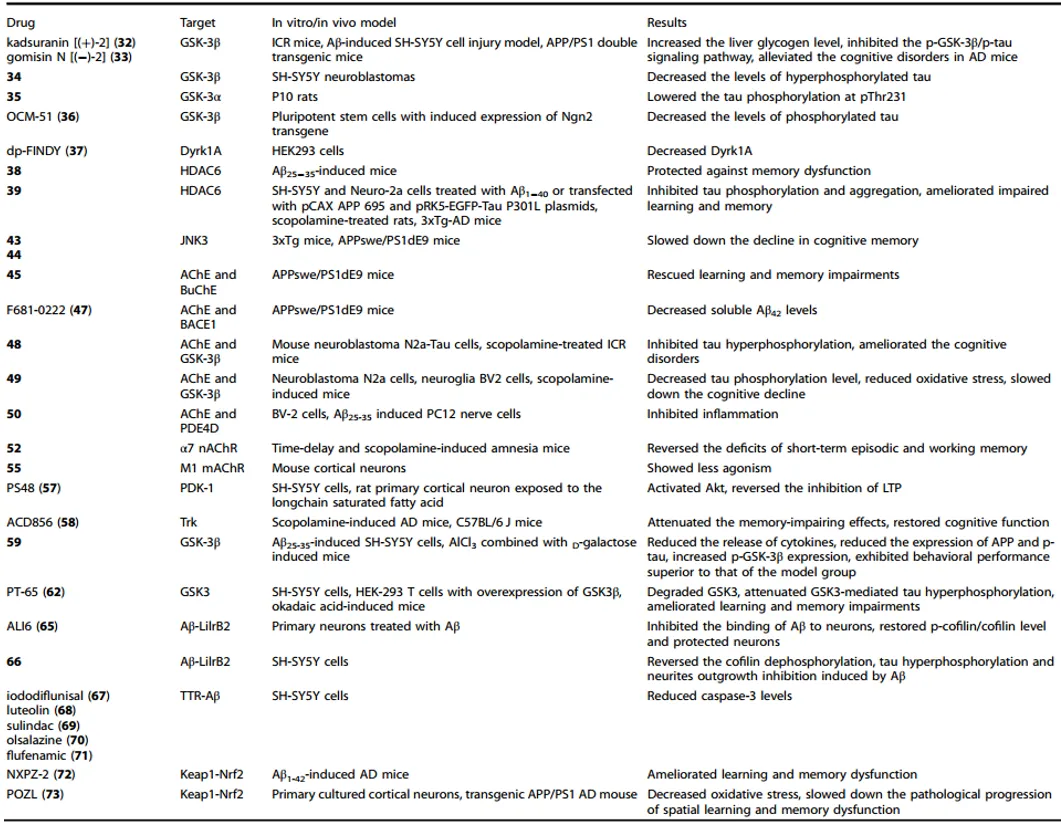
傳統(tǒng)AD藥物的療效有限披腻,而且在臨床試驗中失敗率較高,主要原因在于療效不足或副作用過大底咳。這些問題促使新一代AD藥物的開發(fā)標準不斷提高唱撩,目標是為患者提供多樣化且精準的治療方案,能夠根據(jù)個人的獨特病理過程量身定制珍霉。隨著對疾病機制的深入理解和藥物開發(fā)技術(shù)的進步殃倒,創(chuàng)新性AD藥物的開發(fā)正逐步成為現(xiàn)實(表1)。
表1. 下一代的AD治療藥物
選擇性抑制劑
隨著對病理蛋白質(zhì)生理功能的理解加深嘿杖,選擇性抑制劑的開發(fā)取得了顯著進展梁泞。這些抑制劑能夠特異性地靶向特定的蛋白類別、亞型或結(jié)構(gòu)域趾痘,從而在療效慢哈、安全性和耐受性方面提供更顯著的優(yōu)勢。
例如永票,從五味子果實中提取的Kadsuranin和gomisin N分別是五味子素B的兩種立體異構(gòu)體卵贱,能夠有效抑制GSK-3β。選擇性GSK-3β抑制劑OCM-51在減少tau蛋白磷酸化的同時侣集,能夠防止β-連環(huán)蛋白信號通路的過度激活键俱。
然而,開發(fā)選擇性抑制劑面臨諸多挑戰(zhàn)肚吏,特別是在高度保守或同源的結(jié)合口袋中設計出高選擇性的抑制劑方妖。為此,發(fā)現(xiàn)目標酶上的額外口袋罚攀、優(yōu)化目標党觅、以及使用計算工具可能成為解決這一難題的新策略。
雙靶點抑制劑
由于AD的多因素性質(zhì)和單靶點藥物效果有限斋泄,尋找有效的雙靶點或多靶點抑制劑成為新的研究方向杯瞻。這些抑制劑能夠?qū)σ粋€或多個靶點產(chǎn)生相加或協(xié)同作用,從而提高療效癌蚂、延長治療效果渴肿、減少副作用并降低藥物劑量。
例如在策,抑制乙酰膽堿酯酶(AChE)和丁酰膽堿酯酶(BuChE)的雙靶點藥物不僅能通過增加乙酰膽堿水平緩解AD患者的認知障礙肥爵,還可以延緩Aβ斑塊的形成。Ladostigil是一種AChE/MAO-B抑制劑,在II期臨床試驗中表現(xiàn)出良好的耐受性和安全性舶抚。
雖然多靶點藥物對單個靶點的活性可能低于單靶點藥物杏疑,但通過多靶點調(diào)節(jié)的協(xié)同效應可以獲得更好的療效和更少的不良反應。
變構(gòu)調(diào)節(jié)劑
變構(gòu)調(diào)節(jié)劑通過與受體的正構(gòu)位點不同的區(qū)域結(jié)合寄硬,誘導構(gòu)象變化來調(diào)節(jié)正構(gòu)配體的親和力和/或效力参枯,或直接調(diào)節(jié)受體活性。這些藥物可以產(chǎn)生正响徒、負或中性效應辩溢。例如,γ-分泌酶的變構(gòu)調(diào)節(jié)劑可促進產(chǎn)生較短丹禀、毒性較小的Aβ亞型状勤,而選擇性正變構(gòu)調(diào)節(jié)劑(PAMs)則靶向α7煙堿乙酰膽堿受體(α7 nAChR)亞型,減緩遺忘小鼠模型中的情景/工作記憶衰退湃崩。
變構(gòu)調(diào)節(jié)劑在AD藥物開發(fā)中具有巨大的潛力荧降,但同時也面臨挑戰(zhàn),需要更多的體外和體內(nèi)研究來評估化合物的功能效果和影響其特性的因素攒读。
共價抑制劑
共價抑制劑通過與目標蛋白形成共價鍵,展現(xiàn)出卓越的效力辛友、選擇性和作用持續(xù)時間薄扁。例如,具有丙烯酰胺彈頭的化合物59能夠與GSK-3β共價結(jié)合废累,顯著降低AD小鼠海馬中的APP和p-tau蛋白的表達邓梅,并改善其空間學習和記憶能力。
盡管共價抑制劑可能存在潛在的毒性問題邑滨,但通過優(yōu)化親電試劑的反應性和可逆性日缨、設計非共價支架、調(diào)整劑量等方式掖看,可以提高其選擇性并降低毒性匣距。
PROTACs(蛋白降解靶向嵌合體)
PROTACs利用泛素-蛋白酶體系統(tǒng)精確靶向并降解特定蛋白質(zhì),從而提高藥物的作用準確性和速度馁捌。在AD藥物開發(fā)中梗药,PROTACs可以靶向tau蛋白、磷酸激酶GSK-3β往蚕、組蛋白去乙踝粤荩化酶(HDACs)、BET蛋白和轉(zhuǎn)甲狀腺素蛋白(TTR)-Aβ相互作用等纱栓。然而费抚,PROTACs也面臨挑戰(zhàn),如E3連接酶的選擇有限韭惧、化合物分子量較大導致血腦屏障穿透性差等斟拘。
靶向PPI網(wǎng)絡
蛋白質(zhì)-蛋白質(zhì)相互作用(PPIs)在維持細胞功能中起著至關重要的作用蔚奕,而異常的蛋白質(zhì)相互作用與許多疾病的發(fā)病機制密切相關。在AD中暑赏,Aβ和tau蛋白的錯誤折疊和聚集涉及復雜的PPI網(wǎng)絡媒埃。例如,Aβ與白細胞免疫球蛋白樣受體B2(LilrB2)的相互作用會負向調(diào)節(jié)突觸和記憶贼穆,而Aβ與轉(zhuǎn)甲狀腺素蛋白(TTR)的相互作用則可以減少Aβ聚集和毒性题山。通過阻斷或調(diào)節(jié)這些相互作用,小分子抑制劑有望減輕AD的病理過程故痊。
小 結(jié)
總之顶瞳,AD的發(fā)病機制極為復雜,目前仍存在諸多未解之謎愕秫。然而慨菱,在藥物研發(fā)等方面卻不斷涌現(xiàn)新的進展。鑒于此戴甩,我們必須繼續(xù)深入研究阿爾茨海默病的發(fā)病機制符喝,致力于開發(fā)更加安全、有效的藥物甜孤,以便為AD患者提供更好的治療選擇协饲。
未來,隨著科學技術(shù)的持續(xù)進步缴川,我們堅信一定能夠攻克阿爾茨海默病這個難題茉稠,為患者及其家庭帶來嶄新的希望。
參考資料:
1. Recent advances in Alzheimer’s disease: Mechanisms, clinical trials and new drug development strategies.
2. Perspectives and challenges in patient stratification in Alzheimer’s disease.
3. New approaches to symptomatic treatments for Alzheimer’s disease.
4. Alzheimer’s disease clinical spectrum: diagnosis and management.

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 26
26

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 31
31

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 26
26