
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥渡
藥渡  2024-10-17
2024-10-17
 95
95
10月4日,邦耀生物等在Cell發(fā)表世界首個現(xiàn)貨通用CAR-T成功治療自身免疫疾病的臨床結(jié)果录切。值得一提的是福耐,這是國際上首次關(guān)于異體通用型CAR-T在治療自身免疫疾病中獲得成功的報道葫羡。
此次技術(shù)的重大意義在于異體通用技術(shù)的突破,為大規(guī)模生產(chǎn)CAR-T細(xì)胞療法治療自身免疫疾病邁出了關(guān)鍵第一步昌罩。此前哭懈,國外已有多個臨床案例表明利用CAR-T可以治愈系統(tǒng)性紅斑狼瘡灾馒、多發(fā)性硬化癥等自身免疫病,但都是僅限于自體CAR-T遣总。
在此背景下睬罗,大家愈加認(rèn)為CAR-T在自免疾病領(lǐng)域的未來潛力巨大。但是藥企的研發(fā)進(jìn)展如何旭斥,比之實體瘤如何容达?筆者將帶你一探究竟。
PART.01
從自體到異體通用技術(shù)突破
CAR-T在自免領(lǐng)域潛力凸顯
以目前CAR-T在自免治療領(lǐng)域所展現(xiàn)的突出成果來看垂券,其未來的潛力確定性還是很高董饰。
2021年8月5日,德國埃爾朗根-紐倫堡大學(xué)的研究人員在《新英格蘭醫(yī)學(xué)期刊》(NEJM)上發(fā)表研究成果圆米,他們采用自體CD19 CAR-T細(xì)胞治療了一名患有嚴(yán)重系統(tǒng)性紅斑狼瘡的20歲女性患者卒暂,該療法讓她的病情很快得到緩解,且沒有明顯副作用娄帖。該患者也成為了世界上首個接受CAR-T細(xì)胞治療的狼瘡患者乏根。
2022年9月,Nature Medicine期刊論文報告了5名難治性系統(tǒng)性紅斑狼瘡患者經(jīng)CAR-T細(xì)胞治療后仔省,所有患者病情得到改善俄躺,在長達(dá)17個月的隨訪中未出現(xiàn)復(fù)發(fā),并且均實現(xiàn)了無藥物緩解红集。
2023年2月亲沃,Georg Schett團(tuán)隊等人在《柳葉刀》發(fā)表臨床研究論文表示,使用CAR-T細(xì)胞療法成功治療了一種新的自身免疫疾病——特發(fā)性炎性肌病判懒。
2023年12月9日袋员,德國埃爾朗根-紐倫堡大學(xué)的Fabian Müller博士報告了一項最新研究數(shù)據(jù),15名自身免疫疾病患者(8名系統(tǒng)性紅斑狼瘡患者刀雳、4名系統(tǒng)性硬化癥患者和3名特發(fā)性炎性肌病患者)在接受CAR-T細(xì)胞療法后重獲新生痘嫉,他們不再出現(xiàn)癥狀或不再需要進(jìn)行新的治療。
2024年2月粪世,頂級期刊《新英格蘭醫(yī)學(xué)雜志》發(fā)表的一項研究顯示馆义,針對系統(tǒng)性紅斑狼瘡、特發(fā)性炎癥性肌炎和系統(tǒng)性硬化癥三類患者胁塞,經(jīng)過CAR-T治療后咏尝,所有患者體內(nèi)的自身抗體消失,且完全停止包括糖皮質(zhì)激素在內(nèi)的免疫抑制和抗炎藥物的治療啸罢。
2024年10月4日编检,Nature官網(wǎng)頭條發(fā)布了邦耀生物等利用CRISPR-Cas9基因編輯技術(shù)改造的異體通用型CAR-T細(xì)胞,幫助2名系統(tǒng)性硬化癥、1名免疫介導(dǎo)的壞死性肌病患者達(dá)到長期緩解……
從最初的系統(tǒng)性紅斑狼瘡蒙谓,逐漸延展到特發(fā)性炎癥性肌炎、系統(tǒng)性硬化癥训桶、壞死性肌病等多種自免疾病累驮,CAR-T療法都表現(xiàn)出治愈性的效果,而且在今年實現(xiàn)了異體通用CAR-T技術(shù)的突破舵揭,為大規(guī)模生產(chǎn)制備和低成本供給提供了支撐谤专。這些標(biāo)志性的研究,讓CAR-T療法在自免領(lǐng)域的商業(yè)化價值愈加凸顯午绳,其市場預(yù)期也逐步升溫置侍。
邦耀生物是如何實現(xiàn)異體通用CAR-T技術(shù)突破的?眾所周知拦焚,異體細(xì)胞容易引起機體的免疫排斥反應(yīng)瘫骏,邦耀生物使用了CRISPR-Cas9基因編輯工具敲除CAR-T細(xì)胞中的5個基因(HLA-A、HLA-B荣吻、CIITA哭夺、TRAC和PD-1),這幾個基因在免疫系統(tǒng)中扮演著重要的角色押辽,HLA-A和HLA-B主要參與遞呈內(nèi)源性抗原卷撞,CIITA確保MHC II類分子的正確表達(dá)和呈遞外源性抗原給輔助性T細(xì)胞,敲除他們可以避免同種異體T細(xì)胞引起的移植物抗宿主反應(yīng)饵忙。
PART.02
實體瘤VS自免疾病
自免CAR-T有望領(lǐng)先取得臨床成功
此前盐文,CAR-T已在血液腫瘤領(lǐng)域取得比較多的商業(yè)化應(yīng)用,當(dāng)下企業(yè)研發(fā)的熱門是實體瘤方向岖疲,此賽道患者需求多咏摔、市場空間龐大。但由于實體瘤中腫瘤特異性抗原較少极阴、腫瘤微環(huán)境復(fù)雜愧增、免疫抑制機制等等,造成CAR-T療法在實體瘤應(yīng)用中難以研發(fā)成功钥屈。
而自免疾病則不同悟民,很多自免疾病的致病機制在某程度上與B細(xì)胞淋巴瘤有接近之處,比如紅斑狼瘡是因為B細(xì)胞變得異撑窬停活躍并攻擊身體自身的組織射亏,只不過不同之處在于,B細(xì)胞淋巴瘤是B細(xì)胞不受控地不斷增生和分化形成血液瘤竭业,自免疾病則是B細(xì)胞表達(dá)異常智润。不管怎么說都是以B細(xì)胞為靶點,大多數(shù)自免疾病不存在如腫瘤微環(huán)境一樣的物理屏障,CAR-T細(xì)胞更容易接近和進(jìn)入窟绷。因此锯玛,CAR-T療法從之前的血液瘤轉(zhuǎn)向自免疾病也來的更容易些。
由于此兼蜈,很多人認(rèn)為自免疾病是CAR-T療法較實體瘤更有可能率先取得臨床突破的方向攘残。
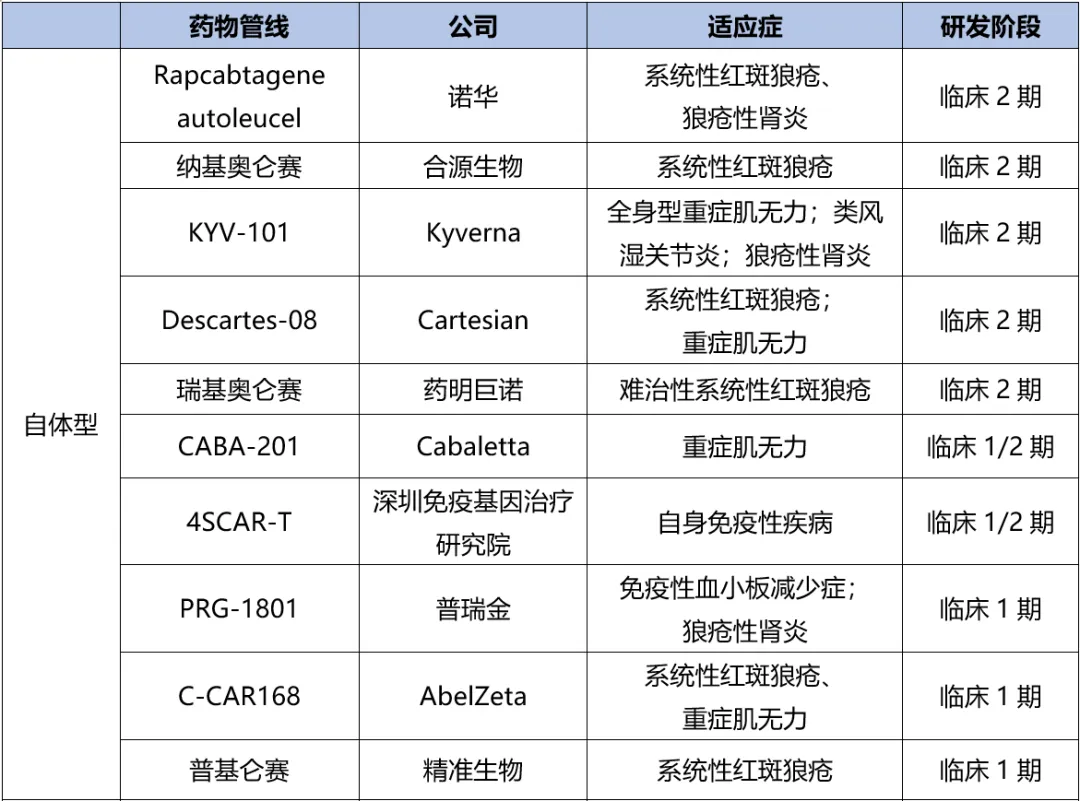
根據(jù)藥渡數(shù)據(jù),截至目前为狸,自免疾病領(lǐng)域的CAR-T藥物管線已超過280個歼郭,其中最快的已經(jīng)進(jìn)入臨床2期,數(shù)量有10個臭膊。諾華盆扳、合源生物、Kyverna栏赋、藥明巨諾等公司處于前列俭整。不乏之前的血液瘤CAR-T企業(yè)拓展自免適應(yīng)癥:
諾華的CD19 CAR-T產(chǎn)品rapcabtagene autoleucel,采用了與已獲批的Kymriah相同的CAR結(jié)構(gòu)仙衩,用于治療系統(tǒng)性紅斑狼瘡岩视、狼瘡性腎炎;
合源生物的納基奧侖賽申請了新適應(yīng)癥-系統(tǒng)性紅斑狼瘡血小板減少癥插凳;
還有藥明巨諾的瑞基奧侖賽也針對難治性系統(tǒng)性紅斑狼瘡進(jìn)行研發(fā)颓蛀。
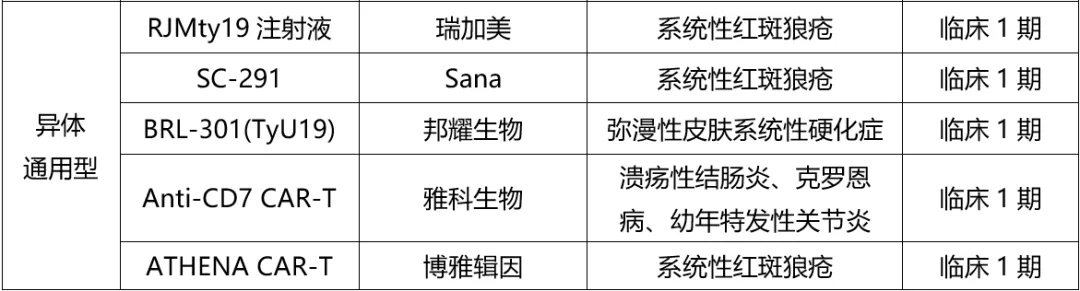
表1. 全球自免疾病CAR-T研發(fā)進(jìn)展(截至2024.10),來源:藥渡數(shù)據(jù)
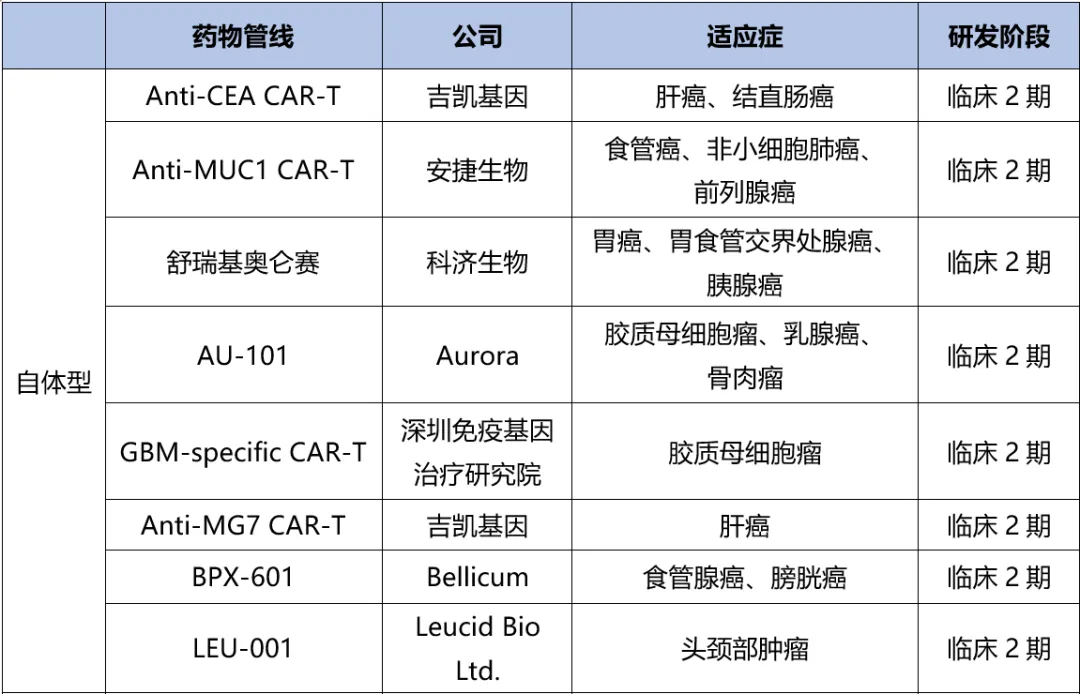
而在實體瘤領(lǐng)域姥胳,截至目前鹰坐,CAR-T藥物管線已超過1500個,其中最快的也是進(jìn)入了臨床2期贵健,數(shù)量有40個迷啄。癌種涵蓋肝癌、結(jié)直腸癌朋蔫、食管癌罚渐、頭頸部腫瘤等。
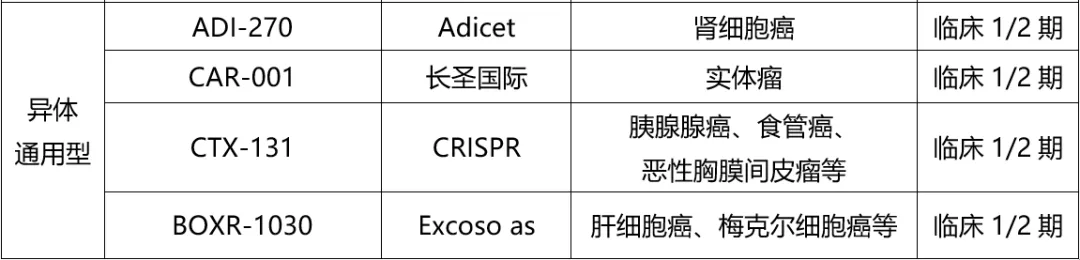
表2. 全球?qū)嶓w瘤CAR-T研發(fā)進(jìn)展(截至2024.10)驯妄,來源:藥渡數(shù)據(jù)
PART.03
小 結(jié)
綜上所述荷并,雖然從管線數(shù)量看,自免領(lǐng)域CAR-T規(guī)模比不上實體瘤青扔,但兩者的研發(fā)進(jìn)度上卻是相當(dāng)源织,進(jìn)展最快的都是處于臨床2期,而且從技術(shù)難度和發(fā)展速度來看微猖, CAR-T在自免疾病領(lǐng)域技術(shù)難度較實體瘤低谈息,研發(fā)推進(jìn)快缘屹,或許可能領(lǐng)先于實體瘤取得臨床成功。
參考文獻(xiàn):
https://www.biospace.com/biospace-layoff-tracker

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 15
15

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 18
18

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 15
15
 熱門資訊
熱門資訊