
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Insight數(shù)據(jù)庫
Insight數(shù)據(jù)庫  2024-10-18
2024-10-18
 562
562
根據(jù) Insight 數(shù)據(jù)庫「中國上市策略 & 時長預(yù)測」模塊诈乒,今年第四季度院颜,預(yù)計將有近 40 款新藥首次在國內(nèi)獲批上市赡勘。其中阅六,有 8 款抗腫瘤新藥有望通過「優(yōu)先審評」通道加速獲批上市攒读。本文將分享這幾款抗腫瘤新藥的基本信息指孤,僅供讀者參閱瘩绒。
葆元醫(yī)藥/信達(dá)生物
ROS1 抑制劑「他雷替尼」
23 年 11 月猴抹,他雷替尼(曾用名泰萊替尼)的首個 NDA 獲得 CDE 受理带族,并被納入優(yōu)先審評(CXHS2300104),用于治療經(jīng) ROS1-TKI 治療失敗的 ROS1 陽性局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)成人患者蟀给。
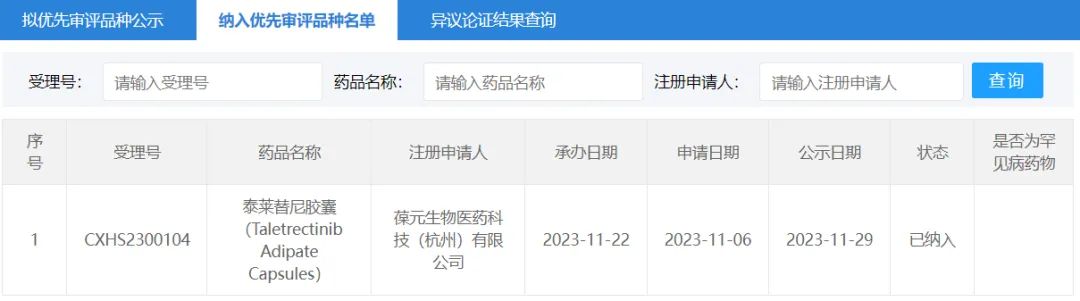
截圖來源:CDE 官網(wǎng)
他雷替尼是一種腦滲透蝙砌、選擇性、新一代 ROS1 抑制劑跋理,最初由葆元醫(yī)藥(已被 Nuvation Bio 收購)開發(fā)择克。2021 年 6 月,信達(dá)與葆元醫(yī)藥達(dá)成合作前普,在大中華區(qū)(包括中國大陸肚邢、香港、澳門和臺灣)共同開發(fā)和商業(yè)化他雷替尼麦荸。
今年 ESMO 上公布的關(guān)鍵 Ⅱ 期臨床數(shù)據(jù)顯示:
在未接受過 TKI 治療的患者中苛每,cORR 為 91.5%,顱內(nèi) ORR 為 76.5%喷融;在接受過 1 次 ROS1-TKI 治療的患者中木鸭,cORR 為 54%,顱內(nèi)ORR 為 62.5%淹摧。
對于未接受過 TKI 治療的患者巴俯,中位 DOR (mDOR) 和中位 PFS (mPFS) 未達(dá)到;對于接受過 1 次 ROS1-TKI 治療的患者钾抛,mDOR 為 24.9 個月漏炕,mPFS 為 9.6 個月。
12 個月 PFS 率方面衣夏,未接受過 TKI 治療的患者為 77.9%扭享,接受過 1 次 ROS1-TKI 治療的患者為 38.4%。
今年 3 月加六,CDE 還受理了他雷替尼的第 2 個 NDA(CXHS2400020)辫继,并將其納入優(yōu)先審評,用于未經(jīng) ROS1-TKI 治療的 ROS1 陽性局部晚期或轉(zhuǎn)移性 NSCLC 成人患者俗慈。Insight 數(shù)據(jù)庫預(yù)測姑宽,該申請也有望在今年 Q4 獲批。
益方生物/正大天晴
KRAS G12C 抑制劑「格舒瑞昔」
23 年 12 月闺阱,格舒瑞昔片(D-1553 片)的上市申請被 CDE 納入優(yōu)先審評(CXHS2300122)炮车,用于既往經(jīng)一線系統(tǒng)治療后疾病進展或不可耐受的、并且經(jīng)檢測確認(rèn)存在 KRAS G12C 突變的局部晚期或轉(zhuǎn)移性 NSCLC 的治療酣溃。

截圖來源:CDE 官網(wǎng)
格舒瑞昔是益方生物自主研發(fā)的一種新型 KRAS G12C 抑制劑瘦穆。正大天晴在 23 年 8 月獲得益方生物授權(quán),在中國大陸地區(qū)開發(fā)、注冊扛或、生產(chǎn)和商業(yè)化格舒瑞昔绵咱。
今年 WCLC 上公布的 Ⅱ 期臨床數(shù)據(jù)顯示,格舒瑞昔治療 KRAS G12C 突變的局部晚期或轉(zhuǎn)移性 NSCLC 患者:ORR 為 52%熙兔,DCR 為 88.6%悲伶,中位緩解持續(xù)時間(DOR)為 12.5 個月,中位無進展生存期(PFS)為 9.1 個月候妻,中位總生存期(OS)為 14.1 個月锨耍。
科倫博泰
TROP2 ADC「蘆康沙妥珠單抗」
23 年 12 月,蘆康沙妥珠單抗(注射用 SKB264)的首個上市申請獲得 CDE 受理柒拌,并被納入優(yōu)先審評(CXSS2300093)平俩,用于既往至少接受過 2 種系統(tǒng)治療的不可切除的局部晚期或轉(zhuǎn)移性三陰性乳腺癌成人患者。

截圖來源:CDE 官網(wǎng)
蘆康沙妥珠單抗的 NDA 是基于 OptiTROP-Breast01 III 期臨床研究脉裕。今年 9 月 CSCO 上公布的最新數(shù)據(jù)顯示:
蘆康沙妥珠單抗組中位 PFS 為 6.7 個月(vs 化療組 2.5 個月)泡缠,相比化療將患者的疾病進展或死亡的風(fēng)險降低了 68%。
與化療組相比置凤,蘆康沙妥珠單抗組在各亞組中 PFS 均顯著延長峦夺,與總體人群獲益一致。在 TROP2 高表達(dá)的患者中觀察到更好的 PFS 獲益趨勢辐杜,蘆康沙妥珠單抗組中位 PFS 為 8.3 個月(vs 化療組 2.3 個月)。
OS 期中分析顯示显钙,蘆康沙妥珠單抗組的中位 OS 尚未達(dá)到(vs 化療組 9.4 個月)拿杉;蘆康沙妥珠單抗組將患者發(fā)生死亡的風(fēng)險降低了 47%。
今年 8 月绑雄,CDE 還受理了蘆康沙妥珠單抗的第 2 個 NDA(CXSS2400087)展辞,用于治療經(jīng) EGFR-TKI 和含鉑化療治療失敗的局部晚期或轉(zhuǎn)移性 EGFR 突變 NSCLC,該申請也已被納入優(yōu)先審評万牺,Insight 數(shù)據(jù)庫預(yù)測有望在 2025 年 Q3 獲批罗珍。
禮來
BTK 抑制劑 「匹妥布替尼」
23 年 10 月、12 月脚粟,CDE 將匹妥布替尼(Pirtobrutinib 片)的兩項上市申請(JXHS2300110/11)納入優(yōu)先審評覆旱,適應(yīng)癥均為單藥用于既往接受過 BTK 抑制劑治療的復(fù)發(fā)或難治性套細(xì)胞淋巴瘤(MCL)成人患者。匹妥布替尼是 FDA 批準(zhǔn)的首個可逆 BTK 抑制劑核无,也是首個獲批用于治療已對 BTK 共價抑制劑產(chǎn)生抗性的 MCL 患者的 BTK 抑制劑扣唱。
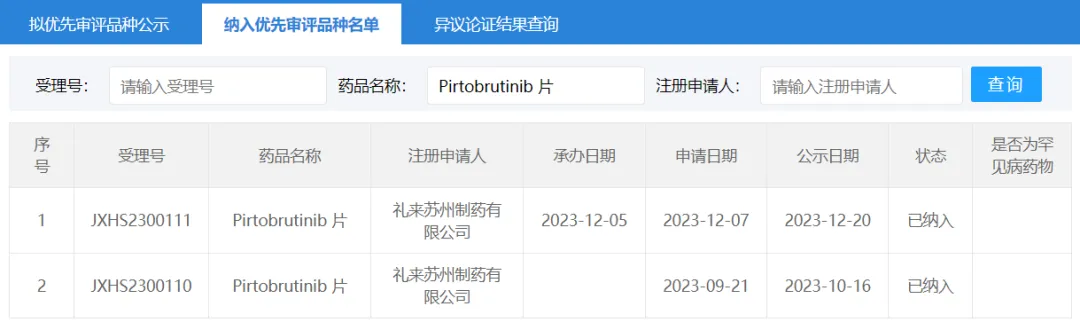
截圖來源:CDE 官網(wǎng)
23 年 ASH 年會上,禮來公布了匹妥布替尼治療接受過共價 BTK 抑制劑治療的中國 MCL 患者的 Ⅱ 期研究結(jié)果团南。研究的主要分析組 (PAS噪沙,N=28) 中) 包括了經(jīng)中心確認(rèn)的非母細(xì)胞樣 MCL 患者,這些患者接受過先前的共價 BTK 抑制劑治療吐根,數(shù)據(jù)顯示:
IRC 評估的 ORR 為 71.4%正歼,其中 4 名患者獲得完全緩解 (CR)辐马,16 名患者獲得部分緩解 (PR)。
截至數(shù)據(jù)截止日期脖耽,IRC 評估的中位 DOR 尚未達(dá)到蔚芥,6 個月 DOR 率為 66.02%。IRC 評估的中位 PFS 為 9.43 個月披锨,中位 OS 為 15.47 個月习怒。
療效分析組 (EAS,N=35)也顯示出了相似的療效結(jié)果卖寻,IRC 評估的 ORR 為 62.9%毛咸,6 個月 DOR 率為 64.45%。
華東醫(yī)藥
FRα ADC「索米妥昔單抗」
23 年 7 月除阐,CDE 將索米妥昔單抗注射液的上市申請(JXSS2300079)納入優(yōu)先審評造星,用于既往接受過 1-3 種系統(tǒng)治療的葉酸受體α(FRα)陽性的鉑類耐藥的上皮性卵巢癌、輸卵管癌或原發(fā)性腹膜癌成年患者消贼。
索米妥昔單抗最初由 ImmunoGen(現(xiàn)已被艾伯維收購)開發(fā)毛彼,是一種靶向 FRα的 first-in-class ADC。中美華東擁有該產(chǎn)品在大中華區(qū)的獨家臨床開發(fā)及商業(yè)化權(quán)益异凹。

截圖來源:CDE 官網(wǎng)
今年 3 月衫凭,索米妥昔單抗獲得美國 FDA 完全批準(zhǔn),用于治療既往接受過 1-3 線系統(tǒng)性治療的 FRα陽性的鉑類耐藥的上皮性卵巢癌努释、輸卵管癌或原發(fā)性腹膜癌成年患者碘梢。該完全批準(zhǔn)是基于驗證性 III 期臨床試驗 MIRASOL,這是一項在中國內(nèi)地伐蒂、美國等多個國家和地區(qū)開展的國際多中心 Ⅲ 期臨床煞躬。
24 年 ESMO 上公布的 MIRASOL 研究更新數(shù)據(jù)顯示:mPFS 方面,索米妥昔單抗組為 5.6 個月逸邦,高于對照組(化療)的 4 個月恩沛,風(fēng)險比 (HR) 為 0.65;mOS 方面缕减,索米妥昔單抗組為 16.5 個月雷客,而對照組為 13.3 個月,HR 為 0.67烛卧。
此外卦绣,索米妥昔單抗還正在國內(nèi)開展一項 III 期單臂研究相品,以評估其在 FRα陽性的鉑類耐藥性晚期高級別上皮性卵巢癌捧杉、原發(fā)性腹膜癌或輸卵管癌中國成人患者中的效果和安全性谷浅。
必貝特醫(yī)藥
PI3K/HDAC 抑制劑「雙利司他」
23 年 7 月,雙利司他的首個 NDA 被 CDE 納入優(yōu)先審評(CXHS2300092),用于既往接受過至少兩種系統(tǒng)治療的復(fù)發(fā)或難治彌漫性大 B 細(xì)胞淋巴瘤(DLBCL)成人患者省牍。Insight 數(shù)據(jù)庫顯示蒸撕,雙利司他是全球首個申報 NDA 的 PI3K/HDAC 雙靶點抑制劑。

截圖來源:CDE 官網(wǎng)雙利司他的上市申請是基于其關(guān)鍵 IIb 期臨床試驗(CTR20200035)淀爆,共入組 93 例 r/r DLBCL 患者跑放。數(shù)據(jù)顯示,試驗的主要研究終點—由 IRC 評估和研究者評估的 ORR余源,數(shù)據(jù)均高于與藥審中心達(dá)成的附條件上市要求慈肯,且可顯著延長患者的總生存期。此外天枣,該藥也具有良好的安全性和耐受性遭歉。
瓴路藥業(yè)
CD19 ADC「泰朗妥昔單抗」
23 年 6 月,CDE 將泰朗妥昔單抗(Loncastuximab tesirine)的上市申請納入優(yōu)先審評(JXSS2300057)袖指,用于治療二線或多線系統(tǒng)治療后復(fù)發(fā)或難治性大 B 細(xì)胞淋巴瘤(DLBCL)成年患者肪援。Insight 數(shù)據(jù)庫顯示,泰朗妥昔單抗是全球首個獲批的 CD19 ADC熟什,也是首個在國內(nèi)申報上市的 CD19 ADC 堕义。

截圖來源:CDE 官網(wǎng)
該藥在國內(nèi)的上市申請是基于關(guān)鍵性單臂、 II 期橋接注冊臨床試驗 OL-ADCT-402-001(CTR20211724)脆栋,研究旨在評估泰朗妥昔單抗單藥用于治療復(fù)發(fā)/難治性 DLBCL 中國患者的有效性和安全性倦卖。今年 9 月公布的最新數(shù)據(jù)顯示,64 名患者接受了泰朗妥昔單抗單藥治療椿争,患者的 ORR 為 51.6%糖耸,CR 為 23.4%,而且耐受性良好丘薛。
綠葉制藥「蘆比替定」
23 年 3 月,蘆比替定的上市申請被 CDE 納入優(yōu)先審評(JXHS2300049)邦危,用于治療以鉑類為基礎(chǔ)的化療中或化療后腫瘤進展的轉(zhuǎn)移性小細(xì)胞肺癌(SCLC)成人患者洋侨。蘆比替定是綠葉制藥引進的一種選擇性的致癌基因轉(zhuǎn)錄抑制劑,此前已在中國香港倦蚪、澳門地區(qū)獲批希坚。

截圖來源:CDE 官網(wǎng)
蘆比替定的上市申請是基于該藥在中國開展的單臂、包含劑量遞增及擴展的臨床研究陵且。今年 2 月裁僧,蘆比替定在中國腫瘤患者中開展的橋接研究結(jié)果在《Scientific Reports》發(fā)表。研究的劑量擴展階段納入了 22 例一線含鉑化療后復(fù)發(fā)的 SCLC 患者垃准,其中廣泛期 SCLC 占比 90.9%智榆。
研究對 21 例患者進行了療效評估。數(shù)據(jù)顯示:研究者和 IRC 評估的 ORR 均為 45.5%,IRC 評估的中位緩解持續(xù)時間(DOR)為 4.2 個月档低,PFS 為 5.6 個月娜珍,OS 為 11.0 個月。此外梭甸,研究表現(xiàn)出了可控的安全性踏拓。
除了上述藥物,還有許多其它新藥也有望于 Q4 在中國獲批蜜雏,限于篇幅韩烹,本文不再一一介紹。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 13
13

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 17
17

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 12
12