
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-10-21
2024-10-21
 88
88
10月16日蹲自,GSK宣布美國(guó)FDA已受理Gepotidacin的新藥上市申請(qǐng)(NDA)并授予其優(yōu)先審評(píng)資格搔谴,用于治療單純性尿路感染(uUTI)的女性成人患者(≥40kg)和青少年患者(≥12歲盖喷,≥40kg),PDUFA日期為2025年3月26日张重。

Gepotidacin是一種在研的靶向拓?fù)洚悩?gòu)酶II(Top II)的first in class新型口服抗生素抛惶,其結(jié)構(gòu)屬于三氮雜苊烯類,不同于現(xiàn)有的喹諾酮類抗生素紊竹。相比于喹諾酮類抗生素(單一抑制Top II或Top IV)牺道,Gepotidacin具有全新的作用機(jī)制,可選擇性且均衡抑制細(xì)菌DNA回旋酶(Top II的一種)和Top IV壹会,從而抑制細(xì)菌DNA復(fù)制。由于Gepotidacin對(duì)Top II和Top IV為均衡抑制铲桑,因此及键,當(dāng)這兩種酶均發(fā)生突變時(shí)才會(huì)顯著影響細(xì)菌對(duì)Gepotidacin的敏感性。
Gepotidacin結(jié)構(gòu)
此次申請(qǐng)得到了兩項(xiàng)關(guān)鍵性III期研究的陽(yáng)性數(shù)據(jù)支持掺薪,即EAGLE-2和EAGLE-3研究胸胚。EAGLE-2和EAGLE-3研究均為全球性、隨機(jī)啤邑、雙盲垫嚣、非劣效性(界限值為10%)III期臨床研究,共納入了3136例患者津函,旨在評(píng)估Gepotidacin(1500mg肖粮,每日2次)對(duì)比呋喃妥因(100mg,每日2次)治療uUTI的有效性和安全性尔苦。研究的主要終點(diǎn)為第10~13天治愈檢驗(yàn)期(TOC)訪視時(shí)產(chǎn)生治療應(yīng)答(包括臨床應(yīng)答和微生物學(xué)應(yīng)答)的患者數(shù)量涩馆。在EAGLE-2研究中,Gepotidacin組有50.6%的患者實(shí)現(xiàn)“治療成功”允坚,呋喃妥因組為47.0%魂那。在EAGLE-3研究中,Gepotidacin組有58.5%的患者實(shí)現(xiàn)“治療成功”稠项,呋喃妥因組為43.6%涯雅。此外,在治療失敗風(fēng)險(xiǎn)更高的關(guān)鍵亞組中展运,Gepotidacin也表現(xiàn)出一致的非劣效于呋喃妥因的療效活逆,包括大腸桿菌病原體對(duì)其他抗生素耐藥的患者、有復(fù)發(fā)史的患者和50歲以上的患者乐疆。
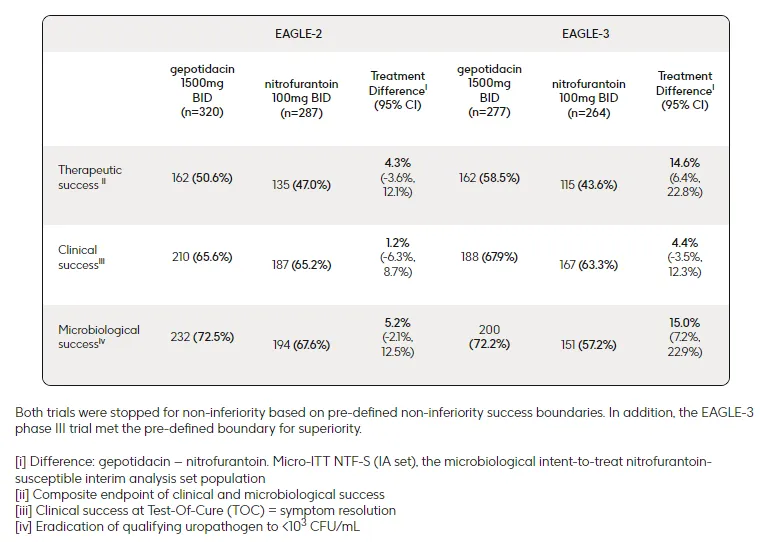
EAGLE-2和EAGLE-3研究主要結(jié)果(來(lái)源:GSK官網(wǎng))
Gepotidacin組最常報(bào)告的不良事件(AE)是胃腸道反應(yīng)划乖,其中腹瀉(16%)和惡心(9%)較為常見贬养。不過(guò)這些AE的嚴(yán)重程度大多數(shù)為輕度(1級(jí),69%)和中度(2級(jí)阶庆,28%)郎博。非復(fù)雜性尿路感染 (uUTI) 是最常見的門診感染,超過(guò)一半的女性在其一生中會(huì)患上uUTI铺享,超過(guò)四分之一的女性患有復(fù)發(fā)性u(píng)UTI抱壶。Gepotidacin一旦獲批,將成為20多年來(lái)首個(gè)治療uUTI 的新型口服抗生素潘乖。

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-10-21
2024-10-21
 88
88

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-10-21
2024-10-21
 78
78

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-10-21
2024-10-21
 89
89
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽