
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 阿基米德Biotech
阿基米德Biotech  2024-10-22
2024-10-22
 147
147
中美至今未批準任何一款干細胞藥物。
干細胞高端局在國內(nèi)風(fēng)起云涌耽晦,療程一次標價7.8萬元至20萬元,2022年7月车崔,有人在江西九江被騙450余萬元。干細胞在醫(yī)學(xué)界被稱為萬用細胞福吩,被套利群體演繹成包治百病述尊、返老還童的神藥。只有當合規(guī)產(chǎn)品正常供給之后秆惑,這一領(lǐng)域才有可能河清海晏赛羡。
干細胞合規(guī)市場明年初迎來開天辟地時刻。Mesoblast于2024年7月向FDA重新提交remestemcel-L上市申請哗蛋,PDUFA日期為2025年1月7日,有望成為美國首個獲批的干細胞創(chuàng)新藥园担。2024 年6月届谈,鉑生卓越生物的艾米邁托賽注射液成為國內(nèi)首款獲得國家藥監(jiān)局新藥上市申請正式受理并納入優(yōu)先審評的干細胞新藥。
成藥性解決后弯汰,巨大的臨床需求將在合規(guī)產(chǎn)品上集中釋放艰山。
從2018年到2024年7月湖雹,國內(nèi)干細胞新藥 IND獲批83個,進入臨床60個曙搬。據(jù)醫(yī)藥魔方數(shù)據(jù)不完全統(tǒng)計摔吏,國內(nèi)干細胞創(chuàng)新藥處于III期臨床試驗4項,II期臨床試驗11項纵装。
等待一支穿云箭征讲。
黎明降至
干細胞是人體中具有自我更新能力、多功能性和再分化能力的細胞橡娄,具有分化成各種組織和器官的潛能诗箍。作為重要的再生醫(yī)學(xué)產(chǎn)品,干細胞進入人體挽唉,哪里有損傷滤祖、老化、病變片家,就在哪里聚集走木,可能應(yīng)用到幾乎涉及人體所有重要組織器官的修復(fù)及研究,攻克人類諸多醫(yī)學(xué)醫(yī)美難題肿兴,根治糖尿病敢添、帕金森綜合征、阿爾茲海默癥叁乍,抗衰除皺季训,疤痕修復(fù)。
可見干細胞療法是一種烏托邦藥物则沃,戳中富裕老人的每一個痛點肝庸,具有濃郁的老錢風(fēng),一度成為高端定制坑章迎。
干細胞療法面臨著倫理和成藥挑戰(zhàn)吓死。胚胎干細胞(ESC)效果最佳,卻需要破壞人類胚胎焚寂,存在倫理爭議普晌。誘導(dǎo)性多能干細胞(iPSC)的發(fā)現(xiàn)克服這一擔憂,卻面臨著另一場倫理爭議沧奴,其無限的分化能力有朝一日可能應(yīng)用于人類克隆痘括,并且在臨床治療中仍具有高風(fēng)險,這些細胞經(jīng)移植可能會誘導(dǎo)腫瘤形成滔吠。雖然間充質(zhì)干細胞被普遍認為是安全的纲菌,在當前臨床應(yīng)用中最多,從組織中分離獲得并在體外培養(yǎng)和擴增疮绷,具有增殖能力強翰舌、分化潛力廣泛的優(yōu)點嚣潜,但其持續(xù)監(jiān)測和長期隨訪將是未來研究重點,需觀察椅贱、避免治療后形成腫瘤懂算。間充質(zhì)干細胞規(guī)模化生產(chǎn)需要突破庇麦,供體單次取材難以滿足大規(guī)模商業(yè)化生產(chǎn)需求计技,而不同供體來源的細胞存在生物特性差異,只有保證細胞批次間產(chǎn)量和質(zhì)量的穩(wěn)定性才有可能提高制劑生產(chǎn)效率女器,獲得可重復(fù)的臨床療效口迟。
緩慢的進步始終在發(fā)生,F(xiàn)DA也快要動心巨脚。Mesoblast今年以來股價已上漲353%保蒲。
今年7月23日,F(xiàn)DA接受Mesoblast公司細胞療法remestemcel-L的生物制品許可申請重新提交敢弟,用于治療類固醇難治性急性移植物抗宿主苍羟洹(SR-aGVHD)兒童,如果獲得批準捅振,將成為美國首個同種異體現(xiàn)貨型細胞療法彬率,早于通用CAR-T取得突破。
remestemcel-L是一種同種異基因間充質(zhì)干細胞療法怯糠,其細胞來源于無關(guān)供體的骨髓署隔,通過抑制T細胞增殖,和下調(diào)促炎細胞因子和干擾素的產(chǎn)生瓦统,來調(diào)節(jié)T細胞介導(dǎo)的炎癥反應(yīng)贿妹。此前已公開的一項III期試驗結(jié)果顯示,患者接受治療后第28天的客觀緩解率(ORR)為69%金矛,與45%歷史控制率相比芯急,有統(tǒng)計學(xué)意義的顯著增加。在接受至少一次輸注治療且隨訪100天的患者中驶俊,患者的死亡率為22%娶耍,而接受初始類固醇治療無效的患者第100天死亡率高達70%。
即使Mesoblast遇挫饼酿,后面還有大將福泰制藥為干細胞療法托底榕酒。
一名叫Amanda Smith的35歲護士患有1型糖尿病,一直依賴胰島素維持生命嗜湃。直到2023年情人節(jié)奈应,她接受一項開創(chuàng)性干細胞療法。醫(yī)生將實驗室中從胚胎干細胞中培養(yǎng)出來的替代胰島細胞移植到為Amanda Smith的肝臟供血的血管中购披。到8月杖挣,她不再需要胰島素了,新細胞正在大量生產(chǎn)胰島素刚陡。
Amanda Smith接受的干細胞療法惩妇,是福泰制藥的VX-880,正向關(guān)鍵臨床階段邁進筐乳。
VX-880是一種研究性同種異體干細胞衍生撤掀、完全分化、產(chǎn)生胰島素的胰島細胞療法涨给,其Ⅰ/Ⅱ期臨床試驗數(shù)據(jù)顯示拂谆,所有接受全劑量單次輸注的12名患者在第90天時均展現(xiàn)出胰島細胞移植成功及對葡萄糖有反應(yīng)的胰島素生成,均達到HbA1c水平低于7.0%的目標水平念肆。并有超過70%的時間血糖值處于正常范圍(70-180 mg/dL)姓纲,其中11位患者減少外源性胰島素使用或完全停用。
VX-880臨床試驗中2名患者死亡徊疆,后經(jīng)獨立監(jiān)督委員會審查數(shù)據(jù)并確定死亡與試驗治療無關(guān)愕啰,臨床試驗恢復(fù)。福泰制藥還有VX-880的升級版棉莹,將與VX880相同的同種異體干細胞衍生的胰島細胞封裝在類似于“海蜇”的裝置中温盅,大小約為一枚硬幣,可通過手術(shù)植入患者體內(nèi)梢拜,且無需使用免疫抑制療法改耽。
現(xiàn)在輪到中國藥企上場了。
2024年5月30日叁巨,北京市藥監(jiān)局核發(fā)全國第一張干細胞《藥品生產(chǎn)許可證》斑匪,獲得者正是鉑生卓越,引起轟動俘种,預(yù)示著合規(guī)干細胞藥物即將進入產(chǎn)業(yè)化階段秤标。
6月,鉑生卓越自主研發(fā)的艾米邁托賽注射液(人臍帶間充質(zhì)干細胞)上市申請獲得受理宙刘,適應(yīng)癥為激素失敗的急性移植物抗宿主膊越(aGVHD),有望成為全國首款干細胞新藥悬包。
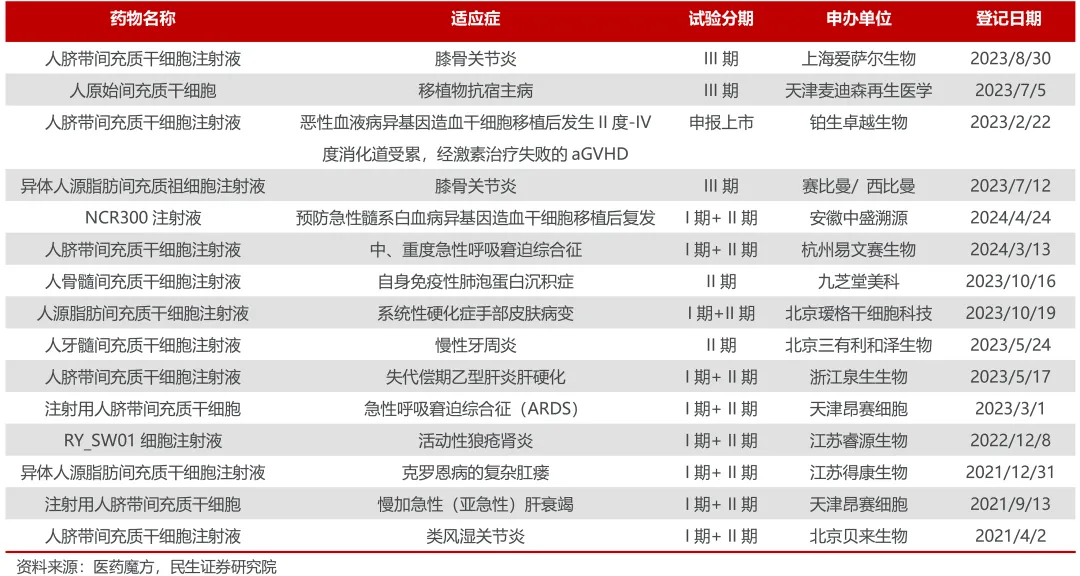
國內(nèi)臨床II期后干細胞創(chuàng)新藥研發(fā)情況(不完全統(tǒng)計)
群起撞線
在鉑生卓越身后衙猪,還有3款干細胞創(chuàng)新藥也即將撞線,分別來自愛薩爾生物(膝骨關(guān)節(jié)炎布近,III期)垫释、麥迪森再生醫(yī)學(xué)(移植物抗宿主病,III期)、賽比曼/ 西比曼(膝骨關(guān)節(jié)炎棵譬,III期)显蝌,行業(yè)漸呈洶涌澎湃之勢。
中源協(xié)和布局干細胞全產(chǎn)業(yè)鏈唠俄,參股公司牙髓干細胞藥物有望成為大單品惨浩。
公司主導(dǎo)或參與的11個干細胞臨床研究項目完成備案,全資子公司武漢光谷藥業(yè)核心產(chǎn)品VUM02共開發(fā)8個適應(yīng)癥杜戈,為自研的冷凍保存型細胞制劑赫窄,是由經(jīng)篩選的健康新生兒臍帶組織通過體外分離、擴增拉拨、收獲臭脯、凍存后制備的人臍帶源間充質(zhì)干/基質(zhì)細胞(UC-MSC)新藥,其中用于治療特發(fā)性肺纖維化(IPF)2023年8月獲得FDA授予的孤兒藥資格認定旦坷。
參股的北京三有利和澤生物與首都醫(yī)科大學(xué)共同申報的人牙髓間充質(zhì)干細胞注射液治療慢性牙周炎是國內(nèi)首個獲得IND 受理的干細胞新藥谒娩,于2023年5月進入II期臨床試驗,目前已有受試者入組給藥宽缴。
傳統(tǒng)牙周炎治療聚焦炎癥控制迎反,阻止或延緩疾病進程,難以獲得滿意的牙周組織再生趾迈,目前臨床常用的植骨術(shù)依賴手術(shù)方式實施旷似。國內(nèi)外尚無與“人牙髓間充質(zhì)干細胞注射液”局部注射治療類似的非侵入式的牙周組織再生引導(dǎo)技術(shù)。
牙周炎發(fā)病率高乔煞,危害大吁朦,是導(dǎo)致成年人牙齒缺失的最主要原因。據(jù)民生證券測算渡贾,2023年我國中重度牙周炎患者約10087萬人逗宜,三有利牙髓干細胞預(yù)計2027年獲批上市銷售,至少在2031年前享有市場獨占期空骚,2033年銷售額有望達到約77億元纺讲。
天士力引進的remestemcel-L暫停研究,是悲是喜囤屹?
2018 年7月熬甚,天士力與前文所述干細胞明星Mesoblast簽署MPC-150-IM(rexlemestrocel-L)產(chǎn)品開發(fā)商業(yè)化協(xié)議。2023 年1月肋坚,公司公告決定暫停rexlemestrocel-L研究工作乡括,主要是在美國審評審批遇到波折,是否倒在黎明前的黑暗智厌?然而诲泌,2024 年3月,F(xiàn)DA支持Rexlemestrocel-L用于終末期射血分數(shù)降低( HFrEF )和植入左心室輔助裝置( LVAD )心衰患者的加速批準申請。
在前沿領(lǐng)域的創(chuàng)新需要堅持的勇氣予裳。
不過澈渠,天士力從東方醫(yī)院引進的人臍帶間充質(zhì)干細胞注射液(B2278注射液),今年1月獲批開展心衰適應(yīng)癥的臨床試驗兆婆。
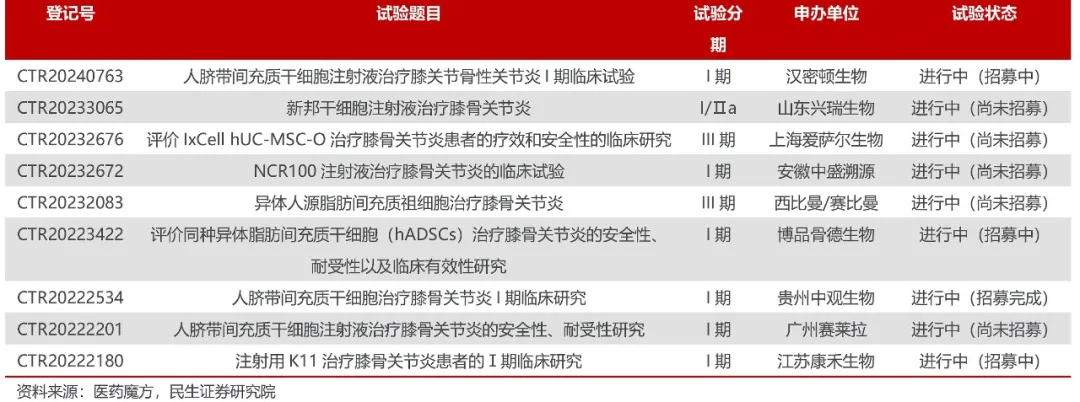
國內(nèi)骨關(guān)節(jié)適應(yīng)癥干細胞創(chuàng)新藥研發(fā)情況
干細胞療法圍攻關(guān)節(jié)炎大適應(yīng)癥植嚼。
骨關(guān)節(jié)炎( osteoarthritis遏貌,OA) 是一種嚴重影響患者生活質(zhì)量的關(guān)節(jié)退行性疾病婿哥,隨著我國人口老齡化程度的不斷加劇,OA的患病率有逐漸上升的趨勢获玻。據(jù)《中國骨關(guān)節(jié)炎診療指南(2021年版)》酣矮,我國40歲及以上人群不同年齡段原發(fā)性 OA 患病率分別為:30.1%(40~49 歲)、48.7%(50~59歲)缕兄、62.2%(60~69歲)和62.1%(70歲以上)颅挟;由此估算我國OA患病人數(shù)約有3.59 億。
2021 年9月6日弓洒,發(fā)表于《The Knee》的一項薈萃分析通過對 79 項(包含 8761名膝骨關(guān)節(jié)炎患者)的隨機對照臨床試驗進行系統(tǒng)總結(jié)證實:在長達一年的隨訪中而芥,干細胞注射對膝骨關(guān)節(jié)炎患者的疼痛和功能有最大的改善作用,優(yōu)于其他骨關(guān)節(jié)炎治療方式膀值。
我武生物子公司我武干細胞持續(xù)開展干細胞領(lǐng)域的研究開發(fā)棍丐,完成自研完全培養(yǎng)基、分化培養(yǎng)基(成脂沧踏、成骨歌逢、成軟骨)的開發(fā),相關(guān)培養(yǎng)基已應(yīng)用于干細胞治療骨關(guān)節(jié)炎項目中翘狱,正全力推進干細胞治療藥物的臨床前研究秘案。
Biotech進度更快,西比曼與愛薩爾兩家均已開展III期臨床潦匈。新三板上市公司賽萊拉人臍帶間充質(zhì)干細胞注射液治療膝骨關(guān)節(jié)炎新藥I 期臨床試驗完成首例患者給藥阱高。
針對缺血性腦卒中后偏癱是新興熱點。
ST 九芝堂子公司北京美科同種異體骨髓間充質(zhì)干細胞治療缺血性腦卒中處于I/ II期臨床茬缩。據(jù)醫(yī)藥魔方數(shù)據(jù)赤惊,國內(nèi)另有5家公司也在布局缺血性卒中干細胞產(chǎn)品。
成藥性在日本得到驗證寒屯。由于腦細胞不可再生荐捻,針對慢性運動功能障礙及其他后遺癥一直缺乏有效的治療手段,2024年7月下桃,SanBio 開發(fā)的AKUUGO在日本獲批成為全球首款用于此適應(yīng)癥的同種異體間充質(zhì)干細胞昨镊。
首家干細胞Biotech上市公司能成嗎?
澤輝生物向港交所遞表,將申請主板掛牌上市梁捉。
核心產(chǎn)品ZH901處于臨床II期階段追粉,是國內(nèi)首個也是唯一一個源自hESC(人胚干細胞)的干細胞來源細胞治療在研產(chǎn)品,為可用現(xiàn)貨細胞制劑箍属,且可于氣相液氮中穩(wěn)定保存至少3年短硼。
如前文所述胚胎干細胞存在倫理爭議。用于新hESC系來源的胚胎是在父母雙方知情同意的情況下通過體外受精診所獲得公上。只有無法用于不孕治療的多余胚胎才能用于獲取hESC自幕。然而,這種獲取通常需要破壞子宮外胚胎幌扁,此舉會引起倫理問題振袋,在諸多國家為法律所禁止。
澤輝生物還折射出一級市場Biotech的現(xiàn)金流危機憎茂。
2023年末珍语,澤輝生物的現(xiàn)金及現(xiàn)金等價物為1.67億元,而到今年8月底竖幔,已降至0.67億元板乙,這意味著歷輪融資累計獲得的6.88億元已快燒完。
在另外一面拳氢,澤輝生物計劃10億元建設(shè)中山工廠募逞,預(yù)計2024年底開工,2026年下半年完成饿幅,年產(chǎn)能約為500000支細胞療法產(chǎn)品注射液凡辱。
奇跡會發(fā)生嗎?

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 生輝
生輝  2024-11-25
2024-11-25
 7
7

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Medaverse
Medaverse  2024-11-25
2024-11-25
 7
7

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-11-25
2024-11-25
 6
6