
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 細胞與基因治療領域
細胞與基因治療領域  2024-10-25
2024-10-25
 64
64
去年衍周,全球AAV基因療法的市場銷售額達到了15億美元纽门,據(jù)預測,到2029年這一數(shù)字將增長至223億美元。這表明AAV基因療法擁有廣闊的市場前景。據(jù)不完全統(tǒng)計,目前夸营,國內(nèi)已44款AAV基因藥物IND申報獲批,其中漾肩,至少4款進入III期臨床贫介。按照其IND獲批時間順序匯總?cè)缦拢?/strong>
1、因諾惟康的IVB103
2024年10月15日掘鱼,因諾惟康的IVB103注射液獲得國家藥品監(jiān)督管理局審評中心(CDE)的臨床許可翠蓄。此外,該產(chǎn)品已于7月獲得FDA的IND許可鸣拦。
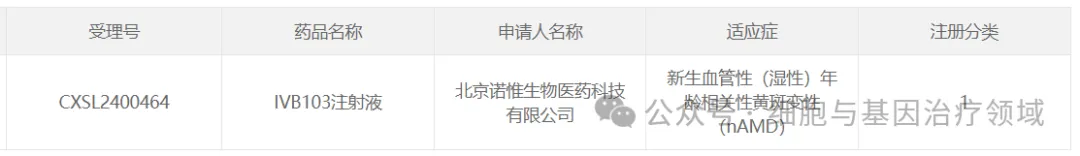
IVB103注射液是在因諾惟康自主研發(fā)的新型載體基礎上開發(fā)的一款可玻璃體內(nèi)給藥的治療新生血管性年齡相關性黃斑變性(nAMD)的藥物抢纹。臨床前數(shù)據(jù)顯示IVB103優(yōu)于國際在研的同類先進產(chǎn)品,具有“best in class”的潛力葱妒。
2谚剿、諾潔貝生物的NGGT007
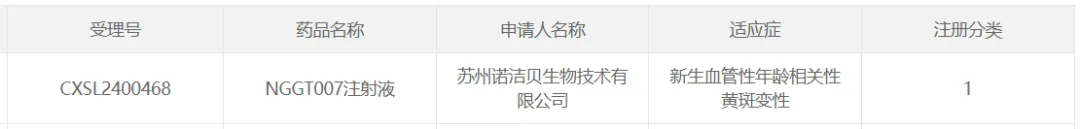
2024年10月15日,據(jù)CDE官網(wǎng)公示连锯,諾潔貝生物的NGGT007注射液獲臨床許可归苍,擬用于新生血管性年齡相關性黃斑變性。
3运怖、瑞宏迪醫(yī)藥的RGL-193
2024年10月11日拼弃,CDE官網(wǎng)公示,恒瑞醫(yī)藥子公司上海瑞宏迪醫(yī)藥有限公司(以下簡稱“瑞宏迪”)自主研發(fā)的AAV雙基因藥物RGL-193注射液獲批臨床摇展。

圖片來源:CDE官網(wǎng)
據(jù)悉肴敛,這是國內(nèi)首個用于帕金森病患者的AAV雙基因藥物,旨在提高左旋多巴的轉(zhuǎn)化效率吗购,保護并修復受損的多巴胺能神經(jīng)元,以期達到延緩疾病進展砸狞,減少口服抗帕金森藥物用量的目的捻勉。此前,瑞宏迪發(fā)布消息稱刀森,由瑞宏迪支持踱启,中國科技大學附屬第一醫(yī)院神經(jīng)內(nèi)科施炯教授團隊、神經(jīng)外科牛朝詩教授團隊共同參與開展的IIT臨床研究(ChiCTR2400082369)已完成了國內(nèi)首例帕金森病患者AAV雙基因藥物手術給藥研底。該手術使用腦立體定向技術和對流增強給藥技術庵恨,成功將RGL-193注射液遞送至患者腦組織特定靶區(qū),患者術后恢復良好,已平安出院诀烫。
4榔况、瑞風生物的RM-101
瑞風生物自主研發(fā)的Usher綜合征基因編輯藥物RM-101新藥臨床試驗申請,于2024年10月11日獲得CDE的默示許可勃拢。此外钩榄,RM-101已在美國時間2024年9月17日獲得美國食品藥品監(jiān)督管理局(FDA)的IND批準。

RM-101是瑞風生物開發(fā)的針對Usher綜合征USH2A基因相關視網(wǎng)膜色素變性的創(chuàng)新藥物產(chǎn)品后涛。RM-101是基于AAV的基因編輯類藥物武也,能特異靶向USH2A RNA,調(diào)控可變剪接生物學過程口愁,誘導功能正常蛋白的表達恢復耿逐。RM-101通過視網(wǎng)膜下注射給藥,有望實現(xiàn)一次性給藥并長期有效鸿挠。
5醇舶、貝思奧的BN-1001
2024年8月28日,南京貝思奧生物科技有限公司自主研發(fā)的基因治療I類創(chuàng)新藥BN-1001眼用注射液的新藥臨床試驗(IND)申請正式獲得CDE默認許可炼幔,用于治療新生血管性(濕性)年齡相關性黃斑變性(wAMD)秋茫。
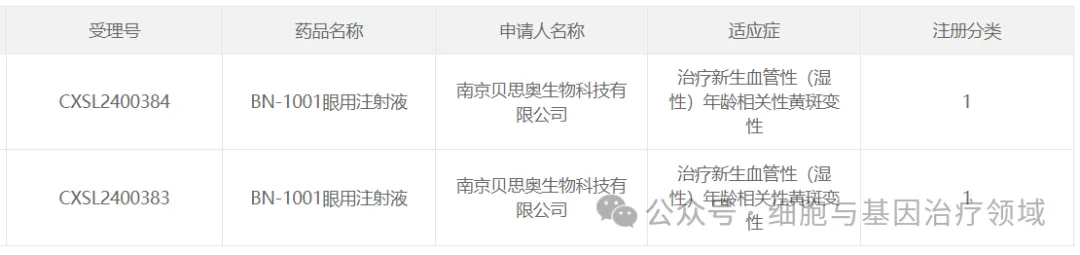
BN-1001眼用注射液采用了AAV基因治療策略,是目前國內(nèi)外已披露的同類產(chǎn)品中劑量最低且能持續(xù)穩(wěn)定表達抗VEGF分子的產(chǎn)品乃秀,該注射液能在患者中最大程度地降低癥狀的發(fā)生率肛著,有望實現(xiàn)“一次治療,終生治愈”的 目標跺讯,滿足當前日益增加的臨床需求枢贿。
6、星眸生物的XMVA09
2024年8月19日刀脏,合肥星眸生物科技有限公司宣布其自主研發(fā)的基因治療I類創(chuàng)新藥“XMVA09注射液”的第2項新藥臨床試驗(IND)申請已獲得國家藥品監(jiān)督管理局(NMPA)批準局荚。今年3月,XMVA09注射液針對濕性年齡相關性黃斑變性(wAMD)適應癥的IND申請獲得CDE臨床默示許可愈污,此次新批準的適應癥為糖尿病性黃斑水腫(DME)耀态。
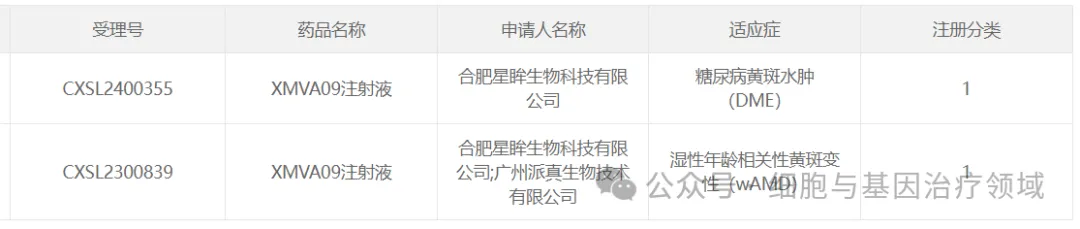
XMVA09注射液是星眸生物自主研發(fā)的基因治療藥物,相比于傳統(tǒng)抗體治療藥物1-3個月的注射周期暂雹,基因治療藥物可產(chǎn)生持續(xù)的治療作用首装,有望實現(xiàn)一次注射便終身有效,極大地造赶胃患者赊偿。XMVA09注射液采用全新的AAV衣殼,通過玻璃體腔內(nèi)注射即可感染到緊貼脈絡膜病灶的視網(wǎng)膜色素上皮層(RPE)細胞悬鲜,為后續(xù)臨床應用提供了更便捷的途徑绅鉴。此外,XMVA09注射液采用雙抗設計,同時靶向血管內(nèi)皮生長因子(VEGF)和血管生成素-2(ANG-2)雙靶點既蛙,提高了藥物的治療效果仲侈,增加了對于VEGF不敏感患者的覆蓋范圍。2024年6月21日农帝,XMVA09注射液順利完成wAMDⅠ期臨床試驗首例患者給藥误目。
7、瑞吉康的RJK002
2024年5月9日舆飒,上海瑞吉康生物醫(yī)藥有限公司1類新藥RJK002注射液獲CDE臨床試驗默示許可轴私,適應癥為肌萎縮側(cè)索硬化(簡稱“ALS”,也稱“漸凍癥”)能真。這是中國首款獲批臨床的漸凍癥AAV基因治療藥物赁严,也是全球首款靶向蛋白質(zhì)異常聚集的漸凍癥AAV基因治療藥物。
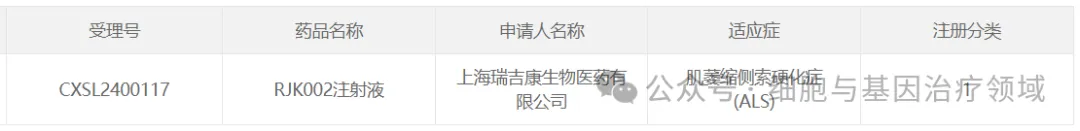
瑞吉康RJK系列藥物可“溶解”已經(jīng)聚集的病原蛋白粉铐,阻滯異常聚集蛋白的進一步形成疼约,恢復生物體內(nèi)蛋白質(zhì)“相分離”平衡,從而恢復神經(jīng)元細胞功能蝙泼,實現(xiàn)對神經(jīng)退行性疾病的治療程剥。RJK002在臨床前漸凍癥模型動物實驗中獲得了顯著的神經(jīng)元保護和生存期延長的治療效果,并于去年10月獲美國FDA孤兒藥資格認定(ODD)汤踏。2024年9月24日织鲸,RJK002Ⅰ期臨床試驗啟動會在北京大學第三醫(yī)院順利舉行,標志著RJK002項目正式進入臨床試驗研究全速推進階段溪胶。
8搂擦、泰昶生物的VGN-R09b
2024年4月19日,上海天澤云泰生物醫(yī)藥有限公司及其全資子公司上海泰昶生物技術有限公司開發(fā)的AAV基因治療藥物VGN-R09b獲國家藥品監(jiān)督管理局簽發(fā)的藥物臨床試驗批準通知書哗脖,同意開展治療原發(fā)性帕金森病和芳香族L-氨基酸脫羧酶缺乏癥(AADCD)的臨床試驗瀑踢。
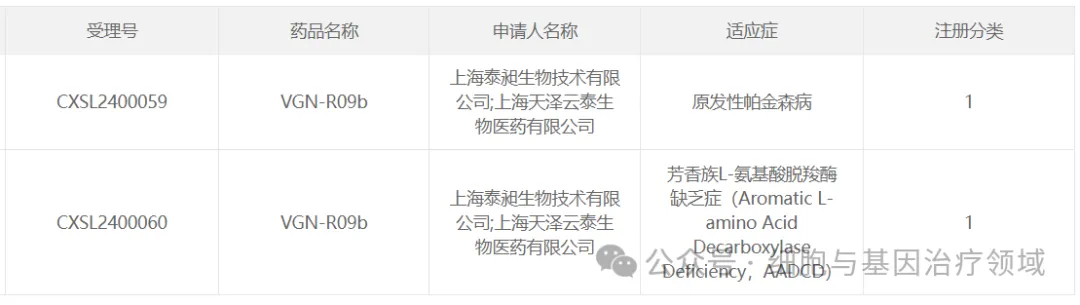
VGN-R09b是上海天澤云泰生物醫(yī)藥有限公司自主研發(fā)的基因治療產(chǎn)品,使用重組AAV作為基因載體才避,以遞送有功能的AADC為基礎恢復多巴胺的生成咱茂,從而發(fā)揮相應的潛在的治療作用。通過局部紋狀體注射的方式棕优,使藥物能夠直接作用于發(fā)病部位靡黑,減少全身的給藥劑量,從而減少相應的免疫反應等不良反應敢薄。理論上,一次給藥長期療效挎茂。該療法的臨床研究(IIT)“VGN-R09b在AADC缺乏癥患者中紋狀體內(nèi)注射用藥的耐受性艇线、安全性和有效性的開放、劑量遞增的早期臨床研究”,于2023年年初游鹿,在上海交通大學醫(yī)學院附屬上海兒童醫(yī)學中心順利啟動盔惑。據(jù)悉,接受治療后的患兒义誓,身體各項運動功能與智力提升明顯律坎。
9、諾潔貝生物的NGGT002
2024年3月22日蟋定,據(jù)CDE官網(wǎng)公示粉臊,諾潔貝生物的NGGT002注射液獲批臨床,用于治療苯丙酮尿癥驶兜。
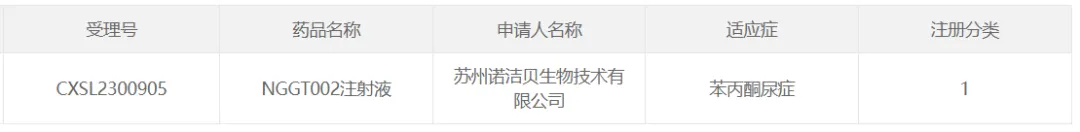
NGGT002注射液是一款治療代謝性疾病的創(chuàng)新性AAV基因治療藥物扼仲。在此之前,NGGT002項目的IIT研究已經(jīng)完成低抄淑、中劑量的患者給藥屠凶,初步結(jié)果表明了安全性與有效性。此前肆资,NGGT002已獲FDA孤兒藥資格認定矗愧。
10、金唯科的JWK001
2024年2月22日郑原,由成都金唯科生物科技有限公司(下稱“金唯科”)自主研發(fā)的針對新生血管性年齡相關性黃斑變性(nAMD)基因治療I類創(chuàng)新藥“JWK001注射液”的新藥臨床試驗(IND)申請順利獲得國家藥品監(jiān)督管理局(NMPA)批準唉韭。
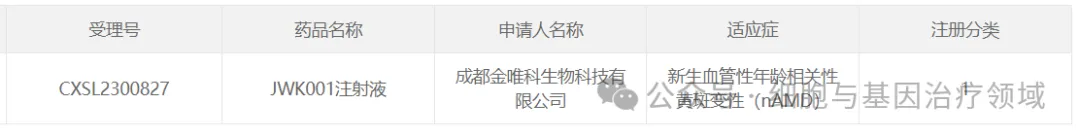
JWK001注射液是首個采用“兩質(zhì)粒包裝系統(tǒng)”的AAV基因治療新藥。據(jù)悉颤专,金唯科自主研發(fā)的兩質(zhì)粒懸浮HEK293細胞包裝技術纽哥,大幅提升了AAV包裝效率、降低了生產(chǎn)成本衙猾。JWK001注射液通過將攜帶全新自主設計的抗VEGF蛋白表達框的AAV載體柬激,在視網(wǎng)膜細胞中持續(xù)高效表達抗VEGF蛋白。該基因治療手段可以避免傳統(tǒng)nAMD治療中存在的風險斧与,如反復玻璃體腔注射對眼組織的傷害行忘、患者依從性差等,可實現(xiàn)一次治療筋劣,終身有效的目的牡徘。
11、中因科技的ZVS203e
2024年2月7日正脸,北京中因科技有限公司首個眼科基因編輯1類創(chuàng)新藥----ZVS203e注射液獲國家藥品監(jiān)督管理局藥品審評中心(CDE)臨床試驗(IND)默示許可式伶。ZVS203e注射液是一款以AAV為載體基于基因編輯技術開發(fā)的1類創(chuàng)新藥,用于治療RHO基因變異導致的視網(wǎng)膜色素變性鄙叼。

ZVS203e注射液是利用第三代人工核酸內(nèi)切酶CRISPR/Cas9贡金,對突變的RHO基因進行定點編輯壕归,針對致病基因從根源對疾病進行治療,達到一次給藥終身治愈的效果衅侥。該藥物于2022年7月獲得FDA孤兒藥資格認定癞季,并于2023年9月在北京大學第三醫(yī)院開展的研究者發(fā)起的臨床研究(IIT)中完成全球首個RHO基因突變RP患者的注射給藥,在首例患者中表現(xiàn)出良好的安全性和有效性倘潜。
12绷柒、至善唯新的ZS805
2024年1月31日,四川至善唯新生物科技有限公司自主研發(fā)的法布雷病基因治療產(chǎn)品ZS805注射液已獲臨床試驗默示許可涮因。至善唯新公司成為國內(nèi)首家法布雷病原創(chuàng)基因新藥獲批臨床的藥企废睦。
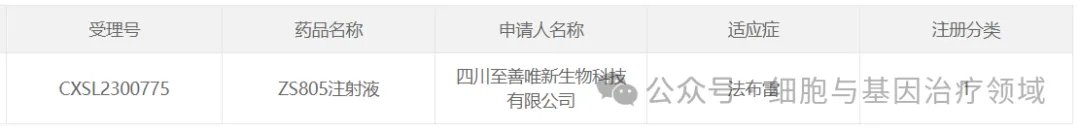
S805是一種rAAV基因治療1類新藥,用于治療法布雷病蕊退。ZS805的基因表達盒框架搭載了至善唯新公司自主研發(fā)的全球最小肝臟特異啟動子和信號肽序列優(yōu)化后的α-半乳糖苷酶A基因郊楣,保證了α-半乳糖苷酶A蛋白在肝臟細胞中特異表達并高效分泌,提高了藥物的安全性與有效性瓤荔。為確保更多患者能夠得到有效治療净蚤,至善唯新挑選了適合中國人群的AAV載體血清型。經(jīng)過動物模型評價输硝,ZS805表達的α-半乳糖苷酶A蛋白在心今瀑、腎等疾病相關器官的分布優(yōu)于國外競品。在華西醫(yī)院開展的IIT研究中点把,已有2名患者入組接受ZS805基因治療橘荠,目前,接受治療的患者整體狀態(tài)良好氢碰,各項指標獲得改善克酿,患者體內(nèi)的半乳糖苷酶活性已達到正常水平,初步驗證了ZS805藥物在人體的安全和有效性申广。
13限匕、凌意生物的LY-M001
2024年1月16日,凌意(杭州)生物科技有限公司(以下簡稱“凌意生物”)自主研發(fā)的I類治療用生物制品LY-M001注射液的新藥臨床試驗(Investigational New Drug东六,IND)申請順利獲得國家藥品監(jiān)督管理局(NMPA)的默示許可(受理號為:CXSL2300730)困荤。

LY-M001注射液是中國首個自主研發(fā),針對I型或III型戈謝病的AAV基因治療藥物待讲。該產(chǎn)品使用重組腺相關病毒rAAV為載體捎鹤,通過單次靜脈輸注給藥后即可表達患者所需的葡萄糖腦苷脂酶。凌意生物開發(fā)了擁有完全自主知識產(chǎn)權的改良型葡萄糖腦苷脂酶基因治療載體殃烤,可在體內(nèi)長期穩(wěn)定表達并降解有害糖脂代謝物亡荞,從而達到長期治療戈謝病的目標。由浙江大學醫(yī)學院附屬第一醫(yī)院黃河院長牽頭發(fā)起的IIT臨床研究項目也已正式啟動并完成首例患者給藥情誊,初步的IIT數(shù)據(jù)顯示:LY-M001在有效性和安全性方面均有良好表現(xiàn)水孩,無任何不良事件發(fā)生箱靴。2024年4月,“一項評估LY-M001注射液治療I型戈謝病成人患者的安全性荷愕、耐受性和有效性的多中心、開放棍矛、單臂安疗、單次給藥、劑量遞增和擴展的I/II期臨床研究”在中國醫(yī)學科學院血液病醫(yī)院(中國醫(yī)學科學院血液學研究所)(以下簡稱“血研所”)順利啟動够委。
14荐类、九天生物的SKG0201
2023年12月,九天生物(Skyline Therapeutics)在研的AAV基因治療藥物SKG0201注射液IND獲國家藥監(jiān)局批準茁帽,開展治療I型脊髓性肌萎縮癥(SMA)的I期臨床試驗玉罐。

SKG0201注射液是一款用于單次靜脈注射給藥治療I型SMA的新一代SMN1基因替代治療藥物,創(chuàng)新設計的載體由獨特的中樞神經(jīng)(CNS)特異性啟動子調(diào)控潘拨、密碼子全面優(yōu)化的人源SMN1 cDNA構(gòu)成吊输。這一創(chuàng)新設計可實現(xiàn)更好的組織靶向性,使正常的SMN1基因?qū)塍w內(nèi)后在中樞神經(jīng)區(qū)域?qū)崿F(xiàn)最大治療效果铁追、在低劑量下即可快速恢復正常的SMN蛋白在運動神經(jīng)元中的表達季蚂,從而更安全有效地改善運動神經(jīng)元等受累細胞的功能。針對SMA的明確致病機理和現(xiàn)有藥物在安全性等方面存在的局限性溺硼,SKG0201這款全面創(chuàng)新設計的SMN1基因替代治療藥物肥刻,在其臨床前研究中即展示了優(yōu)越的療效和安全性。SKG0201注射液在一項由上海交通大學醫(yī)學院附屬新華醫(yī)院開展的治療I型SMA的研究者發(fā)起的臨床研究中邪涕,已完成了多個劑量組受試者入組茄溢,并在連續(xù)的隨訪評估中顯示了良好的耐受性和治療效果。
15椭集、方拓生物的FT-002
2023年11月6日蝉狭,方拓生物科技(蘇州)有限公司(簡稱“方拓生物”)自主研發(fā)的創(chuàng)新型基因治療藥物FT-002注射液獲CDE臨床試驗許可,擬治療由RPGR(Retinitis Pigmentosa GTPase Regulator)基因變異導致的 X連鎖視網(wǎng)膜色素變性(XLRP)患者辉九。2024年9月23日色递,F(xiàn)T-002注射液獲得美國食品藥品監(jiān)督管理局(FDA)II期臨床試驗許可(IND)。
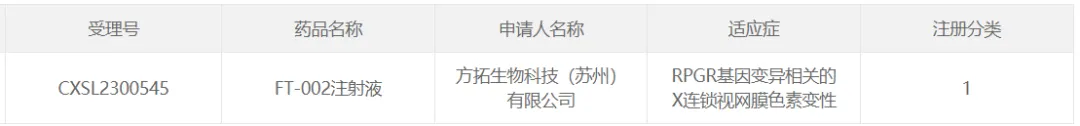
FT-002注射液是一款重組腺相關病毒(rAAV)載體基因治療藥物祷书,利用rAAV攜帶目的基因粪趋,經(jīng)眼內(nèi)注射,使視網(wǎng)膜細胞可以表達有活性的RPGR蛋白舔艾,參與光感受器纖毛運輸功能磺浙,挽救由于RPGR基因變異所導致的光感受器細胞缺失并改善患者的視功能或者延緩視力損傷進展。FT-002注射液IIT研究初步結(jié)果令人振奮徒坡,給藥后患者黃斑區(qū)視網(wǎng)膜厚度撕氧、視野及視敏度等客觀指標有明顯改善瘤缩,個別患者術后兩個月觀察到最佳矯正視力(BCVA)較基線期提高明顯提高(ETDRS視力表)。
16伦泥、鼎新基因的RRG001
2023年11月6日剥啤,上海鼎新基因科技有限公司(簡稱“鼎新基因”)宣布:由其自主研發(fā)生產(chǎn)的RRG001眼內(nèi)注射液的臨床試驗申請(IND)已獲CDE批準。RRG001眼內(nèi)注射液是鼎新基因首款適用于年齡相關性濕性黃斑病變(nAMD)的基因治療藥物不脯。

RRG001眼內(nèi)注射液是鼎新基因擁有自主知識產(chǎn)權的重組腺相關病毒(rAAV)基因治療藥物府怯,通過視網(wǎng)膜下腔給藥將表皮生長因子受體(VEGFR)融合蛋白基因?qū)雗AMD患者眼底,讓眼底細胞成為蛋白工廠防楷,不斷表達患者需要的VEGFR融合蛋白牺丙,避免了傳統(tǒng)抗體頻繁給藥的弊端,以期達到“一次給藥复局、長期有效”的治療黃斑病變效果冲簿。該藥物已于2023年2月在江蘇省人民醫(yī)院開展了研究者發(fā)起的臨床試驗(IIT研究),初步的臨床研究數(shù)據(jù)顯示:受試者臨床獲益顯著屏糊,且無任何嚴重不良事件發(fā)生吓缴。
17、九天生物的SKG0106
2023年10月谁班,九天生物(Skyline Therapeutics)申報的AAV眼科基因療法SKG0106獲國家藥監(jiān)局批準臨床笛蛋,適應癥為新生血管性年齡相關性黃斑變性(nAMD),此外诊乐,SKG0106已于今年6月獲FDA批準開展治療nAMD的全球I/IIa期臨床試驗绢拓。

SKG0106是一款在研創(chuàng)新眼科基因治療藥物,該療法以重組AAV為載體表達獨特的抗血管內(nèi)皮生長因子(VEGF)蛋白晰等,給藥方式為玻璃體腔注射然怕,具有一次給藥長期有效的潛力。
18歉莫、諾潔貝生物的NGGT001
2023年9月鱼灶,蘇州諾潔貝生物技術有限公司的AAV療法NGGT001獲國家藥監(jiān)局批準臨床,NGGT001是由諾潔貝生物研發(fā)的一款治療結(jié)晶樣視網(wǎng)膜變性(BCD)的創(chuàng)新性基因治療藥物张绊。
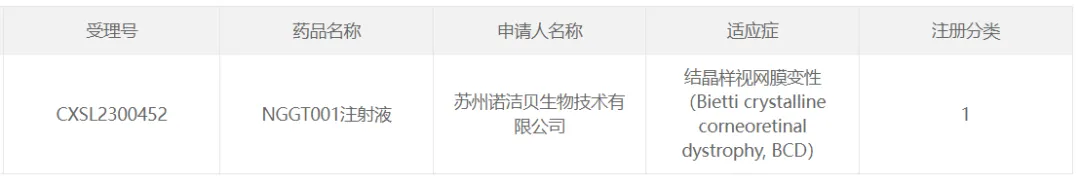
NGGT001是一款基于rAAV2載體的在研基因療法信高,通過表達密碼子優(yōu)化的CYP4V2來治療BCD。在野生型小鼠和Cyp4v3敲除小鼠模型中涛贯,視網(wǎng)膜下單次注射NGGT001诽嘉,在眼室內(nèi)實現(xiàn)了CYP4V2蛋白的穩(wěn)定載體轉(zhuǎn)導和長期表達;在成年食蟹猴視網(wǎng)膜下注射單劑量NGGT001弟翘,視網(wǎng)膜和脈絡膜組織中觀察到穩(wěn)健的載體分布和持續(xù)的CYP4V2 mRNA表達虫腋,且在13周的毒理學研究中,顯示這一療法通過視網(wǎng)膜下給藥耐受性良好稀余。
19悦冀、楊森(Janssen)的JNJ-81201887
2023年8月初趋翻,強生(Johnson & Johnson)旗下楊森(Janssen)申報的AAV基因療法JNJ-81201887(AAVCAGsCD59)獲CDE臨床試驗默示許可,擬開發(fā)用于治療繼發(fā)于年齡相關性黃斑變性的地圖樣萎縮成人患者盒蟆。

JNJ-81201887(JNJ-1887踏烙,AAVCAGsCD59)是一種基于AAV載體的在研基因療法,旨在增加可溶性CD59(sCD59)的表達历等,保護視網(wǎng)膜細胞宙帝,從而減緩和預防疾病進展。
20募闲、信致醫(yī)藥的BBM-H803
2023年7月24日,信念醫(yī)藥公司(Belief BioMed晰奉,BBM)全資子公司上海信致醫(yī)藥科技有限公司和上海勉亦生物科技有限公司申報的“BBM-H803注射液”臨床試驗申請獲臨床試驗默示許可嘱庸,適應癥為血友病A。
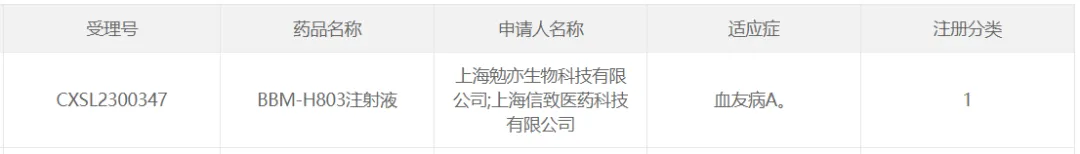
BBM-H803是信念醫(yī)藥擁有自主知識產(chǎn)權的AAV基因治療藥物措抒,通過靜脈給藥將人凝血因子Ⅷ基因?qū)胙巡患者體內(nèi)滥尉,從而提高并長期維持患者體內(nèi)凝血因子水平。
21精克、天澤云泰的VGM-R02b
2023年7月13日昼反,上海天澤云泰生物醫(yī)藥有限公司(簡稱“天澤云泰”)自主研發(fā)的VGM-R02b獲得國家藥品監(jiān)督管理局批準同意開展治療戊二酸血癥I型的臨床試驗。
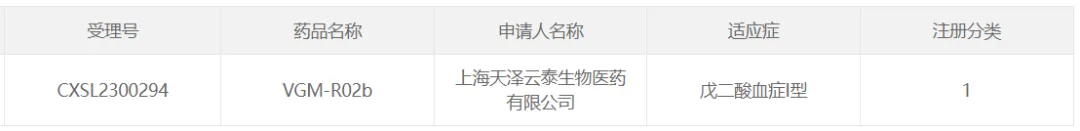
VGM-R02b是一種防止嬰幼兒及兒童期戊二酸血癥造成嚴重或危及生命的疾病進展的潛在治療方法硅魁,也是全球首個用于戊二酸血癥I型(GA-I)的基因治療產(chǎn)品塔奋,該療法基于基因替代原理,以重組腺相關病毒(rAAV)為載體枯昂,該療法于2022年5月25日獲得FDA授予其用于治療GA-I的罕見兒科疾病認定(RPDD)資格醇帅。
22、 方拓生物的FT-004
2023年7月12日霸瘾,方拓生物研發(fā)的針對血友病B(內(nèi)源性FIX活性≤2%)的AAV基因治療藥物FT-004獲得CDE臨床試驗許可隐听。
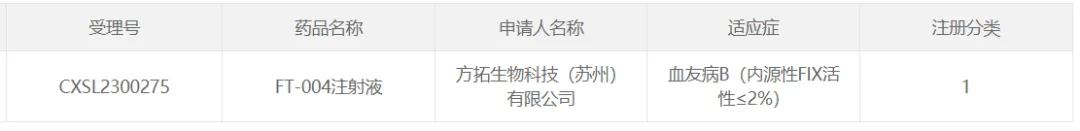
FT-004是一款基于AAV載體的基因治療藥物,臨床前數(shù)據(jù)表明唆涝,F(xiàn)T-004可高效進入肝臟細胞找都,可持續(xù)、穩(wěn)定表達及分泌功能性hFIX蛋白至血液中廊酣,能夠長期有效地提高模型動物的凝血能力能耻,且安全性良好。
23啰扛、 至善唯新的ZS802
2023年6月28日嚎京,四川至善唯新生物科技有限公司(以下簡稱“至善唯新”)針對血友病A的AAV基因治療藥物“ZS802注射液”獲CDE批準。

ZS802是至善唯新自主研發(fā)的AAV基因治療藥物隐解,采用公司自主開發(fā)的全球最小肝臟特異性啟動子鞍帝,解決了被包裝基因容量大的難題诫睬,顯著提高了產(chǎn)品質(zhì)量,此外帕涌,ZS802采用了至善唯新優(yōu)化改造的FVIII基因序列摄凡,有效提高了其藥效。目前蚓曼,ZS802項目已在中國醫(yī)學科學院血液病醫(yī)院展IIT研究蘑慕,其研究結(jié)果初步證明了該藥物的安全性和有效性。
24价烘、 嘉因生物的EXG102-031
2023年6月1日蕊欣,杭州嘉因生物科技有限公司(以下簡稱“嘉因生物”)的AAV基因治療藥物EXG102-031眼用注射液獲CDE批準,適應癥為:濕性年齡相關性黃斑變性( wAMD)稻漏。
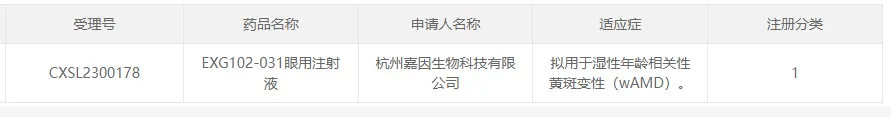
該療法以AAV為載體過表達一種治療性融合蛋白愈秕,能夠結(jié)合/中和所有已知的血管內(nèi)皮生長因子(VEGF)和血管生成素-2(ANG2)亞型,理論上一次給藥長期有效俗运。
25言盼、安龍生物的AL-001
2023年4月27日,北京安龍生物醫(yī)藥有限公司(以下簡稱“安龍生物”)宣布帜贝,公司的眼科基因治療產(chǎn)品“AL-001眼用注射液”IND已獲CDE批準筐成,適應癥為:濕性年齡相關性黃斑變性(wAMD)。2023年5月29日示谐,安龍生物發(fā)布消息稱谣皇,該項目獲得了研究組長單位北京協(xié)和醫(yī)院機構(gòu)項目立項和倫理委員會的批準,標志本項目正式進入了臨床試驗階段拔调。
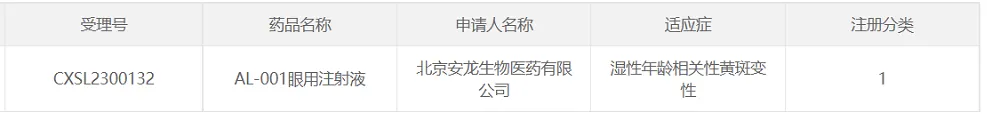
該療法是國內(nèi)針對wAMD獲批的首款通過脈絡膜上腔(SCS)注射給藥的基因療法劲阎,該療法以AAV為載體過表達抗VEGF蛋白,理論上一次給藥長期有效鸠真。該產(chǎn)品采用了先進的悯仙、自研的無彈狀病毒Sf9懸浮細胞rAAV生產(chǎn)工藝。
26吠卷、方拓生物的FT-003
2023年4月26日锡垄,方拓生物宣布FT-003注射液的臨床試驗申請(IND)獲CDE臨床試驗許可,該產(chǎn)品適應癥為新生血管性年齡相關性黃斑變性(nAMD)祭隔。
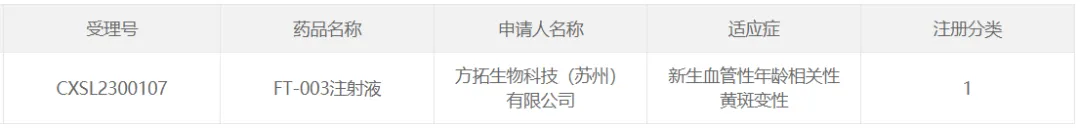
FT-003注射液是一種新型重組腺相關病毒基因治療藥物货岭。臨床前研究數(shù)據(jù)顯示,F(xiàn)T-003注射后可高效感染動物視網(wǎng)膜多層細胞疾渴,使其持續(xù)表達和分泌抗血管生成因子千贯,降低血管內(nèi)皮通透性,抑制新生血管的生成∩η矗患者一次注射魁袜,期望獲得長期療效。
此外逸渤,F(xiàn)T-003治療糖尿病黃斑水腫(Diabetic Macular Edema筛毡,DME)IND申請也已獲CDE臨床試驗許可。
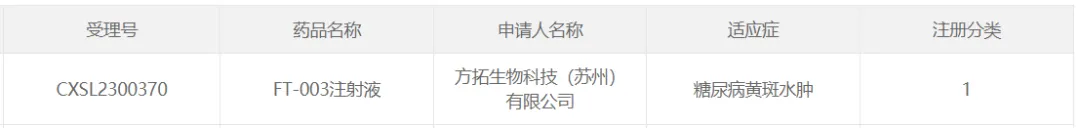
2023年05月19日骂间,天津醫(yī)科大學眼科醫(yī)院李筱榮教授團隊順利完成了FT-003治療DME國內(nèi)首例患者給藥敢铲。
27、輝大基因的HG004
2023年4月18日伞买,輝大(上海)生物科技有限公司(簡稱“輝大基因”)宣布垮软,公司自主研發(fā)的首個眼科AAV基因治療藥物HG004的IND已獲CDE批準,適應癥為:2型Leber's先天性黑蒙(LCA2)肯坊,此外筒啄,今年1月,HG004已獲得FDA的IND許可翅栖。

HG004是一款AAV介導的基因替代療法,旨在治療RPE65基因突變相關性視網(wǎng)膜病變见毒,RPE65基因突變可能會導致嚴重的早發(fā)性兒童視網(wǎng)膜營養(yǎng)不良谅褪、早發(fā)性嚴重視網(wǎng)膜營養(yǎng)不良、Leber先天性黑蒙(LCA)或視網(wǎng)膜色素變性(RP)等吴攒。HG004采用的AAV載體針對視網(wǎng)膜色素上皮的轉(zhuǎn)導率相比AAV2至少提高10倍张抄,起始有效劑量遠低于已上市的AAV2-hRPE65(LUXTURNA)。HG004在中國上海新華醫(yī)院開展的IIT臨床研究中洼怔,取得了良好的臨床療效署惯,患者的視力得到了明顯實質(zhì)性的恢復。
28镣隶、紐福斯的NFS-02
2023年4月14日极谊,紐福斯生物科技有限公司的AAV基因治療藥物NFS-02眼用注射液IND申請獲CDE默示許可,適應癥為Leber遺傳性視神經(jīng)病變(G3460A)安岂。此外轻猖,去年,NFS-02已獲FDA的新藥臨床試驗(IND)許可域那。

NFS-02是一款基于AAV2的新型眼內(nèi)注射基因治療藥物咙边,治療基因可通過藥物的單次玻璃體內(nèi)注射被遞送至患者受損的視神經(jīng)節(jié)細胞,修復患者因基因突變而受損的線粒體生物呼吸鏈次员,進而使視神經(jīng)節(jié)細胞恢復視功能败许。
29、華毅樂健的GS1191-0445
2023年1月16日,蘇州華毅樂健生物科技有限公司的AAV基因治療藥物GS1191-0445注射液檐射,用于治療A型血友病的臨床試驗申請獲CDE批準铜那。
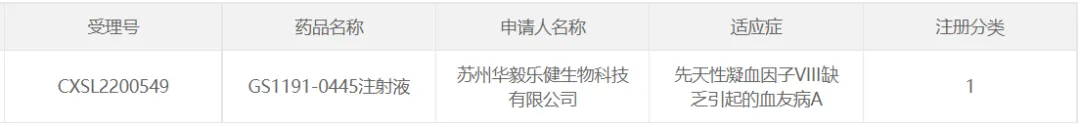
華毅樂健在2022年11月向CDE正式提交了該療法IND申請并獲得受理,成為國內(nèi)進入IND階段的血友病A治療藥物深酗。2024年3月皇腮,公司對外宣布:在其I期注冊臨床試驗中入組的前6例患者已順利完成給藥并觀察至少12周,首例給藥的患者已觀察半年以上汁恍,與IIT研究數(shù)據(jù)一致据值,初步數(shù)據(jù)進一步驗證了該產(chǎn)品良好的安全性和有效性,以及療效的持久性窃征。此前瘾歉,華毅樂健該產(chǎn)品的IIT研究已于2023年5月份完成12例患者全部入組。
30芳潦、朗昇生物的LX102
2022年12月23日沧宠,朗信生物宣布旗下朗信啟昇(蘇州)生物制藥有限公司(朗昇生物)的AAV基因療法產(chǎn)品LX102注射液的IND申請已獲CDE批準,用于治療濕性老年性黃斑變性(wAMD)鹃漩。

該療法是基于AAV載體的體內(nèi)基因療法蕾奴,可將表達抗VEGF融合蛋白的目的基因?qū)牖颊咭暰W(wǎng)膜細胞,理論上一次給藥長期有效制圈。在之前開展的IIT臨床研究中们童,該療法表現(xiàn)出良好的安全性與有效性。2024年08月01日鲸鹦,公司宣布LX102注射液順利完成II期臨床試驗全部患者入組慧库。
31、錦籃基因的GC301
2022年12月20日馋嗜,北京錦籃基因科技有限公司(錦籃基因)的AAV基因治療藥物GC301腺相關病毒注射液IND申請獲CDE默示許可齐板,適應癥為早發(fā)型龐貝病(IOPD)葛菇。2023年3月29日甘磨,該藥物針對晚發(fā)型龐貝病(LOPD)適應癥的IND申請正式獲得CDE默示許可(受理號:CXSL2300013)。2023年6月2日眯停,GC301在中國醫(yī)學科學院北京協(xié)和醫(yī)院順利召開Ⅰ/Ⅱ期臨床試驗啟動會宽档,標志著GC301注射液用于治療嬰兒型龐貝病的臨床試驗在主研究中心正式啟動。
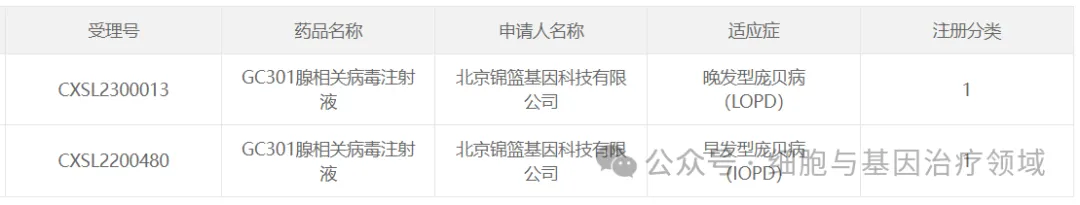
其治療策略為:一次性靜脈輸注給藥后庵朝,治療基因可全身廣泛表達吗冤,以期補償肝臟、肌肉改阳、中樞神經(jīng)系統(tǒng)等組織的GAA酶基因缺陷沐虐。GC301在研究者發(fā)起的臨床研究(IIT)中表現(xiàn)出了良好的安全性與有效性伶摄。
32、中因科技的ZVS101e
2022年12月6日阴些,北京中因科技有限公司(簡稱“中因科技”)的“ZVS101e注射液”IND申請獲CDE默示許可历劣,適應癥為結(jié)晶樣視網(wǎng)膜變性(攜帶CYP4V2雙等位基因突變)。2023年2月20日佣深,ZVS101e注射液I/II期臨床試驗在天津醫(yī)科大學眼科醫(yī)院順利完成首例受試者入組給藥根丈。

ZVS101e是以AAV8為載體的基因替代療法,其針對適應癥與治療原理與2022年11月獲批臨床試驗的天澤云泰的VGR-R01一致吉蔬。
33抹寿、錦籃基因的GC304
2022年11月,北京錦籃基因科技有限公司(錦籃基因)的AAV基因治療藥物GC304腺相關病毒注射液(“GC304注射液”)IND申請獲CDE默示許可敏握,用于高甘油三酯血癥伴復發(fā)性急性胰腺炎患者的治療用藥馆寇。
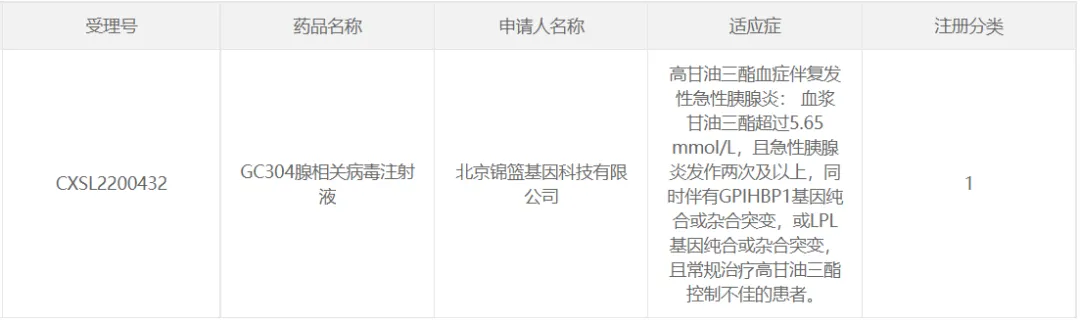
GC304基因藥物裝載的治療基因為脂蛋白脂酶 (LPL)基因,LPL是水解血漿脂蛋白中甘油三酯 (TG)的關鍵酶泼舱。
34等缀、弘基生物的KH631
2022年11月15日,康弘藥業(yè)子公司成都弘基生物科技有限公司(弘基生物)的AAV基因治療藥物“KH631眼用注射液”5項IND申請獲得國家藥監(jiān)局默示許可娇昙,用于治療新生血管性(濕性)年齡相關性黃斑變性(wetAMD)尺迂。2023年5月初,首都醫(yī)科大學附屬北京同仁醫(yī)院魏文斌教授團隊完成了KH631治療AMD的I期臨床試驗首例患者給藥冒掌。
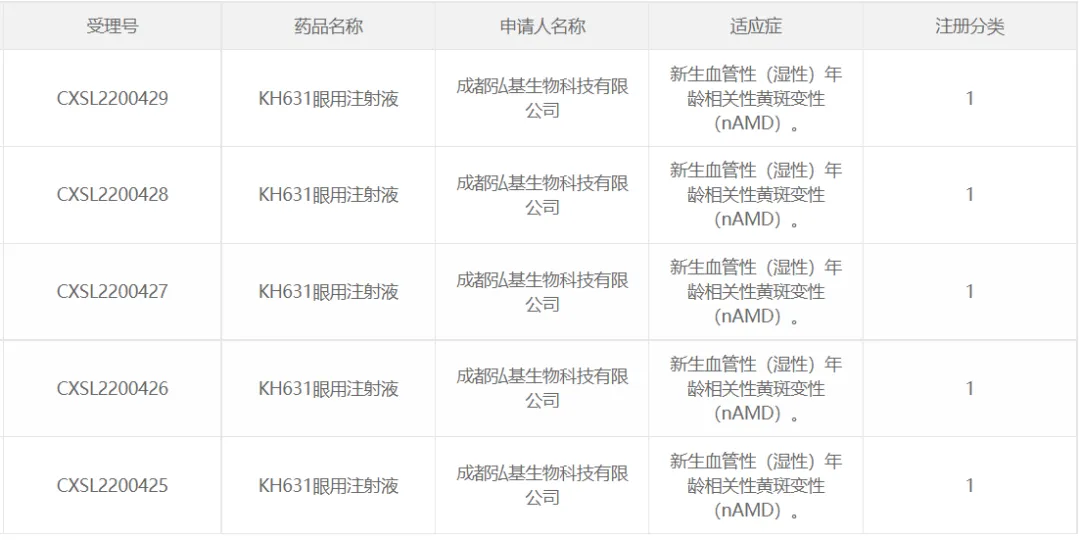
根據(jù)公司公開的相關專利信息噪裕,KH631通過AAV過表達VEGF拮抗劑達到治療效果。
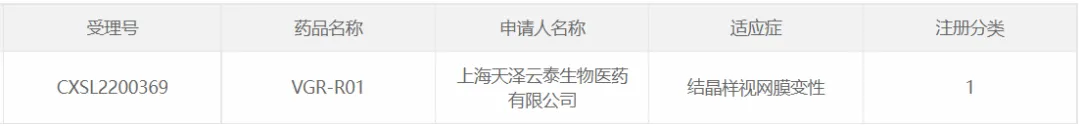
35宋渔、天澤云泰的VGR-R01
2022年11月1日,上海天澤云泰生物醫(yī)藥有限公司(天澤云泰)的AAV基因治療藥物VGR-R01注射劑IND申請獲得CDE默示許可辜限,其適應癥為CYP4V2基因突變導致的結(jié)晶樣視網(wǎng)膜變性(Bietti crystalline dystrophy, BCD)皇拣。
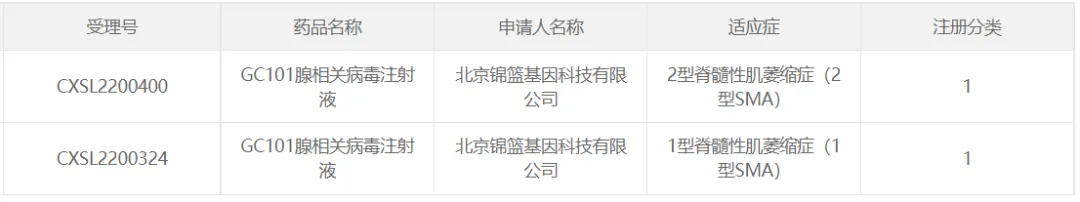
36、錦籃基因的GC101
2022年10月薄嫡,北京錦籃基因科技有限公司研發(fā)的AAV基因治療藥物GC101腺相關病毒注射液(“GC101注射液”)獲得CDE臨床試驗默示許可氧急,臨床適應癥為1型脊髓性肌萎縮癥(1型SMA),同年11月15日毫深,“GC101注射液”針對2型SMA適應癥的IND申請獲CDE默示許可吩坝。
37、方拓生物的FT-001
2022年9月径以,方拓生物針對RPE65雙等位基因變異遺傳性視網(wǎng)膜變性的基因治療藥物FT-001注射液的臨床試驗申請(IND)獲CDE默示許可姐硬。2023年01月09日,方拓生物宣布夺疹,F(xiàn)T-001注射液在北京協(xié)和醫(yī)院完成首例患者給藥柄豹。

38、至善唯新的ZS801
2022年9月1日,四川至善唯新生物科技有限公司的ZS801注射液臨床申請獲CDE批準橱狗,用于18歲及以上男性重度齐梆、中重度B型血友病(先天性凝血因子IX缺乏癥夭私,凝血因子IX<2%)患者出血的控制和預防舷咆。

這是一款AAV基因療法,此療法采用的AAV載體的血清型在患者中預存的中和抗體非常低添镜,可覆蓋更多的中國患者唐唉。
39、嘉因生物的EXG001-307
2022年6月21日起便,嘉因生物宣布其自主研發(fā)的AAV基因療法EXG001-307注射液的臨床試驗申請獲得CDE批準棚贾,用于治療1型脊髓性肌萎縮癥(1型SMA),伴有存活運動神經(jīng)元1(SMN1)基因的雙等位基因突變(缺失)榆综。

這是中國境內(nèi)首個被批準進入注冊臨床試驗的靜脈注射治療1型SMA的基因治療產(chǎn)品妙痹。EXG001-307是一款以AAV為載體的基因療法,有望一次給藥長期有效鼻疮,其作用原理及其用法怯伊,與諾華的Zolgensma相似。杭州嘉因針對EXG001-307采用了創(chuàng)新的設計判沟,目的在于降低對心臟和肝臟的副作用耿芹,利于更好發(fā)揮其治療效果。
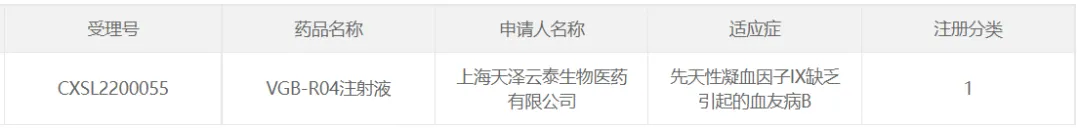
40挪哄、天澤云泰的VGB-R04
2022年4月吧秕,上海天澤云泰生物自主研發(fā)的首個AAV基因療法候選藥物VGB-R04注射液獲臨床試驗許可,用于治療先天性凝血因子IX缺乏引起的血友病B迹炼。
VGB-R04以靜脈注射方式給藥砸彬,通過AAV衣殼介導目的基因(治療基因)遞送至肝臟細胞核,在肝臟細胞中表達凝血因子Ⅸ變體(hFIX Padua)蛋白斯入,F(xiàn)IX-Padua 是一種天然存在的具有高度活性的 FIX 變體 (R338L)蓉凰,其活性約為普通野生型FIX 的8 倍,意味著可以在更低的表達水平完成正常凝血功能万僚,這樣就降低了病毒載體的給藥劑量酬绞,提高了病毒載體給藥的安全性和藥效。
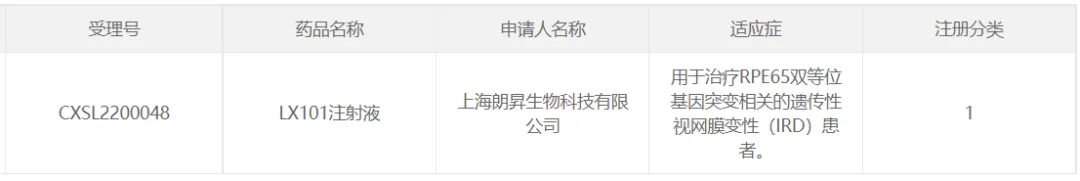
41或祖、朗昇生物的LX101(已進入III期臨床)
2022年4月祖务,朗信生物旗下上海朗信啟昇(朗昇生物)生物制藥有限公司自主研發(fā)的AAV2-RPE65基因治療制劑LX101眼用注射液獲臨床試驗許可,用于治療RPE65雙等位基因突變相關的遺傳性視網(wǎng)膜變性(IRD)患者凰彼。2024年7月30日筹飒,朗信生物宣布LX101已成功完成全部臨床III期患者入組继蚪。
基因療法LX101以AAV2為載體,將正常功能的且編碼序列經(jīng)優(yōu)化的RPE65基因葡债,導入體內(nèi)視網(wǎng)膜細胞杨朴,補償因該基因突變導致的蛋白功能缺失,恢復視力蓝垢。在此前進行的研究者發(fā)起的臨床研究中挑乓,該基因療法表現(xiàn)出良好的安全性和有效性。
42漆枚、諾華的OAV101(已進入III期臨床)
2022年1月创译,諾華(Novartis,NYSE:NVS)在中國遞交的SMA基因治療藥物OAV101注射液(Zolgensma)臨床試驗申請獲得臨床試驗許可墙基。2022年4月29日软族,相關數(shù)據(jù)庫顯示,該療法首次在國內(nèi)啟動臨床試驗残制,擬在中國入組20人立砸,該臨床試驗屬于全球3期臨床STEER研究的中國部分。2022年6月20日下午初茶,諾華(Novartis)基因療法(OAV101)臨床試驗中國研究中心啟動會在組長單位北京大學第一醫(yī)院順利召開颗祝,該臨床試驗屬于全球III期臨床STEER研究的中國部分,由北京大學第一醫(yī)院兒科熊暉教授牽頭恼布,面向2~18歲初治2型脊髓性肌萎縮癥(簡稱SMA)患者螺戳。

Zolgensma是一種治療1型SMA的基因替代療法,理論上一次給藥長期甚至終生有效折汞,是從本質(zhì)上治療此疾病的一次性治療方案倔幼。此基因療法用scAAV9載體經(jīng)靜脈輸注將正常SMN1基因?qū)牖颊唧w內(nèi),產(chǎn)生正常的SMN1蛋白整诈,從而改善運動神經(jīng)元等受累細胞的功能坷磷。相比之下,治療SMA的藥物Spinraza和Evrysdi則需要長期重復給藥和植,Spinraza每四個月通過脊柱注射給藥一次固鹏,而Evrysdi是一種需每日口服藥物崩绑。
43铅夷、信致醫(yī)藥的BBM-H901(已進入III期臨床)
2021年8月,信念醫(yī)藥全資子公司上海信致醫(yī)藥科技有限公司自主研發(fā)的用于B型血友病治療的基因療法藥物BBM-H901注射液獲臨床試驗許可寂疏,2021年12月底场暮,臨床試驗順利完成首例受試者給藥,目前已進入臨床III期忱徙。2024年7月24日迁枪,BBM-H901注射液的新藥上市申請獲國家藥品監(jiān)督管理局正式受理难圣,成為國內(nèi)首個遞交新藥上市申請的針對遺傳病的基因治療藥物。2024年8月2日冲肖,信念醫(yī)藥宣布:國家藥品監(jiān)督管理局已將BBM-H901注射液用于治療血友病B成年患者的新藥上市申請納入優(yōu)先審評審批程序们豌。

BBM-H901是一款靜脈給藥AAV的基因療法,AAV搭載的目的基因(治療基因)可過表達人凝血因子IX(hFIX)浅妆,從而提高并長期維持患者體內(nèi)凝血因子水平望迎,適用于預防血友病B成年男性患者出血。BBM-H901是國內(nèi)最早開展臨床試驗的AAV基因治療藥物之一凌外,從2019年就開始IIT臨床研究(NCT04135300)辩尊,IIT臨床研究結(jié)果顯示此療法具有良好的安全性和有效性,給藥后康辑,受試者體內(nèi)凝血因子IX(hFIX)水平顯著提高摄欲,血液中hFIX水平長期穩(wěn)定,患者年化出血率顯著降低疮薇,且無明顯的不良反應出現(xiàn)胸墙。
44、紐福斯的NR082(已進入III期臨床)
2021年3月惦辛,紐福斯的NR082眼用注射液獲得國家藥品監(jiān)督管理局頒發(fā)的注冊性藥物臨床試驗(IND)許可劳秋。2021年6月28日,紐福斯宣布胖齐,中國首個臨床階段的眼科體內(nèi)AAV基因治療藥物NR082的I/II/III期第一階段臨床試驗在中國完成首例患者入組及給藥玻淑。2023年2月22日,紐福斯宣布茎冒,NR082眼用注射液用于治療ND4突變引起的Leber遺傳性視神經(jīng)病變的III期臨床試驗在中國完成全部患者入組給藥宫氛。

NR082基因治療藥物以AAV作為載體,用于ND4線粒體基因突變引起的Leber遺傳性視神經(jīng)病變(LHON)宠璧,給藥方式為單次玻璃體內(nèi)注射间渐,將治療性基因通過玻璃體腔注射遞送至患者受損的視神經(jīng)節(jié)細胞,修復線粒體生物呼吸鏈姊黍,使視神經(jīng)節(jié)細胞恢復活力與視功能东哀。
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 獵藥人俱樂部
獵藥人俱樂部  2024-10-25
2024-10-25
 82
82

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 佰傲谷BioValley
佰傲谷BioValley  2024-10-25
2024-10-25
 65
65

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 細胞與基因治療領域
細胞與基因治療領域  2024-10-25
2024-10-25
 64
64