
 研發(fā)追蹤
研發(fā)追蹤
 2016-08-26
2016-08-26
 4353
4353
來源:藥明康德??? 2016-08-25
Clovis Oncology公司近日宣布履字,美國FDA已接受其臨床新藥rucaparib的加速審批新藥申請鸦呆,并賦予其優(yōu)先審評資格,適應人群為腫瘤帶有BRAC基因缺失突變、已接受至少兩種化療的晚期卵巢癌患者锦亦。FDA將在明年二月給出審評決定。
“復發(fā)性卵巢癌是一類十分難治的疾病,包括攜帶BRAC基因突變的女性患者。盡管針對這類患者目前已經有了治療方案模蜡,但真正有效的療法仍然有限。因此扁凛,如今我們有機會能用rucaparib治療先前接受過兩種鉑基化療忍疾、帶有胚系或體細胞BRAC基因突變的女性卵巢癌患者,真可以說是一個很大的進展谨朝,”rucaparib臨床試驗的領導者卤妒、德州大學MD安德森癌癥中心的Robert Coleman教授說道。
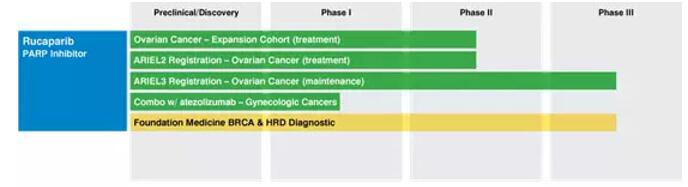
▲Rucaparib臨床開發(fā)進展(圖片來源:Clovis Oncology官網)
Rucaparib是一種口服小分子藥物叠必,是PARP1荚孵、PARP2和PARP3這三種酶的抑制劑妹窖。目前纬朝,該臨床新藥處于2期臨床,并已于去年四月被美國FDA賦予突破性療法資格認定骄呼。同時共苛,該藥還正在被開發(fā)用于治療帶有BRAC突變或其他DNA同源重組缺陷的實體瘤,包括前列腺癌蜓萄、乳腺癌和消化道癌癥等氢莫。
▲Rucaparib結構(圖片來源:維基百科)
同時,藥明康德合作伙伴Foundation Medicine公司秤慌,已于今年六月向FDA提交了配合rucaparib使用的伴隨診斷法FoundationFocus CDxBRAC的上市申請邦擎。該伴隨診斷可檢測患者腫瘤是否帶有BRAC基因突變。
“FDA接受新藥申請對rucaparib和Clovis公司來說是一個重要的里程碑式涝,”Clovis的總裁兼首席執(zhí)行官Patrick Mahaffy先生說道:“攜帶BRAC突變的晚期卵巢癌患者亟需更多的治療手段僧逞。我們期待著與FDA在rucaparib審評工作上的合作。”
參考資料
[1] FDA Accepts Clovis Oncology's New Drug Application for Rucaparib for Priority Review for the Treatment of Advanced Mutant BRCA Ovarian Cancer
[2] ?Clovis Oncology公司官網
(原標題:FDA授予卵巢癌臨床新藥優(yōu)先審評資格)

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 113
113

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 114
114

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 113
113