
 研發(fā)追蹤
研發(fā)追蹤
 2016-08-02
2016-08-02
 4433
4433
來源:藥明康德??? 2016-08-02
今日嫩玻,脊髓性肌萎縮(SMA)治療領(lǐng)域傳來重磅喜訊:藥明康德的兩位合作伙伴百椒猩帧(Biogen)與Ionis Pharmaceuticals今日宣布虚茶,其創(chuàng)新基因療法nusinersen在3期臨床試驗的中期分析中呈現(xiàn)顯著療效虏向,達到了主要臨床終點蓖救。由于目前尚未有治療SMA的藥物獲批上市,百健與Ionis的療法有望成為該疾病治療的里程碑句惯。

SMA是一種遺傳疾病拍嵌,患者體內(nèi)的SMN1基因往往出現(xiàn)突變,導(dǎo)致關(guān)鍵蛋白SMN合成不足潜索,而這會影響運動神經(jīng)元的活性臭增。這種疾病一般發(fā)生在嬰幼兒期。隨著病情的不斷發(fā)展竹习,患者脊髓與低位腦干中的運動神經(jīng)元會缺失誊抛,導(dǎo)致嚴重的肌肉萎縮。最終整陌,患者會出現(xiàn)癱瘓拗窃,甚至無法執(zhí)行像坐立、呼吸泌辫、吞咽等基本的生理功能随夸。對于這些患者及其家人而言,他們急需一種有效的治療手段震放。
由百健與Ionis研發(fā)的創(chuàng)新基因療法nusinersen有望為患者們帶來治療的希望宾毒。Nusinersen是一種反義寡核苷酸,能夠改變SMN2基因的RNA剪切殿遂。由于SMN2與SMN1基因在序列上幾乎如出一轍卸橘,nusinersen的剪切能夠調(diào)控基因的表達量,增加關(guān)鍵蛋白SMN的產(chǎn)量盔锦。鑒于該療法的潛力恤兴,美國FDA曾向它頒布了孤兒藥資格與快速通道認證。
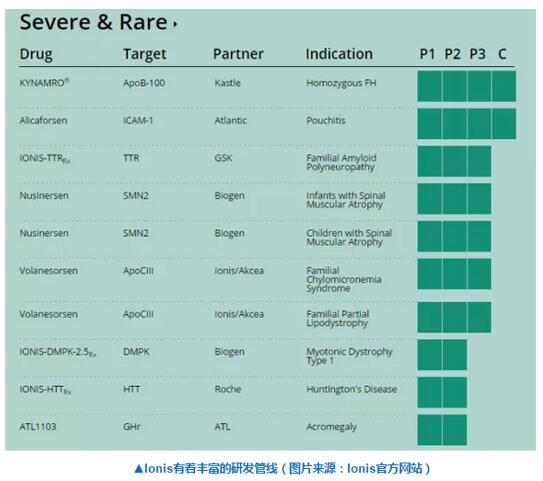
在3期臨床試驗中滑期,nusinersen取得了良好的療效闽但。根據(jù)患者的年齡,研究人員進行了兩項獨立的3期臨床账阳。其中阁喉,ENDEAR招募了122名出生不到6個月,就出現(xiàn)SMA癥狀,且在出生7個月前得到診斷的患者噪设;CHERISH則招募了126名在6個月之后出現(xiàn)癥狀碗挟,且在2-12歲間經(jīng)診斷的患者。在3期臨床的中期分析中乔墙,研究人員發(fā)現(xiàn)在經(jīng)過nusinersen的治療后竞谒,參加ENDEAR試驗的患者運動神經(jīng)元狀況有了非常顯著的改善。正因為它的積極結(jié)果腔召,本試驗已提前終止杆查,對照組的患者也開始采用nusinersen進行治療。
“今天對SMA患者群體而言意義重大臀蛛,”“治愈SMA組織”的主席Kenneth Hobby先生說:“能夠抵達這一里程碑亲桦,我們感到非常振奮。這些結(jié)果有潛力帶來首個SMA的療法浊仆。我們將繼續(xù)支持SMA的研究客峭,直到我們能治愈它。”

“如果獲得批準的話抡柿,nusinersen有望為患者和他們的家庭帶來改變舔琅。我們期待與百健一道完成臨床項目,并期待能得到積極的評審結(jié)果洲劣,”Ionis的首席執(zhí)行官Lynne Parshall博士說:“Nusinersen是我們神經(jīng)疾病藥物庫中首個進入評審階段的反義藥物备蚓,它展現(xiàn)了反義技術(shù)在治療頑疾上的潛力。”
本項3期臨床試驗的另一半——CHERISH在今年5月剛招募完志愿者闪檬,試驗結(jié)果將在幾個月后放出星著。我們祝愿這項試驗同樣能取得令人滿意的結(jié)果,nusinersen也能早日上市坐署,造噶蓟患者。
參考資料:
[1] Biogen (BIIB) Pays Ionis Pharma (IONS) $75 Million for Successful Late-Stage Nusinersen Data
[2] Biogen pays $75M to Ionis on early PhIII antisense results
[3] Ionis官方網(wǎng)站
?

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 117
117

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 118
118

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 117
117