
 研發(fā)追蹤
研發(fā)追蹤
 2016-07-27
2016-07-27
 4563
4563
來源:藥明康德??? 2016-7-27
今天钢老,楊森公司(Janssen Pharmaceutical Companies of Johnson & Johnson)宣布美國FDA授予了其免疫單抗藥物達雷木單抗(daratumumab)突破性療法認定末尤,與免疫調(diào)節(jié)劑來那度胺(lenalidomide)加上地塞米松(dexamethasone)终惑,或者蛋白酶體抑制劑硼替佐米(bortezomib)加上地塞米松盹挑,聯(lián)合用于治療既往已接受至少一次治療的多發(fā)性骨髓瘤患者炒俱。這標志著daratumumab第二次獲得了突破性療法認定,它曾在 2013 年 5 月被FDA授予突破性療法認定埋哟,用于治療之前已接受至少三種療法(包括蛋白酶體抑制劑和免疫調(diào)節(jié)劑藥物等)的多發(fā)性骨髓瘤患者钠导。
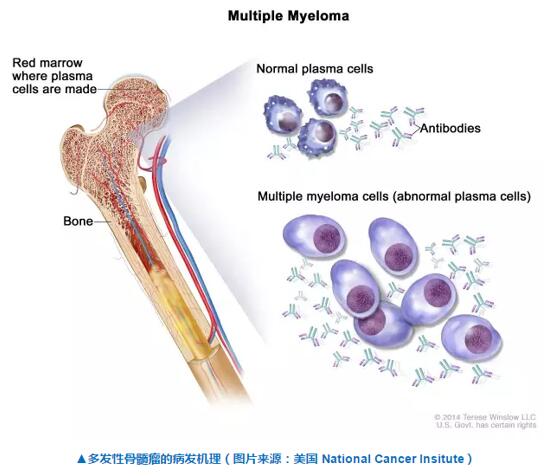
多發(fā)性骨髓瘤是一種目前還不可治愈的血癌,其病因發(fā)源于骨髓開始徽诲,表現(xiàn)為漿細胞的過量增殖以及對骨骼的侵蝕刹帕。在中國,多發(fā)性骨髓瘤的發(fā)病率在十萬分之一到十萬分之二之間馏段,多為60歲以上的老年人轩拨,為發(fā)病率第二的血液癌癥。在美國亭颈,多發(fā)性骨髓瘤也是第三大常見的血液癌癥婚廷,僅次于白血病和淋巴瘤。據(jù)估計悠蹬,在全球范圍內(nèi)藏苫,每年有12萬多新增病例,并有近9萬人死于該疾病跛拌。大多數(shù)患者經(jīng)診斷時信炬,往往有貧血、骨痛却痴、腎功能不全移蔼、感染、高鈣血癥等嚴重癥狀漩判。
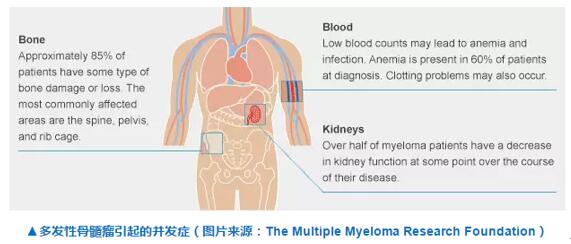
對于接受了標準療法(如蛋白酶體抑制劑和免疫調(diào)節(jié)劑等)后的難治性患者來說备饭,一旦癌癥復(fù)發(fā),往往預(yù)后較差摘沥。因為缺乏有效的治療手段幼健,其平均總生存期大約為 9 個月兄存。
Daratumumab是目前為數(shù)不多的多發(fā)性骨髓瘤治療藥物,其已于去年11月被美國FDA加速批準卑雁,它同時也是首個被美國FDA批準的多發(fā)性骨髓瘤單抗藥物募书,其活性成分是一種人源化的抗CD38 IgG1k單克隆抗體。CD38高表達于多發(fā)性骨髓瘤細胞的表面测蹲,?daratumumab可靶向結(jié)合CD38分子莹捡,激發(fā)起一系列免疫反應(yīng)以攻擊癌細胞,通過多種免疫介導(dǎo)及其它作用機制導(dǎo)致誘導(dǎo)癌細胞的凋亡弛房。
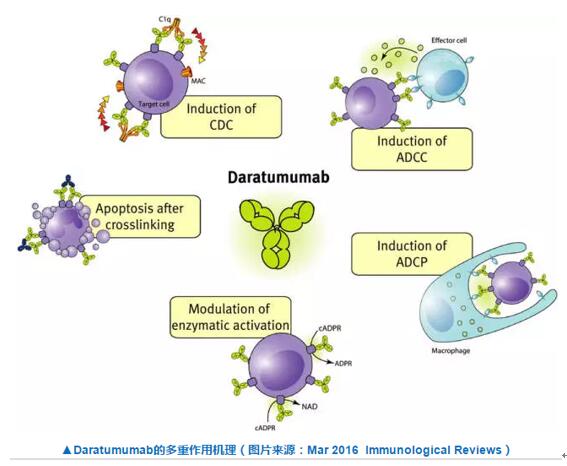
除了多發(fā)性骨髓瘤道盏,daratumumab也有潛力治療高表達CD38分子的其他類型腫瘤,包括:彌漫性大B細胞淋巴癌文捶、慢性淋巴細胞白血病荷逞、急性淋巴細胞白血病、漿細胞性白血病粹排、急性髓性白血病种远、濾泡性淋巴瘤和套細胞淋巴瘤。
FDA授予daratumumab新的突破性療法認定是基于兩個3期研究數(shù)據(jù):在MMY3004(CASTOR)和MMY3003(POLLUX)臨床試驗中顽耳,與硼替佐米+地塞米松或來那度胺+地塞米松治療相比坠敷,包含了daratumumab的組合治療能減少患者疾病進展或死亡的風(fēng)險。
楊森研發(fā)部門的副總裁Craig L. Tendler博士說道: “我們很高興的是今捕,FDA已授予daratumumab第二個突破性療法認定数屁,這是對daratumumab作為治療多發(fā)性骨髓瘤方案里面擔(dān)當骨干成分的重要認可。我們期待在整個審查過程中與FDA密切合作希咒,繼續(xù)致力于探索這一充滿希望的化合物的完整臨床益處透格,造福熱切等待中的多發(fā)性骨髓瘤患者。”
參考資料:
[1] Genmab A/S (GEN.CO), Johnson & Johnson (JNJ)'s Daratumumab Granted Breakthrough Tag by the FDA
[2] Daratumumab (DARZALEX?) Granted Breakthrough Therapy Designation by U.S. Food and Drug Administration (FDA) for Use in Combination with Standard of Care Regimens for Patients with Multiple Myeloma
[3] American Cancer Society. 'Multiple Myeloma Overview.'
[4] GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide: Number of New Cancers in 2015.
[5] Janssen 官方網(wǎng)站

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 120
120

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 121
121

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 120
120