
 研發(fā)追蹤
研發(fā)追蹤
 2016-03-02
2016-03-02
 4272
4272
來源:醫(yī)藥魔方數(shù)據(jù)??? 2016-3-2
一個在研新藥往往要通過歷時數(shù)年的臨床研究才能證明其對患者的確切獲益。FDA在1992年引入了加速批準(zhǔn)(Accelerated Approval)通道橙樟,對于一些針對醫(yī)療需求未得到滿足的嚴(yán)重疾病開發(fā)的藥物狼速,可基于替代終點(diǎn)批準(zhǔn)其上市缤贯。
比如一些抗癌藥要達(dá)到總生存期的臨床終點(diǎn)往往需要很長的時間初烘。FDA此時可以把藥物在無進(jìn)展生存期(PFS)方面的獲益視為總生存期獲益惑叶,并以此為依據(jù)批準(zhǔn)某個藥品上市,從而縮短新藥的上市時間,讓患者更早獲得極具希望的新藥寓调。近10年(2006-2015)FDA共加速批準(zhǔn)了39個藥品的新藥上市申請(NDA/BLA)。
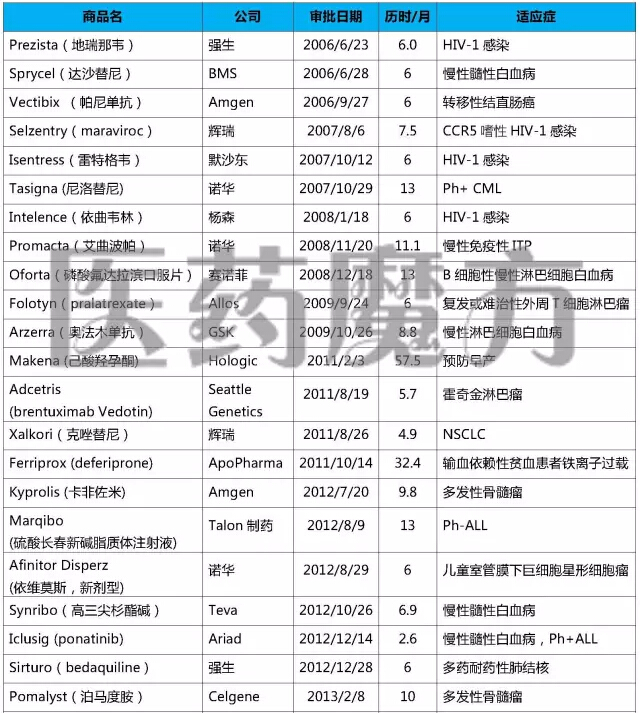
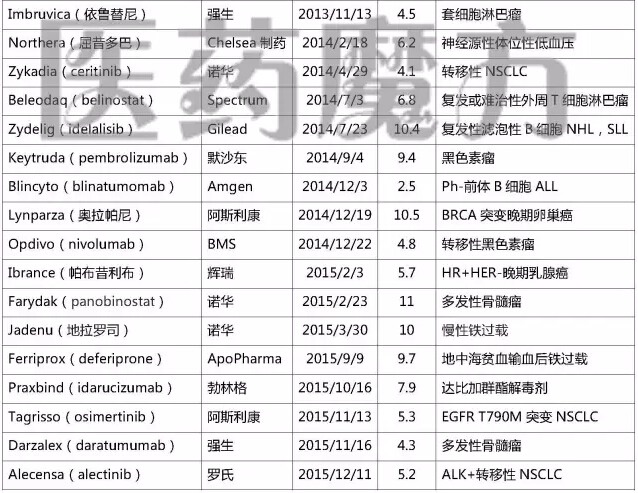
2006-2015年FDA加速批準(zhǔn)的NDA/BLA
?
注:上表僅列入獲得加速批準(zhǔn)的NDA或BLA锄码,不包括加速批準(zhǔn)的sNDA或sBLA
上述表格中“歷時”指FDA從收到申請到做出批準(zhǔn)的時間。經(jīng)過統(tǒng)計(jì)發(fā)現(xiàn)晌涕,在39個以“加速批準(zhǔn)”方式上市的藥品中滋捶,歷時最長的57.5個月,最短的2.5個月余黎。近50%的申請都在6個月內(nèi)完成審批(19個弛镣,49%),超過10個月的申請有9個(23%)才擒。
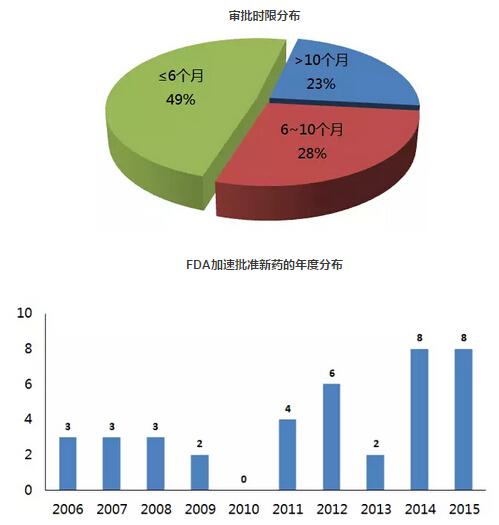
在加速批準(zhǔn)情況下钩裆,制藥企業(yè)在藥品上市后需要繼續(xù)進(jìn)行確證性臨床研究,進(jìn)一步評估藥品的臨床獲益情況善瞧。如果上市后驗(yàn)證了臨床療效图盖,則FDA維持原先的批準(zhǔn)。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 149
149

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 151
151

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 152
152
 熱門資訊
熱門資訊