
 研發(fā)追蹤
研發(fā)追蹤
 2016-02-29
2016-02-29
 4847
4847
來源:醫(yī)藥魔方數(shù)據(jù)??? 2016-2-29
2月17日嘁汞,Catalyst制藥公司宣布收到FDA針對其Firdapse(amifampridine phosphate)NDA的“拒絕申請信“(Refusal to File席赂,RTF)。Firdapse被Catalyst公司開發(fā)用于治療Lambert Eaton肌無力綜合征(LEMS)以及先天性肌無力綜合征(CMS)载易。FDA在RTF中指出Catalyst公司2015年12月提交的申請資料不完整,需要補充更多支持性信息,并未對Firdapse相關臨床數(shù)據(jù)的可接受性做出結(jié)論累榜,也未對Firdapse的療效和安全性做出評價。Firdapse之前曾被FDA授予治療LEMS和CMS的孤兒藥資格以及治療LEMS的突破性藥物資格倘封。
2月23日癣辉,PTC Therapeutics公司宣布收到FDA針對其Translarna (ataluren )NDA的拒絕申請信。Ataluren是first in class的口服性蛋白修復藥物帚萧,用于治療無義突變型杜氏肌營養(yǎng)不良(nmDMD)传起,曾于2014年8月獲得歐盟有條件批準挚雾。FDA在RTF中指出PTC的該項申請資料不完整,無法進入后續(xù)審評流程掺挺。
關于RTF
RTF和完全回復信(CRL)對申請人而言都不是好消息钩氓。區(qū)別在于,CRL是FDA已經(jīng)受理申請人的某項申請狰丝,但是經(jīng)過審評后認為該申請不足以獲得批準脊距,以CRL的形式指出申請中存在的問題。RTF則是FDA在收到申請人遞交的申請后非阿,經(jīng)過初審直接拒絕种诫,該申請不被受理。
RTF的作用在于幫助FDA藥品評價與研究中心(CDER)合理配置審評資源湾关,不要把精力浪費在資料不完整的申請(包括NDA烫饼,sNDA,BLA试读,sBLA)或者原本應該以ANDA形式提交的NDA上面杠纵。CDER認為,RTF可以在更早期提示申請人在研究中存在的重大缺陷钩骇,可以避免審評階段的資源浪費比藻,有利于安全有效的藥物更早獲批上市。關于RTF的更多介紹可點擊“閱讀原文”下載查看FDA官方文件倘屹。
FDA在PDUFA V實施期間表現(xiàn)出史無前例的開放和透明银亲,新藥批準數(shù)量也不斷攀升。生物制藥公司和投資人似乎迎來了新藥開發(fā)環(huán)境無比寬松的年代纽匙,生物技術股的股價也一飛沖天务蝠。不過FDA在過去的1周針對兩個臨床急需藥物發(fā)出RTF似乎也釋放了一個審批趨嚴的信號。
可能是因為審批環(huán)境顯得過于輕松讓申請人開始自得意滿了烛缔,藥品申請資料的提交也開始隨意起來馏段。盡管Catalyst和PTC對外披露FDA僅僅是因為資料不完整而發(fā)出了RTF,但是要知道自從2011年以后践瓷,RTF就是個稀罕物了亭颈,自從PDUFA V于2012年10月生效后FDA僅發(fā)出了3封RTF,如今一周內(nèi)連發(fā)2封RTF絕不是偶然叶刮。RTF的出現(xiàn)頻率在1998-2011年期間開始上升悠蹬,常見原因主要包括臨床數(shù)據(jù)、CMC資料揣响、電子提交文件存在缺陷等簿睦。
2010年以后披露的RTF

?
由上可知,輝瑞、諾華派暴、羅氏等巨頭也都收到過RTF彩淮,想到這里大家可能會對FDA過去1周發(fā)布的RTF不以為然∮焦洌回顧歷史懊潜,Imclone Systems公司的Erbitux在2001年也收到了RTF,其CEO SamWaksal在知道這個壞消息的情況下告知其親戚拋售股票预隆,最終因為證券欺詐鋃鐺入獄乔蜀。
FDA吼一吼,上市公司抖三抖
在宣布收到FDA的RTF之后膳灶,PTC公司的股價在23日跌去62%咱士,另外兩家知名的杜氏肌營養(yǎng)不良(DMD)藥物開發(fā)公司Sarepta和BioMarin的股價也分別跌去7%和4%。
由于DMD是一種進行性疾病轧钓,在不經(jīng)治療的情況下序厉,大多數(shù)患兒會在十幾歲完全喪失行動能力,在二三十歲死亡毕箍。美國大約有1.5萬~2萬DMD患兒弛房,但目前FDA未批準任何治療DMD的藥物。Sarepta和BioMarin為爭奪美國市場首個上市的DMD藥物也是打得不可開交(eteplirsen vs drisapersen)而柑。盡管面臨患者家屬和社會的巨大壓力文捶,FDA此次直接拒絕2個DMD藥物的NDA所表明的態(tài)度也很明確——拒絕受擺布,按我的標準來媒咳!
DMD藥物管線
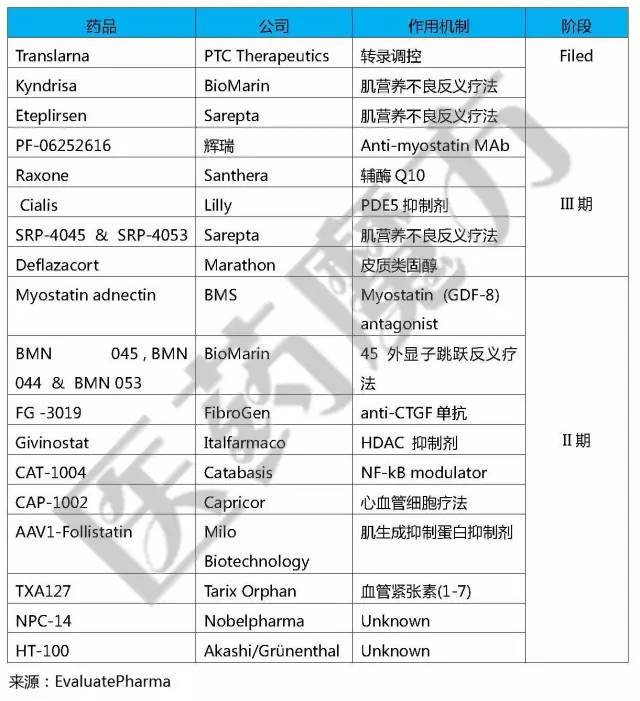

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 149
149

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 151
151

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 152
152