
 研發(fā)追蹤
研發(fā)追蹤
 2016-01-04
2016-01-04
 4508
4508
來源:醫(yī)藥魔方數(shù)據(jù)??? 2015-12-31
2015年FDA共批準45個新藥悯仙,包括33個新分子實體(NME)和12個新生物制品龄毡,創(chuàng)下自1997年以來的歷史新高吠卷。
僅從企業(yè)獲批新藥數(shù)量來看,輝瑞應該算是最大贏家沦零,可能有同學馬上急了祭隔,明明諾華4個,輝瑞才1個路操,這賬怎么算的疾渴?大家可以回想一下“Forest-Actavis-Allergan-輝瑞”這么一條并購關系鏈,加上被Allergan并購的Kythera屯仗,然后比對一下這個表格搞坝,輝瑞可不是收獲了5個新藥嘛~~

從疾病來看,腫瘤依然是新藥產(chǎn)出最大的領域(15)魁袜,其次為內分泌及代謝疾沧椤(9),心血管疾采刚薄(5)仆腐、感染疾病(4)敢铲、精神疾布埂(3)、呼吸疾部迦怼(3)驴涡。
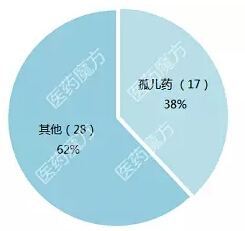
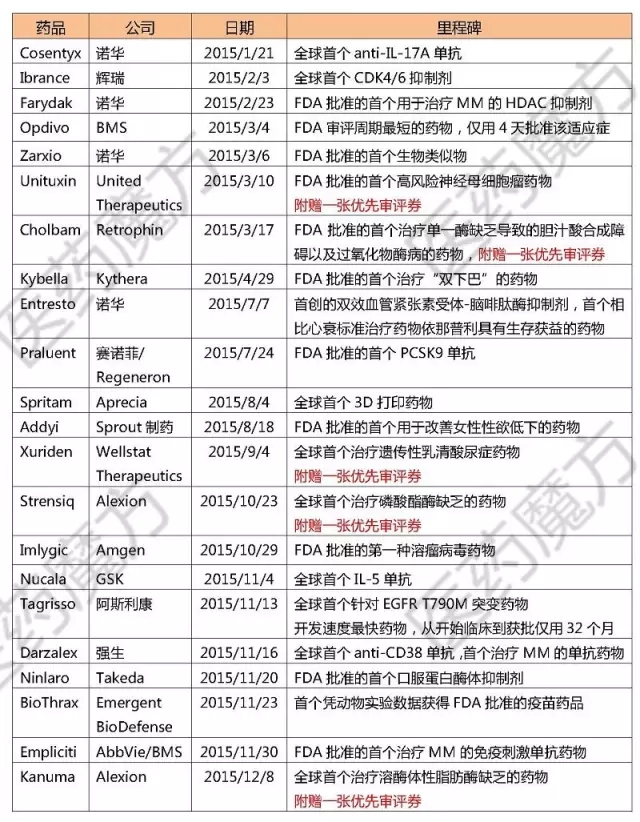
從審批類型上看,45個新藥中有17個被授予孤兒藥資格伊屈。共有21個藥物獲得優(yōu)先審評資格觅符,8個藥物獲得突破性藥物資格翅栖,4個藥物獲得加速批準。
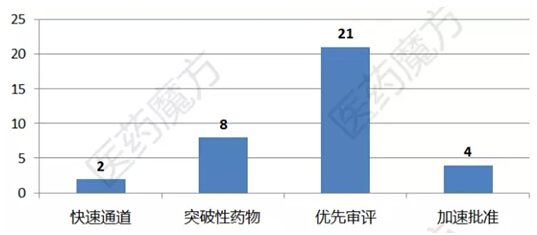
2015年具有里程碑意義的藥物
FDA在2015年表現(xiàn)得更加開放见毒,比如批準了首個生物類似物Zarxio谅褪,批準了首個3D打印藥物Spritam,當然也包括我們在昨天文章中提到的跟兩家公司就“超標簽推廣藥品“達成訴訟和解(2015年全球生物制藥行業(yè)大事記N庠堋)……FDA今年批準的一些具有里程碑意義的藥物如下:
FDA在審批速度上也體現(xiàn)出了高度進取的精神张抄,對于一些臨床需求遠未得到滿足的疾病,FDA可謂不拘一格洼怔,比如加速批準強生的四線多發(fā)性骨髓瘤單抗藥物Darzalex署惯,比預定期限提前了1個月;加速批準阿斯利康用于EGFR靶向治療耐藥的非小細胞肺癌藥物Tagrisso镣隶,比預定期限提前了3個月极谊;基于II期研究數(shù)據(jù)加速批準輝瑞的HR+乳腺癌藥物Ibrance,比預定審批期限提前了1年安岂。對于大熱的PD-1單抗Opdivo轻猖,FDA僅用了4天便批準將其適應癥從黑色素瘤擴大到NSCLC……當然,對于一些帶有玩票意思或者臨床需求相對不那么急切的藥物域那,比如女性偉哥Addyi咙边、雙下巴脂溶針Kybella,FDA還是很守原則地按照標準審評程序處理次员。
??? 對于在罕見兒科疾病藥物開發(fā)方面做出巨大貢獻的企業(yè)败许,FDA也是一律照例打賞,“優(yōu)先審評券“發(fā)得手軟淑蔚。FDA發(fā)得高興檐射,企業(yè)也爭得歡快。比如賽諾菲利用一張優(yōu)先審評券硬生生讓自己PCSK9單抗藥Praluent的批準時間從落后對手5個月加速到比對手提前1個月崔捌,而且在12月18日第2次使用了優(yōu)先審評券來挽救Lantus專利到期的殘局洪防,不得不讓人佩服城里人就是會玩啊~
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 156
156

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 158
158

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 159
159