
 研發(fā)追蹤
研發(fā)追蹤
 2015-12-28
2015-12-28
 4589
4589
來源:醫(yī)藥經(jīng)濟報?? ?2015-12-28
醫(yī)藥市場的繁榮需要強有力的研發(fā)支撐,這是內(nèi)在動力〖虼縱觀全球研發(fā)強度前10位的公司舅狭,研發(fā)投入占比均在10%以上蒋毕,研發(fā)投入的轉(zhuǎn)化成果便是源源不斷的新藥問世仔役。
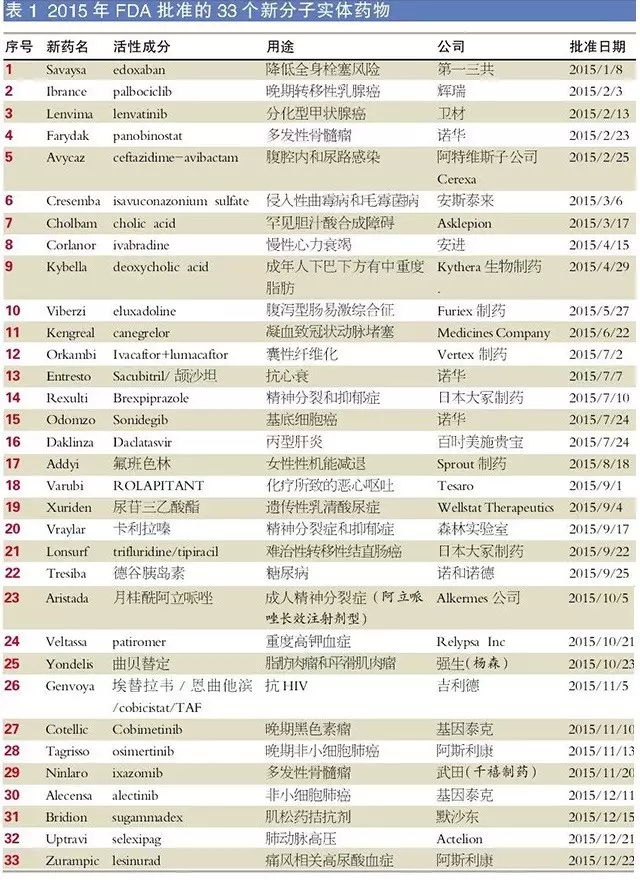
2015年胁赢,FDA共批準了45個新藥砂腰,包括33個新分子實體(NME)和12個生物制品許可申請(BLA)托津,這一數(shù)字高于2014年的41個和2013年的27個叼架,創(chuàng)下近十年來新藥批準數(shù)量的新高颠焦。
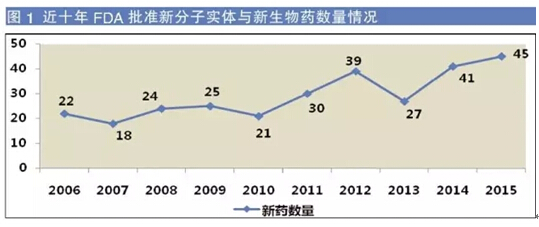
其中,腫瘤治療領(lǐng)域有14個藥物獲得批準跳窖,由此成為獲批藥物最多的治療領(lǐng)域厅肩。諾華2015年共獲批4個藥物螺蜻,成為收獲最多的制藥企業(yè)。獲批新藥數(shù)量龐大對制藥企業(yè)來說是個好兆頭禽制,其中也包括那些發(fā)明和研制多種藥物的小型生物技術(shù)公司剪酵。
根據(jù)FDA官網(wǎng)信息陨否,2015財年FDA的新分子實體(NME)首輪獲批率保持歷史性高位。新藥申請(NDA)和生物制品許可申請(BLA)的整體首次行動獲批率為95%药呜,優(yōu)先審評NDA/BLA申請的首次行動獲批率為93%殃通,標準NDA/BLA的首次行動獲批率為100%。在完成處方藥生產(chǎn)商付費法案(PDUFA)規(guī)定的目標方面访僚,2015年FDA繼續(xù)完成或超越該法案規(guī)定的幾乎所有申請審評目標昔搂。FDA新藥辦公室在編人員在維持小幅增長,確保審評工作的正常開展输拇,在2013財年初為916位全職雇員摘符,2016財年初增加到1014位,但仍低于目前授權(quán)限額1067位全職雇員策吠。

勾畫新藥研發(fā)新版圖
2015年FDA批準的抗腫瘤逛裤、心血管、抗感染三大類新藥分別有14個猴抹、6個和2個带族。

新藥的突破點源自尋找高度未滿足需求的領(lǐng)域◇案抗腫瘤蝙砌、抗感染、心血管是近年來的熱點領(lǐng)域跋理。2015年FDA批準的新藥中择克,有14個抗腫瘤藥和6個心血管藥,都是大類藥物薪介。
抗腫瘤藥祠饺,尤其是抗腫瘤的罕見病用藥被業(yè)界追逐,預(yù)計到2020年草教,腫瘤藥物將增長到1531億美元,復(fù)合增長率達到11.6%舰打。2015年FDA批準的多個抗腫瘤藥物均用于孤兒病適應(yīng)癥经禽,全球至少有40%~45%的投入到抗腫瘤藥物研發(fā)上。
心血管系統(tǒng)重磅新藥將強勢回歸凫荡。2015年批準的心血管系統(tǒng)藥物共有6個可剪,包括諾華的Entresto、安進Repatha功抠、賽諾菲的Praluent登翩、Actelion公司的Uptravi。其中耘昙,預(yù)計Entresto明年的銷售額不是很高沈路,僅為8.4億美元计浮,但2020年銷售額將達到47.59億美元,增速較快加六。這預(yù)示著在后他汀時代沉寂的心血管新藥研發(fā)已經(jīng)復(fù)蘇辫继。
大公司正逐漸回歸抗菌藥研發(fā)。2015年共有2個抗感染藥物獲批俗慈,分別是安斯泰來的Cresemba和阿特維斯子公司Cerexa的Avycaz姑宽。由于耐藥性的發(fā)生,抗菌藥面臨無藥可用的尷尬境地闺阱∨诔担抗菌藥物的世界抗菌新藥研發(fā)周期10~12年,費用>10億美元酣溃,而耐藥菌產(chǎn)生周期僅需2年示血。鑒于抗菌藥研發(fā)的重要性與緊迫性,美國現(xiàn)行抗生素激勵(GAIN)條款作為FDA安全與創(chuàng)新法案的一部分被寫入法律救拉,那些獲得合格傳染病產(chǎn)品(QIDP)認證难审,用于治療嚴重或危及生命感染的藥物,在專利期外還享有額外5年的市場獨占權(quán)亿絮。美國傳染病協(xié)會(IDSA)已和數(shù)十家機構(gòu)合作告喊,目標是在2020年能開發(fā)出10個新的抗生素藥物。
獲批的突破性藥物
2015年通過突破性療法通道審評的藥物有8個派昧,占年度獲批新藥總量的18.2%惯慎。
突破性療法通道是2012年9月FDA首創(chuàng)的一種新藥審評方式,2013年首次使用該審評方式加快藥物審批酬苇。
與快速通道一樣灯忙,突破性療法通道也是為了加速嚴重或致死性疾病藥物的研發(fā)與審批,而二者的不同點在于取得認定所需要提供的證據(jù)蚤件。突破性療法通道的認定需滿足兩個條件:藥物適應(yīng)癥是嚴重或致死性疾病欢兑,以及有證據(jù)顯示目標藥物在某一重要臨床終點上明顯優(yōu)于現(xiàn)有藥物。突破性療法通道的認定比快速通道更加嚴格完株,享有快速通道的所有優(yōu)勢置凤,能得到FDA更加密切的指導(dǎo)。以下是2015年獲得FDA批準的8個突破性藥物颁殃。
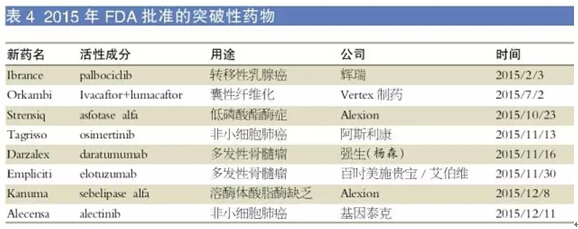
⒈Ibrance(palbociclib)
2月辐杜,輝瑞的突破性乳腺癌藥物Ibrance獲得FDA的加速批準,用作乳腺癌的一線治療显钙。Ibrance是首個細胞周期蛋白依賴性激酶4/6(CDK4/6)抑制劑∧蒙迹現(xiàn)在IBRANCE可與來曲唑聯(lián)合應(yīng)用作為治療ER陽性/HER2陰性絕經(jīng)后轉(zhuǎn)移性乳腺癌的一線治療。
此前,全球醫(yī)藥行業(yè)調(diào)研機構(gòu)GlobalData發(fā)布報告指出展辞,輝瑞CDK4/6抑制劑Ibrance將主導(dǎo)HR+乳腺癌市場奥邮,其2023年的銷售額將達到18.5億美元,而阿斯利康的PARP抑制劑Lynparza將主導(dǎo)三陰乳腺癌(TNBC)市場纵竖。
2Orkambi(lumacaftor+ivacaftor)
7月漠烧,Vertex制藥的Orkambi獲FDA批準,用于12歲及以上CFTR基因存在雙拷貝F508del突變的囊性纖維化(CF)患者靡砌。FDA已授予Orkambi孤兒藥及突破性藥物資格已脓,并通過優(yōu)先審查程序?qū)徟?/span>
Vertex制藥正在轉(zhuǎn)型,該公司在去年9月宣布退出丙肝市場通殃,專注于CF度液。此次Orkambi成功拿到FDA批文,對Vertex而言至關(guān)重要画舌。Vertex將Orkambi的市場定價在25.9萬美元/人/年堕担。由于Orkambi的目標群體是CF群體中最為龐大的雙拷貝F508del群體,因此該藥的商業(yè)前景不可限量曲聂。據(jù)EvaluatePharma預(yù)測霹购,該藥2020年銷售額將達32億美元,成為2015年獲批藥物的最暢銷藥侠呛。
3Strensiq(asfotase alfa)
10月23日贾瞪,FDA批準Alexion制藥的Strensiq作為首款獲得批準的用于圍產(chǎn)期、嬰兒及幼兒期發(fā)作的低磷酸酯酶癥(HPP)的治療藥物披锨。Strensiq獲得突破性治療藥物資格习怒,因為它是首款也是唯一用于圍產(chǎn)期、嬰兒及幼兒期發(fā)作的HPP治療藥物卖寻。
突破性治療藥物項目鼓勵FDA與申請者合作毛咸,通過及時建議與互動溝通,幫助快速推進用于嚴重或危及生命疾病重要新藥的開發(fā)與審評除阐。除了突破性治療藥物資格造星,FDA還授予Strensiq孤兒藥資格,因為這款藥物在美國治療患者人數(shù)不超過20萬的疾病匿贝。預(yù)計Strensiq銷售峰值為5億美元左右搬洪。
4Tagrisso(osimertinib)
11月13日,阿斯利康的Tagrisso經(jīng)FDA加速批準通道獲準上市丁傲,這是治療晚期非小細胞肺癌的第三代TKI類靶向藥物,用于治療表皮生長因子受體(EGFR)T790M突變或?qū)ζ渌?/span>EGFR抑制劑耐藥的晚期非小細胞肺癌审胚。它的問世給更多的肺癌患者帶來生存受益匈勋。Tagrisso還被授予突破療法、優(yōu)先審查資格和孤兒藥的認定。
先前洽洁,湯森路透曾預(yù)測Tagrisso在2019年潛在銷售額為7.61億美元痘系。也有專家預(yù)測,該品若能最終獲批作為EGFR突變非小細胞肺癌的一線用藥饿自,其銷售峰值有望達30億美元汰翠。
5Darzalex(daratumumab)
11月16日,由強生旗下楊森制藥開發(fā)的突破性藥物Darzalex被FDA批準用于治療多發(fā)性骨髓瘤昭雌。FDA做出這一決定的時間比PDUFA規(guī)定的最后期限早了數(shù)月之久复唤。Darzalex是被批準治療多發(fā)性骨髓瘤的第一個單克隆抗體。Darzalex被授予突破性藥物資格烛卧、以及優(yōu)先審評和孤兒藥物認定佛纫。
Darzalex的獲批為患者提供額外的選擇,但這種藥物的治療費用并不便宜总放。第一年治療費用達13.5萬美元左右呈宇。第二年則下降到7.6萬美元。不過侥嫂,強生表示將通過談判為符合要求的患者提供折扣省牍。這一藥物也被市場寄予厚望。
6Empliciti(elotuzumab)
11月30日莽入,由百時美施貴寶(BMS)與艾伯維(AbbVie)聯(lián)合開發(fā)的突破性抗癌藥Empliciti獲得FDA批準淀爆,將與Revlimid/地塞米松聯(lián)合用于已接受一種或多種治療方案的復(fù)發(fā)/難治性多發(fā)性骨髓瘤患者的治療。
Empliciti是FDA批準治療多發(fā)性骨髓瘤的首個也是目前唯一一個免疫刺激單抗藥物年笋。Empliciti已獲得FDA突破性療法認定伍戚、優(yōu)先審批以及孤兒藥資格。2015年FDA共批準了3款治療多發(fā)性骨髓瘤的藥物雌她,另外兩款分別是強生的Darzalex和武田的Ninlaro透汞。
7Kanuma (sebelipase alfa)
12月8日,Alexion制藥的本年度第二個新藥Kanuma獲得FDA批準政用,為首個治療溶酶體酸脂酶癥(LAL-D)藥物薄肉。FDA授予Kanuma孤兒藥資格,因其治療的罕見病在美國患者少于20萬人倘灸。Kanuma同時獲得突破性治療藥物資格某亩,因為它是第一個也是目前唯一可用于嚴重嬰兒疾病LAL缺陷的藥物。FDA還授予Kanuma優(yōu)先審評權(quán)热某。
8Alecensa(alectinib)
12月11日腻菇,羅氏旗下基因泰克的Alecensa獲FDA加速批準,用于既往接受Xalkori(克唑替尼)治療后病情進展或不耐受的間變性淋巴瘤激酶陽性昔馋、轉(zhuǎn)移性非小細胞肺癌患者的治療筹吐。FDA已授予Alecensa孤兒藥地位、突破性藥物資格、優(yōu)先審查資格丘薛。
目前嘉竟,羅氏也正在開展一項頭對頭Ⅲ期研究,研究Alecensa和Xalkori分別一線治療ALK陽性NSCLC的療效和安全性洋侨。該研究如果獲得成功舍扰,將威脅輝瑞抗癌藥Xalkori在ALK陽性肺癌領(lǐng)域的霸主地位。
延伸>>>
還有兩個新紀錄
2015年希坚,有兩個“創(chuàng)紀錄”的不是新分子實體也不是新生物藥的藥物需要特別提出边苹,它們是——百時美施貴寶的Opdivo,以及諾華山德士的Zarxio吏够。
百時美施貴寶的Opdivo犀进,于2015年3月獲批擴展新適應(yīng)癥,用于治療化療后依然進展的轉(zhuǎn)移性鱗狀非小細胞肺癌织扰。它創(chuàng)造了FDA的最快審批記錄膊节,竟只有4個工作日。FDA做出這一決定的時間比其預(yù)定時間提前了三個多月率肉。美國FDA透明而友好的監(jiān)管態(tài)度原拉,幫助加快了新藥上市步伐,進而促進了美股生物醫(yī)藥的活躍剑三。
諾華旗下山德士的Zarxio(Neupogen堵套,非格司亭),2015年3月獲批矩汪,這是FDA首個批準的生物仿制藥端皮。Neupogen最早在1991年獲得FDA批準用于治療5種情況的中性粒細胞減少。受專利過期的影響拒凝,Neupogen的銷售額在過去幾年逐年下降腰凫,2014年全球銷售額僅12億美元。Zarxio獲批在美國上市銷售的預(yù)期空間也有所限制牢裳,主要因為生物仿制藥和原研藥在價格上的優(yōu)勢不太大逢防,通常只有20%~30%,而且本次FDA沒有批準其與原研藥的可互換性蒲讯。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 157
157

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 159
159

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 160
160