
 研發(fā)追蹤
研發(fā)追蹤
 2015-12-03
2015-12-03
 4391
4391
來源:新康界??? 2015-12-03
2015年10月份美國FDA共審批通過15種新藥,1類新分子實(shí)體藥物3個凯沪; 新生物藥物2個眼姐;3類新劑型藥物5個皮获;4類新組合物1個毛雇; 5類藥物新規(guī)格或新生產(chǎn)商4個择卦。
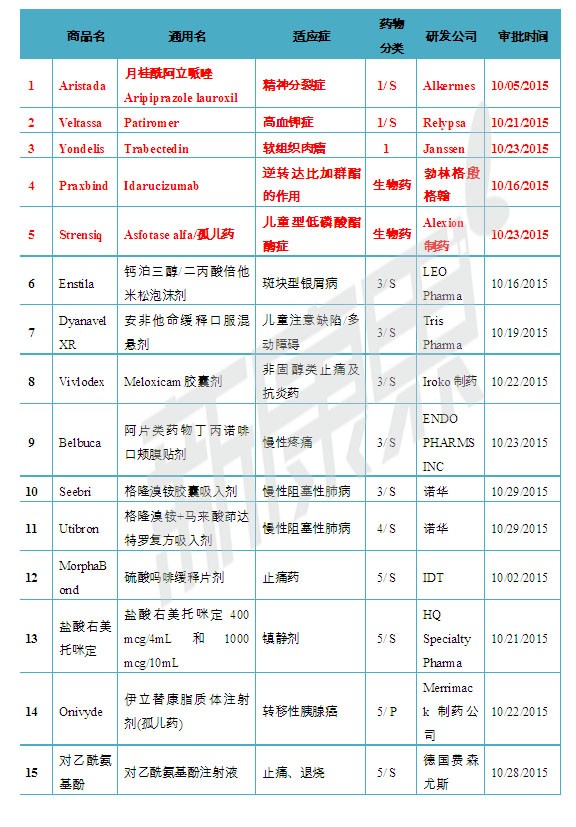
表1 2015年10月份美國FDA審批通過新藥
注:1)化學(xué)新藥分類:1類新分子實(shí)體化合物惊也;3類新劑型;4類新組合物慨即; 5類藥物新規(guī)格或新生產(chǎn)商腿扒;2)審批分類:P優(yōu)先評審昼牛;S常規(guī)評審
一、精神分裂癥新分子實(shí)體藥物 Aristada
2015年10月05日康聂,美國FDA批準(zhǔn)了Alkermes公司的新分子實(shí)體藥物Aristada(Aripiprazole lauroxil贰健,月桂酰阿立哌唑)上市。Aristada為緩釋注射劑恬汁,用于精神分裂癥患者的治療伶椿。Aristada注射劑共有三種規(guī)格,分別含有月桂酰阿立哌唑441 mg氓侧、662 mg 和882 mg脊另。精神分裂患者可每月注射441 mg、662 mg 和882 mg 的Aristada一次,或每6周注射882 mg 的Aristada一次偎痛。Aristada最常見的不良反應(yīng)為靜坐不能烘豌。Aristada帶有黑框警告,提示患者和醫(yī)生Aristada沒有獲得批準(zhǔn)用于老年癡呆相關(guān)精神病的治療看彼,Aristada超適應(yīng)征治療老年癡呆相關(guān)精神病時或升高死亡風(fēng)險廊佩。
二、高血鉀癥新分子實(shí)體藥物Patiromer
2015年10月21日靖榕,美國FDA批準(zhǔn)了Relypsa公司的新分子實(shí)體藥物Veltassa(Patiromer)上市痴坦,用于高血鉀癥的治療。Patiromer的作用機(jī)制是結(jié)合胃腸道中的鉀從而降低鉀的吸收翎襟,Patiromer為口服粉末狀藥物遏谭,共有8.4克, 16.8克和25.2克三種規(guī)格。Patiromer帶有黑框警告寿针,在臨床使用時Patirome由于能與多種藥物結(jié)合思樟,從而降低了其他藥物的吸收減弱藥效。因此黑框警告中建議Patiromer和其他任何口服藥物同服時径卜,應(yīng)間隔6小時以上晦哺。
三、軟組織肉瘤新分子實(shí)體藥物Trabectedin
2015年10月23日芽茄,美國FDA通過優(yōu)先審批途徑批準(zhǔn)了Janssen公司的新分子實(shí)體藥物Yondelis(Trabectedin)上市贩挨,用于不可切除或轉(zhuǎn)移、曾接受過含一種蒽環(huán)類藥物化療的脂肪肉瘤和平滑肌肉瘤患者的治療章神。Trabectedin為烷化劑屬于細(xì)胞毒類藥尤桃,臨床使用中常見的不良反應(yīng)包括惡心、疲勞爷耀、嘔吐甘桑、便秘、食欲下降歹叮、腹瀉等跑杭。
四、新生物藥物Idarucizumab
2015年10月16日盗胀,美國FDA批準(zhǔn)了勃林格殷格翰公司的新生物藥物Praxbind(Idarucizumab)上市艘蹋,用于接受抗凝藥達(dá)比加群酯治療的患者,在急診手術(shù)票灰、介入性操作女阀、或者出現(xiàn)危及生命或無法控制的出血并發(fā)癥,需要逆轉(zhuǎn)達(dá)比加群酯的抗凝效應(yīng)時使用屑迂。Idarucizumab是一種人源性單克隆抗體片段(Fab)浸策,臨床使用時只與達(dá)比加群酯分子特異性結(jié)合,可中和其抗凝效應(yīng),不會干擾凝血級聯(lián)庸汗。
五惫确、罕見病新生物藥物Strensiq
2015年10月23日,美國FDA批準(zhǔn)了Alexion制藥公司的新生物藥物Strensiq(Asfotase alfa)上市也隧,用于兒童型低磷酸酯酶癥的治療流沦。低磷酸酯酶癥為罕見病,是由 ALPL 基因突變引起其編碼的組織非特異性堿性磷酸酶活性降低引起的遺傳性系統(tǒng)性疾病絮商,以骨骼及牙齒硬組織發(fā)育不良以及血清堿性磷酸酶(ALP)活性偏低為特點(diǎn)邢窜。Strensiq為一種酶Asfotase alfa,可以通過替換缺陷的堿性磷酸酶铆韭,促進(jìn)提高酶底物水平丘隙,提升機(jī)體骨礦物質(zhì)化的能力,進(jìn)而避免患者出現(xiàn)骨骼及其他器官嚴(yán)重異常和早夭菜涯。
美國FDA審批新藥主要是根據(jù)藥物化學(xué)類型和治療潛能來進(jìn)行分類的伶离。新藥按化學(xué)類型主要分為:1類新分子實(shí)體化合物(NME),創(chuàng)新性最強(qiáng)拣末。指在美國從未作為藥品批準(zhǔn)或銷售的活性成分诺教,可以是單一成分,也可以是立體異構(gòu)混合物中的一部分杠滓;2類新的衍生物丛剿。從已上市的活性成分(即所謂“專利”藥)化學(xué)衍生而來,即已在美國上市的活性成分的酯臊岸、鹽或其它非共價鍵衍生物,或者是去修飾基團(tuán)的母體化合物未在美國批準(zhǔn)上市的;3類新劑型尊流。含有已上市活性成分的新劑型或新處方帅戒,其適應(yīng)癥可以與上市產(chǎn)品相同,也可以不同崖技;4類新組合物逻住。含有兩種或兩種以上已上市的活性成分的品種,上市產(chǎn)品中尚無這種組合迎献;5類藥物新規(guī)格或新生產(chǎn)商瞎访;6類新適應(yīng)癥。由同一家公司或其他公司在美國批準(zhǔn)或上市的具有新用途的復(fù)制品吁恍;7類已上市但未經(jīng)NDA批準(zhǔn)的藥品扒秸。適應(yīng)癥已與上市產(chǎn)品相同,也可不同冀瓦;8類變?yōu)榉翘幏剿帲?/span>9類(New indication submitted as distinct NDA - consolidated with original NDA after approval)伴奥; 10類適應(yīng)癥不同的新的新藥申請。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 166
166

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 168
168

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 170
170
 熱門資訊
熱門資訊